益肾泄浊方对高糖环境下人肾小球内皮细胞的保护作用及机制*
王宪赟,黄芳,张小鹿,王怡
上海中医药大学附属岳阳中西医结合医院,上海 200437
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的三大微血管并发症之一,是导致终末期肾病的主要原因之一,目前尚无有效方法干预其进展。研究证实,肾小球内皮细胞损伤在DN的发生发展中起重要作用[1]。肾小球内皮细胞结构比较特殊,与一般的毛细血管内皮细胞不同,它具有特殊的窗孔、基底膜和糖萼。作为肾小球滤过屏障的一个关键组成部分,肾小球内皮细胞承载着更高的血流压力,因此更容易受到损伤;其次,肾小球内皮细胞与系膜细胞和基底膜紧密相连,因此肾小球内皮细胞的损伤可能引起系膜细胞的病变[2]。
我科前期研究发现,糖尿病大鼠微血栓形成与纤维蛋白原样蛋白2(fibrinogen-like protein2,fgl2)凝血酶原酶mRNA高表达有关,益肾泄浊方可通过降低DN大鼠肾脏局部Fgl2凝血酶原酶,改善肾脏微循环,有效控制血肌酐水平。该方是本科长期应用治疗慢性肾衰的经验方,对原发病是糖尿病的患者疗效更佳。既往研究证实,糖尿病大鼠肾小球内皮细胞可见fgl2凝血酶原酶的阳性表达,且与肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)密切相关[3]。因此,本研究选择高糖环境下培养的人肾小球内皮细胞,用不同浓度益肾泄浊方含药血清干预,通过检测干预前后肾小球内皮细胞的增殖情况、TNF-αmRNA、fgl2凝血酶原酶mRNA等指标,观察益肾泄浊方对高糖环境下内皮细胞的保护作用及相关机制,并探讨肾小球内皮细胞免疫凝血机制,证实微型癥积是导致DN内皮损伤的关键环节,为DN的中西医结合治疗提供更多理论依据。
1 材料
1.1 实验细胞与动物人肾小球内皮细胞(human renal glomerular endothelial cells,HRGECs)(美国ScienCell研究实验室,目录号:4000)。SPF级雄性SD大鼠20只,体质量(200±15)g,购自上海西普尔-必凯实验动物有限公司,实验动物使用许可证编号:SYXK(沪)2016-0004,实验前适应性饲养1周。
1.2 药物与试剂益肾泄浊方颗粒剂(黄芪20 g,生地黄10 g,淫羊藿10 g,太子参10 g,酒黄精10 g,红花12 g,烫水蛭6 g,熟大黄12 g,江阴天江药业有限公司,批号:1603028、1604121、1603134、1603038、1602113、1602110、1510136、1512126)。D-葡萄糖(上海生工生物工程有限公司,货号:55-99-7);内皮细胞培养基(endothelial cell medium,ECM,美国ScienCell研究实验室,货号:1001);胎牛血清(美国Gibco公司,货号:16000-044);CCK-8试剂盒(美国Signalway Antibody公司,货号:CP002);SYBR Green PCR试剂盒、Trizol试剂(美国Thermo Fisher Scientific公司,货号:K0223、1596-026);胰蛋白酶(北京索莱宝科技有限公司,货号:T1300-100);逆转录试剂盒(加拿大Fermentas公司,货号:K1622);RMPI-1640培养液(美国Hyclone公司,货号:SH30809.01B);TNF-α、fgl2凝血酶原酶ELISA试剂盒(中国X-Y生物技术公司,货号:B1120、B17641)。
1.3 仪器XDS-500C型显微镜(上海蔡康光学仪器有限公司);CKX41/SF型倒置相差显微镜(日本Olympus公司);DNM-9602型酶标仪(北京普朗新技术有限公司);Thermo Forma 3111型二氧化碳培养箱、ABI-7300型荧光定量PCR仪(美国Thermo Fisher Scientific公司);MDF-U71V型超低温冰箱(日本SANYO公司)。
2 方法
2.1 益肾泄浊方含药血清的制备将20只健康雄性SD大鼠按照体质量排序,采用随机数据表分为空白组和药物组,每组10只。中药颗粒剂的给药剂量以60 kg成人药量的20倍计算,给药体积为10 mL·kg-1,即药物浓度为3 g·mL-1,冷藏备用。药物组以益肾泄浊方灌胃,空白组给予等体积的蒸馏水灌胃,早、晚各1次,灌胃3 d。末次灌胃前禁食不禁水2 h,灌胃1 h后大鼠腹主动脉取血,分离血清,过滤除菌,-20℃冻存备用。
2.2 细胞培养与分组HRGECs用含10%胎牛血清的ECM培养基,在37℃、5%CO2培养箱中培养。细胞贴壁生长至80%~90%融合后,进行传代培养。弃上清液,加入0.25%胰蛋白酶1 mL,37℃、5%CO2培养箱中消化3 min,在倒置显微镜下观察细胞形态。当细胞质回缩、细胞间隙增大时,弃去消化液,加入新鲜培养液6 mL,用吸管吸取培养皿内培养液,反复轻柔吹打皿壁细胞,至细胞悬浮,将悬液分至2个培养皿,补足培养液,于37℃、5%CO2培养箱中培养。实验使用传代3代的细胞,当细胞处于对数生长期时,分为空白组、模型组、空白血清对照组、益肾泄浊方含药血清低剂量组、益肾泄浊方含药血清高剂量组。除空白组外,其余4组给予含30 mmol·L-1D-葡萄糖的ECM培养基高糖诱导2 h后,空白血清对照组、益肾泄浊方含药血清低剂量组、益肾泄浊方含药血清高剂量组分别加入10%空白血清、10%益肾泄浊方含药血清、20%益肾泄浊方含药血清,培养24 h、48 h后进行相应检测。
2.3 细胞增殖检测将处于对数生长期的细胞经胰蛋白酶消化后,调整细胞密度为(1~5)×104mL-1。分别取100μL至96孔培养板中,设置3个复孔,以100μL培养液做空白对照,37℃培养过夜。各组细胞干预培养24 h、48 h后,每孔加入100μL CCK-8溶液(CCK-8与无血清培养基的体积比为1∶10),在37℃、5%CO2培养箱中孵育1 h。用酶标仪测定450nm波长处的吸光度,并记录OD值。实验重复3次。
2.4 ELISA法检测HRGECs上清中TNF-α、fgl2凝血酶原酶的水平HRGECs培养24 h及48 h后,转移至无菌管中,离心20 min左右(3 000 r·min-1,离心半径:6 cm),收集细胞上清。严格按照试剂盒操作说明书操作,进行稀释加样、温育、配液、洗涤、加酶、温育、洗涤、显色、终止,最后以空白孔调零,450 nm波长处测量各孔的吸光度(OD值),测定应在加终止液后15 min以内进行。实验重复3次。
2.5 RT-PCR检测HRGECs中TNF-α及fgl2凝血酶原酶mRNA表达收集培养24 h、48 h后经处理的细胞,用Trizol一步法抽取细胞总RNA。采用逆转录试剂盒将总RNA逆转录成cDNA,按照试剂说明书步骤进行RT-PCR检测,以GAPDH引物为内参。扩增条件:预变性:95℃10 min;PCR反应:95℃15 s,60℃45 s,40个循环。数据采用仪器自带软件分析TNF-α、fgl2凝血酶原酶基因在细胞中的相对表达量。引物由通用生物系统(安徽)有限公司合成,序列见表1。
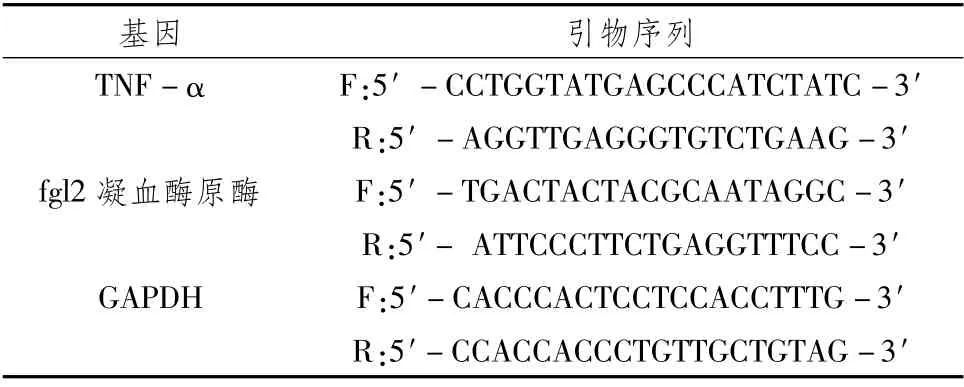
表1 引物序列
2.6 统计学分析应用SPSS 20.0统计软件对实验数据进行统计分析,计量资料以平均值±标准差(±s)表示。数据符合正态分布且方差齐时,多组间比较采用单因素方差分析;若数据服从双变量正态分布,采用Pearson相关分析;若数据不服从双变量正态分布,采用Spearman相关分析,以P<0.05为差异具有统计学意义。
3 结果
3.1 益肾泄浊方含药血清对高糖环境下人肾小球内皮细胞增殖的影响与同期空白组比较,模型组细胞增殖率明显降低(P<0.05),说明高糖环境能减弱HRGECs的增殖活性。与同期模型组比较,空白血清对照组细胞增殖无明显变化(P>0.05);益肾泄浊方含药血清低、高剂量组细胞增殖活性明显提高(P<0.05)。说明益肾泄浊方能明显提高高糖环境下HRGECs的增殖活性。见表2。
表2 不同时间各组细胞增殖变化 (±s,n=9,%)

表2 不同时间各组细胞增殖变化 (±s,n=9,%)
注:与同期空白组比较,*P<0.05;与同期模型组比较,△P<0.05;与同期空白血清对照组比较,#P<0.05
组别24 h 48 h空白组48.10±0.90 82.00±1.00模型组 39.30±0.70*50.20±1.00*空白血清对照组 39.80±1.10 50.70±1.50益肾泄浊方含药血清低剂量组43.40±1.50△#68.40±0.70△#益肾泄浊方含药血清高剂量组46.30±0.90△#68.80±0.90△#
3.2 益肾泄浊方含药血清对高糖环境下人肾小球内皮细胞上清中TNF-α、fgl2凝血酶原酶的影响
与同期空白组比较,模型组HRGECs上清中TNF-α、fgl2凝血酶原酶的水平显著升高(P<0.05)。与同期模型组比较,空白血清对照组细胞上清中TNF-α、fgl2凝血酶原酶的水平无明显变化(P>0.05);益肾泄浊方含药血清低、高剂量组细胞上清中TNF-α和fgl2凝血酶原酶的水平显著降低(P<0.05)。见表3。
表3 不同时间各组细胞上清中TNF-α、fgl2凝血酶原酶的变化 (±s,n=9,ng·L-1)

表3 不同时间各组细胞上清中TNF-α、fgl2凝血酶原酶的变化 (±s,n=9,ng·L-1)
注:与同期空白组比较,*P<0.05;与同期模型组比较,△P<0.05;与同期空白血清对照组比较,#P<0.05
组别 TNF-α fgl2凝血酶原酶24 h 48 h空白组 225.94±11.21 213.86±9.44 1 965.98±164.71 2 1 24 h 48 h 01.39±98.43模型组 549.71±30.99* 653.22±51.00* 5 099.66±177.86* 6 055.65±240.59*空白血清对照组 547.79±28.89 635.85±18.91 4 930.91±169.07 5 946.70±380.47益肾泄浊方含药血清低剂量 418.61±17.08△# 350.48±14.60△# 4 248.38±157.30△# 3 611.08±165.65△#益肾泄浊方含药血清高剂量 356.44±23.07△# 298.04±15.31△# 3 675.25±156.75△# 2 980.63±91.67△#
3.3 益肾泄浊方含药血清对高糖环境下人肾小球内皮细胞TNF-αmRNA、fgl2凝血酶原酶mRNA表达的影响与同期空白组比较,模型组HRGECs中TNF-αmRNA及fgl2凝血酶原酶mRNA的表达明显升高(P<0.05)。与同期模型组比较,空白血清对照组HRGECs中TNF-αmRNA及fgl2凝血酶原酶mRNA的表达无明显变化;益肾泄浊方含药血清低、高剂量组HRGECs中TNF-αmRNA及fgl2凝血酶原酶mRNA的表达明显降低(P<0.05)。见表4。
表4 各组不同时间点TNF-αmRNA、fgl2凝血酶原酶mRNA含量变化 (±s,n=9,%)
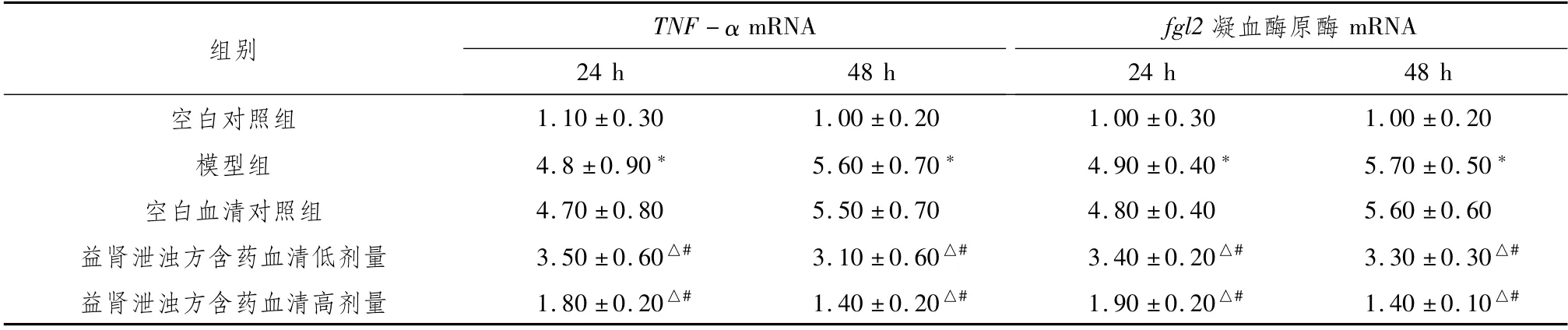
表4 各组不同时间点TNF-αmRNA、fgl2凝血酶原酶mRNA含量变化 (±s,n=9,%)
注:与同期空白组比较,*P<0.05;与同期模型组比较,△P<0.05;与同期空白血清对照组比较,#P<0.05
组别 TNF-αmRNA fgl2凝血酶原酶mRNA 24 h 48 h空白对照组24 h 48 h 1.10±0.30 1.00±0.20 1.00±0.30 1.00±0.20模型组 4.8±0.90* 5.60±0.70* 4.90±0.40* 5.70±0.50*空白血清对照组 4.70±0.80 5.50±0.70 4.80±0.40 5.60±0.60益肾泄浊方含药血清低剂量 3.50±0.60△# 3.10±0.60△# 3.40±0.20△# 3.30±0.30△#益肾泄浊方含药血清高剂量 1.80±0.20△# 1.40±0.20△# 1.90±0.20△# 1.40±0.10△#
3.4 人肾小球内皮细胞TNF-α与fgl2凝血酶原酶的相关性分析采用Pearson相关分析对肾小球内皮细胞上清中TNF-α与fgl2凝血酶原酶的水平进行相关性分析,发现肾小球内皮细胞上清中TNF-α与fgl2凝血酶原酶的表达呈正相关性;采用Pearson相关分析对肾小球内皮细胞中TNF-α mRNA与fgl2凝血酶原酶mRNA的表达进行相关性分析,发现肾小球内皮细胞TNF-αmRNA与fgl2凝血酶原酶mRNA的表达呈正相关关系。表明肾小球内皮细胞的免疫凝血可能由TNF-α介导。见表5。
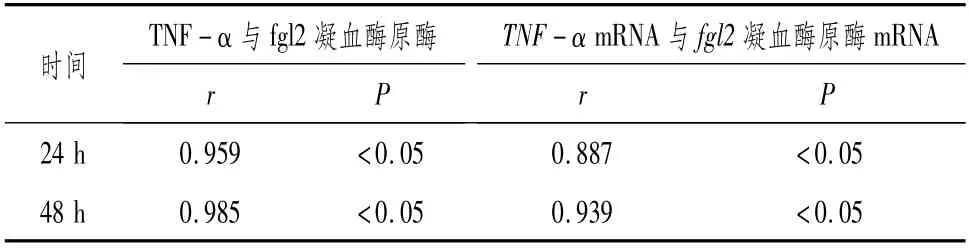
表5 人肾小球内皮细胞TNF-α与fgl2凝血酶原酶的相关性分析 (x¯±s)
4 讨论
中医认为,DN的病机为本虚标实,在临床辨证中,又分为气阴两虚、脾肾亏虚、瘀浊阻络等,其中,“瘀阻肾络”是DN发病的关键因素。现代医学研究表明,DN的发病过程中,肾小球内皮细胞损伤导致微循环障碍,从而引起肾小球硬化是其主要发病原因[4],这与中医理论中的“瘀阻肾络”理论相似。
目前,临床上治疗DN多以益气养阴、健脾补肾、化瘀泄浊为主,在防治患者肾功能恶化、改善患者临床症状等方面取得了一定的疗效。益肾泄浊方是我科治疗DN的常用经验方,主要由黄芪、太子参、淫羊藿、酒黄精、生地黄、红花、炙水蛭、熟大黄等组成。此方权衡气血阴阳,补泻兼施,滋温并用,其中黄芪、太子参大补元气、益气生血,淫羊藿温补元阳,黄精滋养肾阴,生地黄养阴生津,红花、水蛭祛瘀通络,大黄荡涤积滞血中秽浊之邪,各药并用,共奏益气补肾、化瘀泄浊之功,在改善肾脏微循环及DN的早期治疗中收获良效。
现代药理学研究表明,黄芪能通过降低甘油三酯(triglyceride,TG)、胆固醇(cholesterol,TC)、内皮素-1(endothelin-1,ET-1),提高一氧化氮(nitric oxide,NO)、降钙素基因相关肽(calcitonin gene related peptide,CGRP),降低早期DN患者的尿白蛋白排泄率来保护肾脏功能,其作用独立于降血压及降血糖之外[5-8]。研究发现,太子参多糖能升高DN大鼠血清消脂素水平,降低TNF-α水平及DN大鼠的血脂及肾脏指数,通过多途径发挥治疗作用,从而起到肾脏保护的作用[9-10]。牛效清等[11-13]发现,淫羊藿水煎剂可以降低血透患者血清TNF-α水平,保护DN大鼠内皮细胞,改善其肾动脉舒缩功能,发挥肾功能保护作用。黄精具有降血糖、降血脂、调节免疫、抗炎等作用,可有效控制血糖及保护肾脏的作用[14]。《神农本草经》中记载生地黄能“逐血痹”。现代药理研究表明,生地黄具有抗炎及调节免疫的功能。吕高红等[15]研究发现,生地黄具有促进血管内皮细胞增殖的作用,阻止DN的发生发展。《本草纲目》记载红花有“活血、润燥、止痛、散肿、通经”的作用。而现代药理研究表明,红花可以明显降低血液流变学异常患者的血黏度,进而改善其血液流动性,还可以通过抑制DN大鼠肾脏的氧化应激反应,下调细胞外基质蛋白的表达,起到肾脏保护的作用,进而延缓DN的发生与发展。除此之外,红花能通过抗纤维化、降血脂、降尿蛋白、抑制细胞凋亡、抗炎等途径来保护肾脏[16-19]。水蛭具有拮抗类炎性介质的作用[20-21],能高效清除体内循环免疫复合物,从而有效调节机体的免疫功能;同时能明显减少纤维蛋白相关抗原沉积于肾小球内,改善肾小球内皮细胞增殖,延缓肾小球硬化,从而减少蛋白尿、纠正低蛋白血症,保护肾功能。熟大黄主要通过抗炎、抗氧化、改善血液高凝状态、改善微循环、抗纤维化等方面来保护糖尿病引起的肾脏损伤[22-25]。
我科前期动物实验证实,益肾泄浊方可通过调控血脂、血纤维蛋白原,减少DN大鼠肾脏局部fgl2凝血酶原酶、转化生长因子-β1(transforming growth factor-β1,TGF-β1)的合成和释放,增加DN大鼠体质量,有效控制血糖、血肌酐水平,改善肾功能。
肾小球内皮细胞损伤在DN的发生发展过程中起到相当关键的作用,其位于血管和淋巴管内表面上,是一层连续排列的扁平内皮细胞[26],并布满窗孔,存有基底膜和糖萼[27-28],是肾小球滤过屏障的重要部分,在肾小球凝血、免疫和炎症反应中均起到重要的调控作用。研究表明,高糖环境下HRGECs发生病变可能的机制是损伤的肾小球内皮细胞通过激活凝血系统,导致微血栓形成,同时释放出大量生物活性物质,改变肾脏局部的血流动力学,提高肾脏血管内皮通透性,从而出现一系列相关的病理变化[29]。SU等[30]发现,2型糖尿病大鼠肾小球内皮细胞中fgl2凝血酶原酶的阳性表达,可导致肾脏微血栓的形成,且与TNF-α密切相关。
TNF-α是分子量为34 kDa的跨膜同源三聚体蛋白,其主要通过浸润T细胞和单核细胞/巨噬细胞合成,但几乎所有的肾脏细胞,包括肾小球系膜细胞、足细胞、肾小球内皮细胞和肾小管细胞都能够产生TNF-α[31]。在肾脏固有细胞中,高血糖和糖基化终产物可以诱导TNF-α的产生,导致TNF-α在DN患者的血清、尿液中均有升高,且其浓度的变化可以在DN病程中体现。本研究发现,益肾泄浊方含药血清能降低细胞上清中TNF-α的水平,减少细胞TNF-αmRNA的表达。
fgl2凝血酶原酶是一种分子量近70000 kDa的Ⅱ型膜蛋白,属于纤维蛋白原家族,是新近发现的一种促凝因子,参与微血栓的形成。fgl2凝血酶原酶是一种直接激活凝血酶原的凝血因子,可以直接催化凝血酶原转化为凝血酶而启动凝血过程,是一条独立的凝血途径,同时,它可能还具有黏附相关的细胞活性因子样作用并参与肠黏膜固有层免疫细胞的更新等作用[32]。fgl2凝血酶原酶主要表达于巨噬细胞、血管内皮细胞、胎儿滋养层细胞和蜕膜基质细胞等,但在人体各脏器中的表达强弱不同。fgl2凝血酶原酶的表达只在病理情况下增强,即只有在巨噬细胞和血管内皮细胞等免疫活性细胞被活化时才出现高表达,从而启动特异性凝血过程。因此,LEVY等[33]将fgl2凝血酶原酶的促凝途径称为“免疫凝血”。汪艳等[3]发现,DN大鼠肾小球毛细血管内皮细胞中可见fgl2凝血酶原酶阳性表达,提示fgl2凝血酶原酶介导的凝血途径在促进糖尿病肾脏微血栓形成和肾病微血管病变的发展中具有重要作用。本研究发现,益肾泄浊方含药血清能降低细胞上清fgl2凝血酶原酶的水平,减少细胞fgl2凝血酶原酶mRNA表达。
已有研究表明,TNF-α可介导fgl2凝血酶原酶在内皮细胞中转录[34],同时在2型糖尿病大鼠肾脏中也发现TNF-α与fgl2凝血酶原酶的表达呈正相关关系。在本研究中,无论是细胞上清中的TNF-α和fgl2凝血酶原酶的水平还是细胞中TNF-αmRNA和fgl2凝血酶原酶mRNA的表达,两者都呈正相关关系,与既往研究结果一致。推测,在高糖环境下,HRGECs功能受损后可引起TNF-α等炎症介质释放,使fgl2凝血酶原酶mRNA特异性表达,从而导致肾脏局部凝血功能障碍,产生高凝状态,形成微血栓,影响细胞屏障功能、增加细胞通透性并破坏膜的稳定性,加速肾脏纤维化过程。
综上所述,益肾泄浊方含药血清可提高高糖环境下人肾小球内皮细胞的增殖能力,降低细胞上清中TNF-α及fgl2凝血酶原酶的水平,下调TNF-α mRNA及fgl2凝血酶原酶mRNA的特异性表达,保护内皮细胞,且TNF-α及fgl2凝血酶原酶的水平及mRNA的表达均成正相关关系,表明肾小球内皮细胞的免疫凝血可能由TNF-α介导。

