锰氧化物的合成及在锂离子电池中的应用进展
俞明浩,顾梦旋,吴正颖,孙林兵
(1 苏州科技大学材料科学与工程学院,江苏 苏州 215009;2 南京工业大学化工学院,江苏 南京 211816)
过渡金属氧化物具有来源丰富、理论比容量高且绿色环保等特点,因此在锂离子电池负极材料中有着良好的发展前景。2000年Poizot等[1]首次提出了过渡金属可以和Li+发生可逆反应,从而实现Li+的储存和释放。目前,作为锂离子负极材料研究较多的过渡金属氧化物主要是铁基和锰基氧化物。锰在自然界中的储量位于过渡金属第三位,仅次于铁和钛,主要以软锰矿的形式存在。锰元素的价层电子排布为3d54s2,具有多种化合价,包括+2、+3、+4、+6、+7价。因此,锰可以形成多种价态的氧化物,比如MnO、Mn2O3、Mn3O4、MnO2,它们的主要晶体结构如图1所示[2]。MnO是草绿色或灰绿色立方晶系晶体,是一种岩盐型结构的氧化物,晶体结构与NaCl相同,即每个亚锰离子周围有6 个氧,每个氧周围也有6 个亚锰离子。Mn2O3是黑色立方晶系晶体,其基本结构是锰氧八面体[MnO6],通过[MnO6]八面体共用八面体角的一个或两个氧原子方式连接形成;Mn3O4是棕黑色四方晶系晶体,属于尖晶石结构,Mn3+和Mn2+离子分别占据尖晶石结构的八面体和四面体位置。在众多锰氧化物中,MnO2在自然界中的储量最多,MnO2的主要基本单元也是[MnO6]八面体,[MnO6]八面体之间通过共用顶点的方式可以形成6 种不同晶体结构的MnO2,即α-MnO2、β-MnO2、γ-MnO2、ε-MnO2、δ-MnO2、λ-MnO2。图1中列出了3种主要的MnO2晶体结构。

图1 几种主要锰氧化物晶体结构示意图[2]
在用作锂离子电池负极材料时,锰氧化物由于具有相对低的转换电势、小的电压滞后、资源丰富、环境友好等特点而具有很大的吸引力,并且锰氧化物均具有很高的理论比容量[3](MnO=755mA·h/g、Mn2O3=1018mA·h/g、Mn3O4=937mA·h/g、MnO2=1232mA·h/g),因此它们被认为是非常有前途的石墨负极替代品。当然,锰氧化物在用作锂离子电池负极材料时也存在以下问题:①能量密度不够高,充放电过程的不可逆导致首圈库仑效率低;②循环过程中易发生锰金属团聚现象,同时体积膨胀导致材料稳定性降低、电池容量减小、循环性能变差;③较低的电导率导致电子传输受阻,而且体积变化引起的材料粉化也增大了电子的运输难度,使电池倍率性能下降。
目前的研究主要采取以下两种策略来解决上述问题:①块体锰氧化物维度的减小——构筑锰氧化物的纳米颗粒、纳米片、中空或多孔纳米结构等。电极材料尺寸的减小和形貌结构的调控可以缩短锂离子的扩散路径,改善电极和电解质的接触,并且有效抑制由Li+嵌入/脱出引起的自聚集。②引入导电基质,构筑复合结构,以锰氧化物和碳素类材料共组装的复合材料为主。碳素类材料的引入一方面可以增强材料的导电性,另一方面还能抑制活性组分的颗粒粉碎,减少电极和电解质之间的不良副反应。本文也将从这两个方面来总结锰氧化物近几年的材料设计、合成及其在锂离子电池负极材料中的应用。
1 MnO及其复合物的合成
MnO 是锰元素的最低价态氧化物,在用作电极材料时具有理论比容量大(756mA·h/g)、能量密度较高(5.43g/cm3)、电压滞后小(<0.7V)、环境不敏感、相对成本低等优势。遗憾的是,MnO在锂化/脱锂过程中剧烈的体积变化和材料本身较低的电导率导致其在实际使用时的循环稳定性和倍率性能均较差。合成低维纳米结构的MnO(如纳米片和纳米线)以及与高导电性材料(如多孔碳或石墨烯)复合是常用的提高MnO 材料导电性和改善材料电化学反应动力学的两种有效的方法。
1.1 低维及多孔结构MnO的构筑
粉体MnO材料的尺寸减小后能有效缩短Li+/电子的扩散路径,同时,增大的比表面积能提供更多的活性位点来提升材料储锂时的电化学性能。早期报道的粉体MnO 负极材料动力学性能很差,只能在较低的电流密度下进行充放电。近年来,Yu等[4]发现脉冲激光沉积技术(PLD)可用于制备纳米晶状MnO 薄膜,极大提升了MnO 材料的储锂容量和倍率性能。该方法是先将MnO 进行热压烧结作为靶材,通过PLD使其沉积在钛基上获得MnO薄膜。但PLD 只能用于小面积的薄膜生长,无法获得大面积生长的MnO 薄膜。Cui 等[5]同样以热压烧结的MnO 作为靶材,采用射频磁控溅射法在铜箔基底上制备了尺寸为0.7cm×0.7cm的多孔MnO薄膜,远大于前者80nm×20nm 的尺寸。将MnO 制成薄膜对于技术和仪器设备的要求都比较高,因此这方面的研究也相对较少,更多的研究集中在构筑多孔MnO纳米结构上。

除了制备多孔结构来增加比表面积以提升材料储锂性能外,Zou 等[9]发现纤锌矿结构MnO(001)晶面的偶极矩非零,这使得在锂离子嵌入/脱出的过程中MnO 纤锌矿结构与“石墨烯状”结构之间的相互转化,导致材料结构破坏、电池容量迅速损失。Zou 等以KMnO4和Li2CO3为前体,通过水热合成得到六角形片状MnCO3,进一步在Ar/H2气氛下热解和还原MnCO3获得具有富氧缺陷的MnO。热解还原过程中产生氧空位(VOs),引入一个氧空位缺陷可以将电荷密度降低3.2×10-19C,平衡非零偶极矩,使MnO 结构更加稳定,从而显著提升了材料的储锂性能,如图2所示。

图2 MnCO3六角纳米片前体及MnO-Vo六角纳米片的合成示意图[9]
1.2 MnO与碳素材料的复合
将粉体材料的尺寸减小至纳米级别可以有效缓解材料在充放电过程中体积粉化,提升材料的稳定性。但单一的纳米化并不能改变MnO 导电性差的固有缺陷。因此,更多的研究集中在将MnO 与碳素材料结合,改善材料导电性,提升材料在电化学反应过程中的倍率和循环性能。在MnO/C 复合材料的构筑中,高分子材料或其单体因种类多、结构可控成为一种理想的碳源和结构导向剂。
Liu等[10]用KMnO4和MnCl2作为锰源,加入聚乙烯醇(PVA)进行水热,再经过煅烧获得碳包覆的MnO 立方颗粒。其中PVA 既可作为碳源,又能作为生长抑制剂来控制MnO 纳米晶体的生长尺寸[10]。在MnO/C 复合结构的设计中,锰源和碳源的选择也多种多样。例如,Wang 等[11]以MnSO4为锰源先水热得到MnO2纳米线,然后加入吡咯单体在MnO2纳米线表面自聚合,经过煅烧得到碳包覆的MnO纳米线。聚乙烯醇和聚丙烯醇的嵌段共聚物F127也曾作为碳源被涂覆到MnO 纳米线的表面[12]。当然,通过更加复杂的合成工艺还能获得一些特殊的结构。Jiang 等[13]利用聚乙烯吡咯烷酮(PVP)与KMnO4共水热后热解得到MnO-P 前体,然后将MnO-P 加入含有嵌段共聚物P123、氨基异丙基甲醇和多巴胺的混合水溶液中,缩合获得MnO-P/聚多巴胺壳核结构,再进一步在惰性气氛下退火获得具有内部空隙的新型豆荚状的碳包覆MnO纳米棒,如图3所示。碳“豆荚”中相邻的MnO纳米颗粒之间具有约20.6%的大体积比,这种新型结构能够有效地减少电池循环过程中纳米颗粒的自聚集,提升电极材料比容量和循环稳定性。

图3 豆荚状碳包覆的MnO纳米棒及其循环性能[13]
当然,碳包覆MnO 复合材料中碳壳的弹性毕竟有限,因此负极材料在循环一定次数后依然会发生不同程度的断裂。因此,研究人员进一步在MnO/C复合材料中构筑多孔结构、中空结构、三明治结构等特殊结构以期提高材料的电化学性能。Tang 等[14]先用磺化聚苯乙烯(sPS)、MnSO4和NH4HCO3得到sPS-MnCO3悬浮液,后加入酚醛树脂,以乙二醇为溶剂进行溶剂热,后经过碳化得到多孔MnO/C 复合颗粒,丰富且均匀的纳米孔可以有效地适应与Li+发生氧化还原反应过程中体积变化引起的应变和应力,并且能增强复合材料的循环稳定性和倍率性能。除了高分子,其他有机化合物也被尝试用作碳源来形成支撑结构。例如,Jia等[15]利用十八烯酸作为碳源形成3D互连的MnO/C,Zhu 等[16]则利用葡萄糖作为碳源,经过冷冻干燥和热处理得到三维连续碳纳米片,MnO 纳米颗粒则嵌入在碳纳米片中。
自然界中的生物资源具有多种维度的组织结构,且生物组织含有从纳米级到宏观毫米级的各级尺寸。同时,生物资源廉价丰富易再生,是MnO/C复合材料合成过程中理想的模板和碳源。Xia 等[17]以平均直径为2µm 的球形微藻为生物模板,以KMnO4为锰源、聚苯乙烯(PS)为碳源,通过浸渍渗透、干燥、焙烧等一系列过程得到单分散MnO/C中空微球,如图4所示。Lin等[18]以山茶花瓣作为生物模板和碳源、乙酸锰为锰源,通过浸渍渗透、热处理等步骤得到了一种C/MnO/C 三明治状夹心结构。合成过程中,MnO 纳米晶粒的成核和生长被限制在花瓣细胞壁的层状纤维素中,通过煅烧植物纤维素转化为复合材料中的碳支撑结构。

图4 微藻为生物模板的单分散MnO/C中空微球及其电化学性能[17]
碳基体的引入增强了MnO 的结构稳定性和导电性。考虑到氮掺杂碳素材料具有更大的氧化还原反应活性,因此,将MnO 与氮掺杂碳复合成为一种更有效的提升锂离子电池性能的策略。近年来,氮掺杂碳主要是通过采用含氮高分子(聚苯胺、聚多巴胺)作为碳源来实现的。例如,Zhang 等[19]通过将苯胺单体在MnO2表面原位聚合,然后经过煅烧合成一种由氮掺杂碳包裹的MnO 纳米棒组成的三维有序多孔导电框架,如图5 所示。Zhu 等[20]也以聚苯胺(PANI)为碳前体通过与KMnO4水热形成Mn3O4PANI 胶囊,热处理后得到核桃壳状氮掺杂碳包覆多核MnO纳米胶囊。在这一特殊结构中,MnO 纳米粒子均匀地分散在碳胶囊中,碳胶囊可以同时作为导电框架和缓冲保护层来抑制MnO 在充放电过程中的体积变化。除了聚苯胺,聚多巴胺也是一种常用的含氮高分子。例如,Wang 等[21]以碳纳米管(CNT)为模板、乙酸锰为锰源水热生成MnO@CNT,最后涂覆一层由聚多巴胺衍生的氮掺杂碳保护层,获得了一种三明治状CNT@MnO@NC异质纳米管结构。

图5 氮掺杂碳包覆的MnO纳米棒组成三维有序多孔导电框架[19]
在构筑MnO 与碳素材料的复合结构时,二维石墨烯是一种常用的导电体和支撑框架。具有大比表面积和高柔韧性的石墨烯既能赋予材料高导电性,又可以充当缓冲层,用以减轻循环时活性颗粒的体积变化。聚多巴胺涂覆在Mn3O4纳米晶体表面,再通过静电作用与氧化石墨烯(GO)自组装,热处理后可形成GNS@MnO@NC 复合材料[22]。采取“喷雾快速冷冻”工艺可先获取石墨烯带(IGR),然后将IGR 与KMnO4经微波反应合成IGR-MnO2,再加苯胺单体原位聚合,经冷冻干燥和热处理,最终可以得到氮掺杂碳包覆的MnO 锚定在相互连接的石墨烯带上。Huang 等[23]则是在不通过热处理的情况下通过原位方法修饰制备MnO 纳米结构,以无水乙酸锰、三辛胺和油酸为原料,将混合溶液在N2下加热,得到MnO 纳米颗粒,然后将MnO 纳米颗粒悬浮液添加到氮掺杂石墨烯(NG)溶液中,通过搅拌离心分层,最后冷冻干燥得到MnO/NG复合材料。该方法不仅解决了MnO 的聚集问题,而且还能保持MnO的原始形态和晶体结构。
2 Mn2O3及其分级结构的构筑
Mn2O3作为锰氧化物的成员之一,它可以为锂离子电池提供1018mA·h/g 的理论比容量,用作负极材料时,工作电压很低——放电电压约为0.5V,充电电压约为1.2V。然而,由于自身较差的导电性和循环过程中发生的体积效应,Mn2O3倍率性能和循环稳定性通常也不够理想。近年来,文献所报道的解决上述问题的主要策略有两种:①设计纳米孔结构Mn2O3;②构筑分级结构Mn2O3。
2.1 纳米孔结构Mn2O3的设计与合成

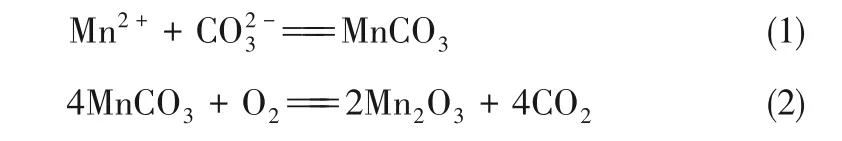
近年来,更常用的方法是通过多元醇的水热/溶剂热方法来制备Mn2O3。例如,Qiu等[26]分别采用果糖和β-环糊精与KMnO4反应,分别得到椭圆形和稻草捆型的介孔Mn2O3。其中,果糖是一种单糖,β-环糊精是一种环状糖,它们的分子结构都含有多—OH,可以作为桥联配体来组装纳米级结构单元,从而控制产物形貌;反应过程中,多糖配体最终被MnO4-氧化生成CO2。此外,乙二醇也被用与跟MnCl2·4H2O[27]、乙酰丙酮锰[28]、Mn(Ac)2·4H2O[29]等锰源通过溶剂热的方法来合成Mn2O3。反应过程中,乙二醇可以抑制晶体的长大,且晶体层会因为乙二醇的存在发生弯曲,形成这种异常形态的原因尚不清楚,需要进一步研究并阐明背后的机理。
除了这些常规的方法,还有一些特殊的溶剂或者模板用来制备结构和形貌特别的Mn2O3。例如,He等[30]首次报道采用环境友好型离子液体1-丁基-3甲基咪唑四氟硼酸盐作为结构导向剂和氟源用溶剂热法制备了空心多面体MnF2前体,后经过退火工艺得到了空心Mn2O3。此外,金属有机框架材料(MOF)是由过渡金属氧化物与有机配体通过自组装形成的具有周期性网络结构的晶体多孔材料。MOF 的独特结构也是制造具有理想尺寸和大面积的中空或多孔结构的理想模板[31-33]。例如,Zhang等[34]先 用Mn(NO3)2·4H2O 和 苯-1, 3, 5- 三 羧 酸[C6H3(COOH)3]为原料,甲醇为溶剂合成了Mn-MIL-100 MOF,随后在400℃热处理得到Mn2O3八面体多孔材料。Bai 等[35]则先由Mn(NO3)2·6H2O、2,3,5,6-四溴对苯二甲酸酯、NaOH 和4,4’-联吡啶合成了Mn-LCP,然后将Mn-LCP 热处理获得多孔Mn2O3。
除采用特殊的模板外,通过一些特殊的设备和工艺也能制备出Mn2O3。喷雾热解被认为是制备均匀化学成分和球形颗粒的简单、稳定、可调控的方法。Zang 等[36]以MnCl2水溶液为原料,通过柔性一步超声喷雾热解成功地合成了特殊的孔洞嵌入多孔空心Mn2O3微球。与普通球形颗粒相比,新型多孔空心Mn2O3微球可以使电解液通过孔洞渗透到内部,提供更多的活性位点并缩短的Li+扩散路径。
2.2 分级结构Mn2O3的设计与合成
设计纳米结构材料可以减少锂离子扩散的路径,提高材料的倍率性能。但纳米结构Mn2O3所制成的电极堆积密度低,导致电池体积小、容量小[37]。涂覆和设计复合材料可以提高外部颗粒之间的导电性,但内部颗粒之间的导电性仍然很差[38]。因而,研究者考虑设计分级结构的Mn2O3以进一步提升材料的性能。分级结构的材料既有纳米级材料的优点,也有微米级组件的优势。由于扩散路径缩短,纳米尺度粒子(初级粒子)可以促进Li+的嵌入和脱出,而微米尺度的次级结构可以保证材料在充放电过程中保持结构稳定[39]。同时,介孔结构可以增强电极/电解质界面接触,提供更多的相互作用位点以增加表面或界面反应,缩短电子和锂离子的传输路径,并适应充放电过程中的体积膨胀[40]。
具有特殊形貌的分级结构Mn2O3往往也展现出良好的电化学性能。Lin 等[41]首先在微乳液中通过沉淀反应合成了立方晶状的MnCO3,以立方MnCO3为模板,通过两步程序退火工艺获得了三壳状分级结构Mn2O3立方体,如图6所示。退火过程中在壳-核界面上主要有两个作用力,一个是煅烧过程中由大量失重而引起的收缩力,会促使MnCO3核向内收缩,另一个是对外壳的黏附力,防止向内收缩。第一次退火过程中,收缩力大于黏附力,内芯向内收缩与外壳分离,第二次退火过程中,黏附力大于收缩力,运动方向相反,内芯向外收缩留下中空的空腔。

图6 MnCO3纳米立方体的FESEM图及三壳层Mn2O3中空纳米立方体的FESEM和TEM图[41]
与分级结构立方体类似的分级结构微球也被成功制备[42]。以Mn(Ac)2·4H2O、聚乙烯吡咯烷酮(PVP)和乙二醇(EG)为助溶剂,经过溶剂热反应和退火可得Mn2O3多孔分级空心微球,如图7 所示。有趣的是,无PVP 只能形成Mn2O3微片,PVP在退火过程中会促进Mn-EG 微片的团聚从而形成分级微球结构。Shi 等[43]则用Mn(Ac)2·4H2O 和碳酸二甲酯(DMC)以水和乙醇为溶剂进行微波水热和退火得到Mn2O3微球。DMC作为沉淀剂,一次沉淀物聚集在一起形成作为二次颗粒的微片,最终生长成微球。与传统水热法相比,微波反应可以大大缩减反应时间,使合成在30min内完成。除了单组分的分级立方体和分级微球外,复合材料也可以构建分级结构,Zhou等[44-45]分别将石墨烯和硫酸锰加入到硝酸钠熔融盐中,冷冻干燥后得Mn2O3@石墨烯复合材料,Mn2O3纳米片在石墨烯上垂直生长,形成如图8所示的2D分层结构。

图7 Mn2O3多孔分级空心微球扫描电镜图[42]
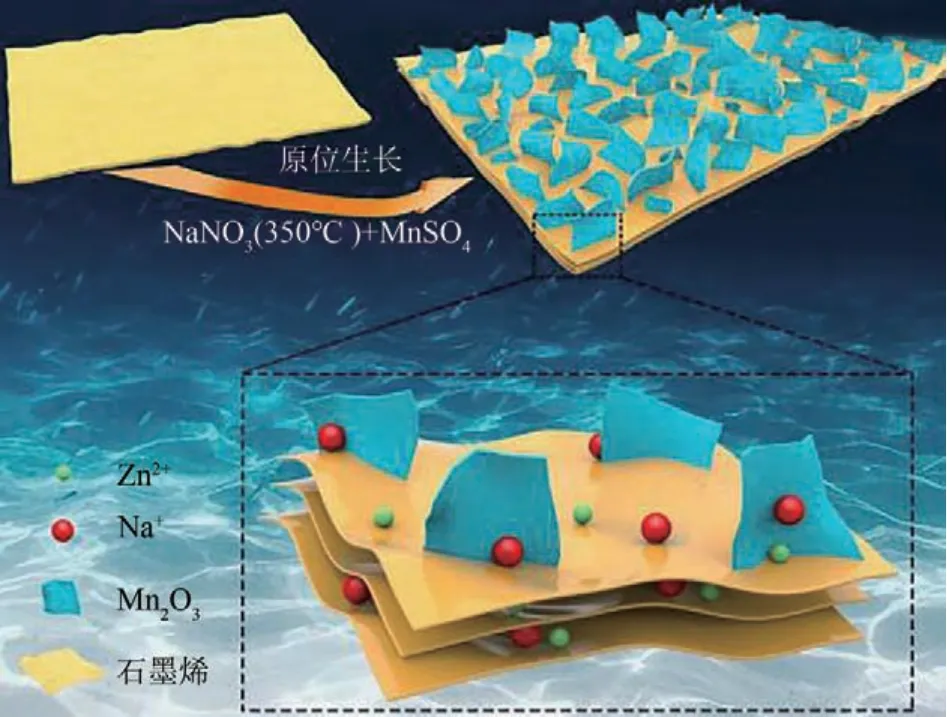
图8 Mn2O3纳米片在石墨烯上垂直生长形成分级结构示意图[44]
3 Mn3O4及其复合物的合成
Mn3O4是一种黑色的四方结晶,在自然界中分布十分广泛,作为锂离子负极材料时具有937mA·h/g的理论容量。Mn3O4不仅价格便宜,而且与其他过渡金属氧化物相比工作电压也很低(放电电压约为0.5V,充电电压约为1.25V)。因此,Mn3O4作为锂离子负极替代材料也有着良好的前景。但Mn3O4极低的电导率(10-7~10-8S/cm)、缓慢的离子传输动力、锂化/脱锂过程中剧烈的体积变化等特点均会导致电池的容量衰减。解决上述问题的思路与改进MnO 电化学性能的思路类似:一种策略是在纳米尺度上构建具有不同结构的Mn3O4,另一个方法是将纳米结构的Mn3O4与碳素材料(如多孔碳、石墨烯、碳纳米管等)或其他结构稳定的材料(如TiO2)相结合形成复合材料。
3.1 Mn3O4纳米结构的设计
通过化学沉淀法来制备纳米Mn3O4是一种常用方法。化学沉淀法通常是将锰盐和有机胺在一定温度下反应,得到Mn3O4的沉淀,经过干燥或退火进一步使晶体更稳定。Dubal 等[46]在含有MnSO4和环六亚甲基四胺(HMT)的溶液中加入钛基底,通过水热结合化学沉淀、退火等过程使Mn3O4晶体膜生长在钛基底上。Zhen 等[47]将MnCl2·4H2O 溶解在乙醇胺中,在室温搅拌下沉淀,退火后得Mn3O4纳米片。Gao等[48]则通过Mn(Ac)2·4H2O和NH4OH沉淀后的热处理得到“海绵状”特殊形貌的Mn3O4。Bui等[49]也通过十六烷基三甲基溴化铵(CTAB)和KMnO4、尿素配成的前体溶液在烘箱中沉淀后煅烧得到高密度Mn3O4,其中尿素与水生成的NH4OH起沉淀剂作用。
水热法也是合成Mn3O4的一种常用的方法。例如,Bai 等[50]先通过KMnO4和镁粉的水热得到MnOOH 纳米棒,后经热处理得到Mn3O4纳米棒。直接在180℃水热Mn(Ac)2也能获得Mn3O4纳米线[51]。总的来说,沉淀法制备的Mn3O4更倾向于呈现出纳米片状甚至还有“海绵状”等特殊形貌,而水热制备的Mn3O4则倾向于呈纳米棒(线)状。
除了沉淀和水热外,一些其他特殊方法也可用来制备Mn3O4。例如,Bai 等[52]采用氢还原法,在280℃H2/Ar 下,通过还原β-MnO2纳米管直接合成了介孔Mn3O4纳米管。Yang 等[53]则是采用了一种电化学电位微扰法合成了Mn3O4纳米材料。以纯金属锰为工作电极,2mol/L KCl 水溶液为电解液,在-2.0~2.0V 的电压范围内,分别以5V/s、200V/s和50V/s的扫描速率,通过循环伏安法可以得到棒状、球形和混合结构的Mn3O4。
3.2 Mn3O4与碳素材料的复合
Mn3O4和MnO一样可以通过和碳复合来提升材料稳定性,复合策略也和MnO 类似,常以一些有机物作为碳源,通过碳包覆的形式来实现。例如,Liu 等[54]以Mn(NO3)2为锰源、均苯三甲酸为碳源、N,N-二甲基甲酰胺(DMF)和乙醇为溶剂,通过溶剂热先合成了Mn-MOC 前体,后在Ar 气氛下煅烧得多孔分级Mn3O4/C 纳米球。以KMnO4为锰源、葡萄糖[55]或多巴胺[56]为碳源,通过水热合成前体后煅烧的方式也可以获得Mn3O4@C壳核结构,如图9所示。其中,有机物在反应过程中既充当碳源,也作为还原剂来还原KMnO4获得Mn3O4。

图9 以KMnO4和葡萄糖为前体合成Mn3O4@C复合材料示意图[55]
通过水热的方法将碳源和锰源共组装形成前体,再焙烧获得Mn3O4@C是一种常见的Mn3O4/C复合材料构筑思路。另一种制备Mn3O4/C复合材料的思路是先合成碳模板,在此基础上再把锰源引入,最后形成复合材料。Zhang 等[57]以柠檬酸钠为模板热分解得到多孔碳粉,然后将多孔碳粉分散在DMF 中,加入Mn(Ac)2,Mn2+被吸收在多孔碳的孔中,并且随着对苯二甲酸(H2BDC)的加入,Mn2+与对苯二甲酸有机配体配位,形成了Mn-BDC 前体,最后通过煅烧得到Mn3O4/C。该方法制备的复合材料并不是以碳包覆的形式存在,而是Mn3O4颗粒嵌入在多孔碳骨架中。总的来说,这些方法都是通过先制备前体,后经过煅烧得到复合材料,在煅烧的过程中需要惰性气体的保护,过程相对复杂。Sun等[58]巧妙地设计了一种盐烤法来合成Mn3O4/C复合材料,实验步骤如图10 所示。先将乙酰丙酮锰和NaCl 研磨,然后压制成圆柱体,与NaCl 一起封装,然后在300℃下热处理,冷却取出后用水洗去NaCl得到Mn3O4/C复合材料。其中NaCl是作为一种导热介质和制造多孔结构的可移动硬模板。

图10 用改进的盐烤法合成Mn3O4@C纳米复合材料的分步图解[58]
石墨烯作为材料中的后起之秀,具有出色的导电性、机械强度和化学稳定性。此外较高的比表面积可使其成为功能纳米材料生长的极佳基材[59-62]。对于纳米复合材料,Mn3O4纳米颗粒在石墨烯片上的良好分散可以有效地避免石墨烯片的聚集。同时,石墨烯不仅为Mn3O4提供了有效的电子传输通道,而且还减轻了充放电循环中的体积膨胀[63-64]。Wu 等[65]以石墨烯纳米片和MnSO4·H2O 为原料通过简单的溶剂热方式在石墨烯上选择性生长了Mn3O4纳米棒。Park 等[66]以Mn(Ac)2为锰源、水合肼作为还原剂和氮源,在掺N 的石墨烯表面生长出小的Mn3O4纳米颗粒。除了可以在石墨烯表面生长Mn3O4外,还可以将Mn3O4纳米管嵌入多孔石墨烯片中。例如,Wang 等[67]采用NaCl 晶体和SiO2纳米球为双模板,制备了珊瑚状复合材料(Mn3O4@PGs)。先通过水热和热处理得到Mn3O4纳米管,然后将Mn3O4纳米管、SiO2纳米球、葡萄糖分散在NaCl 溶液中,搅拌至凝胶状(在此过程中,NaCl 晶体被Mn3O4、SiO2、葡萄糖均匀覆盖),经过高温煅烧,葡萄糖裂解成石墨烯片并均匀涂覆在NaCl 晶体和Mn3O4纳米管表面,最后将模板洗去得到产物。
在构筑Mn3O4/C 复合材料中,多孔碳、石墨烯、碳纳米管等是常见的基质,而碳量子点作为一种新型的富含含氧基团的碳纳米材料,因其高比表面积和低毒性也日益成为新的研究对象[68]。此前,碳量子点已经在光催化和超级电容器应用中表现出优异的性能[69],近年来,碳量子点也逐渐在锂离子电池领域受到关注。碳量子点与锰氧化物复合也成为构筑Mn3O4/C复合材料的一种新思路。Jing 等[70]采用了一种绿色交流电压电化学法,通过将NaCl 和碳量子点分散在水溶液中作电解液,两个Mn箔作电极,在交流电压的作用下收集粉末,然后煅烧得碳量子点包覆的Mn3O4复合材料,合成示意图如图11 所示。研究者在实验过程中发现,引入碳量子点可以诱导复合材料中Mn3O4颗粒形成八面体结构。

图11 碳量子点包覆的Mn3O4复合材料合成示意图及其TEM图[70]
对于用于保护Mn3O4颗粒的碳壳层来说,虽然能在一定程度上解决Mn3O4在锂离子电池应用过程中的问题,但是其本身依然存在一些不足,如容易被溶剂分子插入、对活性材料亲和力弱以及热稳定性差等[71]。因此,研究者也尝试寻找碳以外的替代物。TiO2因具有稳定的晶体结构和良好的热稳定性,在用作锂离子负极材料时体积变化小(仅约4%)、循环稳定性高、倍率性能优异,因而成为改善Mn3O4性能的有效选择。Wang等[72]先通过KMnO4和聚乙二醇水热得MnOOH,然后在低温下使钛酸四丁酯水解生成TiO2生长在MnOOH表面,在Ar/H2下退火得Mn3O4@H-TiO2,材料的合成与结构如图12所示。

图12 Mn3O4@H-TiO2材料的合成示意图和扫描电镜图[72]
4 MnO2及其复合物的合成
MnO2是锰氧化物中价态最高、晶型最多(有6 种)、最常见、也是目前研究最多的氧化物[73]。由于其高理论容量(1230mA·h/g)、低成本、自然丰度和环境友好等特性而备受研究者关注。关于MnO2材料的设计、合成以及在包括锂离子电池、超级电容器、碱性液体电池、金属-空气电池等相关能源领域的应用已有不少文献报道[73-74]。因此,在本文中,对MnO2材料的设计合成将做简单介绍。与锰的其他氧化物一样,MnO2在用作锂离子负极材料时也存在充放电过程中的体积膨胀和聚集、电导率低等问题。常见的解决这些问题的思路与方法也跟锰的其他氧化物相似,如减小MnO2维度、构筑纳米结构、掺杂改性、与导电材料复合等。
总的来说,液相法是制备MnO2最主要的方法,其中最受欢迎的是水热法。通过水热法合成的MnO2纳米材料纯度高、分散性好、晶化程度高而且形貌尺寸可控。Chen等[75]以KMnO4和HCl为反应物,通过水热法制备了MnO2纳米棒,Liu 等[76]以MnSO4和(NH4)2S2O8为反应物,通过水热法制备了β-MnO2纳米棒,Li 等[77]也通过水热法在不锈钢板上生长了相互连接的MnO2纳米片。除了最常用的水热法外,微乳液法也被用作制备MnO2。在微乳液中,两种互不相溶的溶剂在表面活性剂的作用下形成均匀的微乳泡,其表面由表面活性剂组成,可使MnO2晶体的成核、生长、团聚等过程局限在一个微小的球形液滴内,从而形成球形颗粒。Munaiah 等[78]使用KMnO4和Na2S2O4的羧酸介导体系通过微乳液法合成了MnO2空心球,合成示意图如图13所示。Xu等[79]将KMnO4通过双(2-乙基己基)磺基琥珀酸酯(AOT)分散在异辛烷中,其中AOT既作分散剂又作还原剂,利用自反应微乳液法合成了MnO2纳米颗粒。Ragupathy 等[80]在KMnO4与乙二醇混合形成的微乳液中制备了具有层状结构的MnO2纳米材料。

图13 微乳液法合成MnO2空心球及其TEM图[78]
为了得到一些具有特殊形貌与尺寸的MnO2,模板法也是常用的一种方法。Yu 等[81]以MnCO3为模板,利用KMnO4作氧化剂制备了Birnessite 型MnO2中空微球。Zhang 等[82]以废弃鸡蛋壳为生物模板,以MnSO4和KMnO4为原料通过水热法合成了MnO2颗粒,移除模板后形成了絮凝状纳米球结构。近几年,一些新颖的MnO2制备方法也被陆续报道。例如,Voskanyan 等[83]以硝酸锰、甘氨酸和SiO2胶体为原料,通过胶体溶液燃烧法合成了3D中孔δ-MnO2。在常规的湿化学法中,晶体成核和生长需要持续的热量供应和反应时间延长,而胶体溶液燃烧法则是利用反应物的内部化学能作为热能释放,将反应物转化为所需的产物。
与Mn3O4一样,MnO2也可以通过水热法直接在石墨烯表面生长。例如,Jiang等[84]在氧化石墨烯存在的条件下,对KMnO4与2-(N-吗啉)乙磺酸进行水热处理合成了MnO2纳米晶体/还原氧化石墨烯复合材料;Deng等[85]采用化学气相沉积法(CVD)在泡沫镍上沉积石墨烯泡沫(GF),再引入KMnO4和MnSO4进行水热反应,在石墨烯泡沫上构建了一种具有相互连接的MnO2纳米片。值得一提的是,GF可以直接充当集流体,无需使用额外集流体。Yao等[86]也以草酸为还原剂、KMnO4为锰源,通过简单的回流反应,在氧化石墨烯上生长了介孔MnO2纳米球。
除了通过水热法在石墨烯表面生长MnO2外,还可以先分别制备出石墨烯和MnO2,再通过外力将两者进行组装。例如,Chae 等[87]先分别合成了MnO2纳米棒和氧化石墨烯,然后引入聚乙烯亚胺(PEI),通过PEI的静电相互作用,将MnO2锚定在GO 表面。Yu 等[88]则是将事先制备好的石墨烯和MnO2纳米管通过超滤技术形成叠层式逐层组装的石墨烯-MnO2纳米管薄膜复合材料。此外,碳纳米管(CNT)由于具有一维结构、高机械强度、良好的导电性和优异的化学稳定性等优点,也常被用于与MnO2结合,构筑新的复合材料。比较有代表性的做法是先通过化学气相沉积法将CNT 分别生长在纸卷轴[89]和不锈钢网[90]的表面上,然后再以Mn(NO3)2为原料通过电化学沉积法将MnO2生长在CNT 纤维上,形成自支撑的MnO2/CNT 膜。将CNT生长在MnO2上是另一种构筑MnO2-CNT 复合材料的思路。Mao 等[91]通过将(NH4)2S2O8加入到CNT 和MnSO4溶液中形成沉淀,经300℃干燥后得到MnO2@CNT 复合材料,其中(NH4)2S2O8的加入可以促进MnO2单元的生成并聚集。随着反应继续,更多的MnO2聚集在一起,球体体积增大,形成二级微球结构,分散的CNT 与MnO2单元聚集在一起形成内部涂层。与传统涂层方法不同,内部涂层是采用一维导电材料作为涂层材料,一维导电材料相互缠绕在一起形成三维导电网络,不仅能提高电导率,还可以容纳活性材料中的体积变化[91]。
5 锰氧化物在锂离子电池负极材料中的应用
5.1 MnO及其复合物
料时的性能。从表中可以看出,通过减小MnO 维度、构筑多孔及其他特殊结构以及与碳素材料复合等策略,MnO 在锂离子电池材料中的性能得到大大的提升。其中一些具有多孔结构的材料表现出了格外优异的性能,主要是因为多孔结构赋予材料更大的比表面积,能够提供更多的活性位点,还能缓解材料在充放电循环过程中的体积变化。此外,碳素基体的引入也能有效提高材料的导电性和结构的稳定性,以此提升电池性能。

表1 MnO及其复合物作为锂离子电池负极材料的性能比较
5.2 Mn2O3
表2 总结了近年来Mn2O3用作锂离子电池负极材料时的性能。从表中可以看到,Mn2O3的容量远大于目前商用石墨的容量,虽然Mn2O3的理论容量比MnO 大很多,但是由于自身固有的不足,其在锂离子电池中表现出的性能和MnO 类似。在构建了分级结构之后,性能有小部分的提升,纳米尺寸单元组成的分级多孔结构不仅可以降低介面接触电阻,还可以消除电化学循环过程中的团聚现象。此外,介孔结构Mn2O3具有大比表面积和内部体积,可以提供更多的活性位点和更短的Li+嵌入/脱出,提升材料性能。

表2 Mn2O3作为锂离子电池负极材料的性能比较
5.3 Mn3O4及其复合物
表3 总结了近年来Mn3O4及其复合物用作锂离子电池负极材料时的性能。从表中可以看出,Mn3O4在锂离子电池中的容量也比商用石墨的容量高。而且,随着碳素材料的引入,材料的导电性得到提升,团聚现象被抑制,体积变化得到缓解。与纯Mn3O4相比,复合材料的性能有一定提升,并且在大电流密度下依然能保持很高的容量,表现出不俗的循环性能和倍率性能。

表3 Mn3O4及其复合物作为锂离子电池负极材料的性能比较
5.4 MnO2及其复合物
表4 总结了近年来MnO2及其复合物用作锂离子电池负极材料时的性能。MnO2在四种锰氧化物中理论比容量最高。从表中也可以看出,相较于前三种锰氧化物,MnO2表现出优异的可逆比容量,最高可达1405mA·h/g,并且大部分容量都能达到1000mA·h/g 左右。在引入了碳素材料后,不仅材料的比容量得到了提升,而且在较高的电流密度下依然能保持较高的可逆容量,并且在循环之后容量也没有发生太大的衰减。

表4 MnO2及其复合物作为锂离子电池负极材料的性能比较
6 结语
总的来说,锰氧化物在用于锂离子负极材料时均有很高的理论比容量。同时,锰氧化物还具有资源丰富、无毒、环境友好等优点。但在实际应用中,几种锰氧化物也都存在着导电性差、体积变化大、易团聚、易粉化等问题。针对上述问题,近几年对锰氧化物材料的设计思路主要集中在两个方面。
(1)通过减小纳米尺寸、构筑多孔、调控结构和改变形貌等手段来设计新材料,缩短材料用作极片时锂离子的扩散路径并抑制材料在充放电时的粉化及团聚。
(2)通过和碳素类材料(如多孔碳、石墨烯、碳纳米管、碳量子点等)或结构稳定的TiO2等进行复合,来提升材料的导电性以及作为缓冲支撑来减小充放电时剧烈的体积变化。
本文总结了近十年来锰氧化物在锂离子电池负极材料领域的应用。锰氧化物的合成方法多种多样,同样也为锰氧化物在其他方面的应用提供了新的思路。就目前来看,锂离子电池仍将是应用最广、最具潜力的便携二次电池。锂离子电池应用范围的不断扩展、电动汽车的兴起、便携式电子设备市场的爆发对电池材料和电池制备提出了越来越高的要求。就负极材料而言,商品化的石墨负极材料依然存在储锂容量低、可燃、过充安全性差等问题。因此,开发性能更优的非碳负极材料依然是锂离子电池研究的重要课题之一。根据对已有文献的总结可以看出,与其他材料尤其是碳素类材料复合之后的锰氧化物的性能明显要优于单一组分的材料。因此,锰氧化物与其他材料的复合依然是未来研究的重点,特别是二氧化锰/石墨烯或碳纳米管复合材料的设计与构筑。随着研究的深入,寻求更简单、更有效、更环保的合成方法仍然是科学家们努力的方向。此外,如何采用更先进的技术手段来深入分析锰氧化物在用作锂离子电池负极材料时的储锂机理也有望在未来得到进一步发展。

