碳化钨纳米材料的氢氧室温催化性能
黄兰香 ,陈云贵
(1.乐山师范学院 轻合金材料研究所,四川 乐山614000;2.四川大学 新能源与低碳技术研究院,四川 成都610000)
0 引言
为了减少非可再生化石燃料的消耗和二氧化碳温室气体的排放,大力发展清洁能源已是大势所趋。蓄电池是太阳能和风能最适合的储能装置,同时,作为清洁能源的储能蓄电池要求其必须具有安全性高、成本低、循环寿命长和能够免维护等特点。锂离子电池虽然具有较高的效率,但其使用的有机电解质具有不稳定性和毒性,且含锂的电极材料具有高活性,因此,如果使用锂离子电池作为储能装置不仅成本较高,而且安全性大打折扣[1-2]。而水性电解质的使用可以使水性可充电电池满足储能系统的要求,其中,铅酸蓄电池历史悠久,工艺技术成熟,使其市场占有率较高,使用范围较广,但铅对人类和环境具有毒害性,且铅酸电池的循环寿命较短,从而限制了其在大规模储能系统中的应用[3-4]。铁镍电池是一种安全、坚固、耐用的电源,循环寿命长达3 000次,即使在滥用的情况下,其使用寿命也可长达20年[3-4],而且,铁(Fe)和镍(Ni)在地球上储量非常丰富,毒性很小,是非常理想的储能蓄电池。
但是,铁的电极电位(反应1)比电解液中的水在铁负极上的析氢电位(反应2)负[3],在充电过程中将会析出氢气,导致铁镍电池无法密封;水的电解会导致电解液的损失,铁镍电池需要定期注液[4-5]。目前为止,研究人员在电极及电解液方面开展了大量的改性研究工作,取得了一定的效果,但完全抑制氢气的析出是不可能完成的挑战[5-7]。Hariprakash[8]等用Pt/CeO2作为铁镍电池充电过程中产生的氢气和氧气重组的催化剂,氢氧能够得到较好地复合,电池气压稳定,循环性能较好。但是,贵金属催化剂会导致铁镍电池的价格显著提高,进而降低其成本优势。因此,如果可以采用非贵金属催化剂来实现氢气和氧气的重组催化,不仅可以达到使铁镍电池密封和免维护的目的,还可以保住其低成本的优势。
Fe(OH)2+2eFe+2OH E0=-0.877 V vs.SHE
(1)
2H2O+2e-→H2+2OH-E0=-0.828 V vs.SHE
(2)
Levy和Boudart[9]于1973年发现,碳化钨在室温条件下能够催化氢和氧复合反应生成水,其在表面催化中表现出了类铂效应;作者认为是碳元素改变了钨的表面电性,使其与铂的表面电性相似。Colton[10]等利用光电子能谱分析了W、WC及Pt的表面电性,证实了这个观点。之后,科研人员使用碳化钨在催化领域开展了大量的研究,取得了良好的效果[11-20]。本研究采用价格低廉的乙炔黑(Acetylene Black,简称AB,比表面55~70 m2·g-1)作为碳源和碳载体,用柠檬酸(Citric Acid,简称CA)对其进行表面功能化修饰,得到柠檬酸功能化乙炔黑载体(CA-AB);再将其进行钨纳米颗粒的负载及高温固相原位渗碳处理,从而制备出低成本的碳化钨纳米复合材料(WxC/CA-AB),用于铁镍电池的氢氧室温催化重组。
1 实验部分
1.1 材料制备
首先,称取300 mg乙炔黑于纯水中超声分散,再加入柠檬酸600 mg,继续超声分散,直至形成均匀的分散液;将上述分散液置于60 ℃鼓风干燥箱中使水溶剂蒸发直至形成糊状物;最后,将得到的糊状物放入箱式电阻炉内,升温至350 ℃(升温速率10 ℃ min-1),恒温30 min后随炉冷却至室温,得到CA-AB载体。
称取160 mg CA-AB于纯水中超声分散形成均匀的分散液;再称取86.3 mg新鲜的六氯化钨(WCl6)粉末于10 mL乙醇中,磁力搅拌直至溶解完全;然后在搅拌条件下,将六氯化钨乙醇溶液转移至CA-AB分散液中,继续磁力搅拌1 h;将分散均匀的混合液水浴加热至90 ℃并保温,至分散剂完全挥发形成WOx/CA-AB糊状物;将其转移至瓷舟中并置于管式炉内,抽真空去除管内空气后,在氢氩混合气氛中以10 ℃ min-1的升温速率升至400 ℃并保温1 h,使氧化物还原,得到锚定在CA-AB上的金属钨纳米颗粒中间体(W/CA-AB);最后,在氩气氛围中同样以10 ℃ min-1的升温速率将样品温度升至1000 ℃并保温1 h,使金属钨纳米颗粒发生原位渗碳反应。在高纯氩气氛的保护下,使样品随炉冷却至室温,从而得到 WxC/CA-AB纳米复合材料。
1.2 材料表征
采用X射线衍射仪(XRD,丹东方圆仪器有限公司DX-2600X)对催化剂进行物相组成分析,Cu Kα(波长为1.5418 Å)为辐射源,扫描速度0.05°s-1,扫描范围10°~90°。采用X射线光电子能谱仪(XPS,Kratos Axis Ultra DLD)对催化剂表面元素及化学态进行表征,Al Kα(1486 eV) 靶材,全谱扫描范围0~1200 eV。采用扫描电子显微镜(SEM,日本JSM-6490LV)分析催化剂的微观形貌。采用透射电子显微镜(TEM)分析催化剂的粒子分布情况及颗粒粒径,并采用高分辨透射电子显微镜(HRTEM,美国FEI公司生产的Tecnai G2 F20 S-Twin)对催化剂的晶面取向进行分析。采用热重分析(TGA,德国Netzsch公司生产的STA 2500)测量样品中的金属含量,从而确定负载型催化剂中活性物质的含量。
1.3 电池组装及催化性能测试
将93 wt.%的四氧化三铁粉末材料(四川长虹电池有限公司提供),5 wt.%的乙炔黑,2 wt.%的聚四氟乙烯(PTFE)混合后超声分散于无水乙醇中,直至形成均匀的浆料,然后将其涂覆在泡沫镍上;在真空烘箱中于65 ℃干燥6 h后,将其切割成直径为14 mm的圆形电极,并与过量的商用Ni(OH)2电极分别置于电池模具中作为阳极和阴极;电解液为6 M KOH与15 g L-1LiOH的水溶液。采用电池气室上方的压力变送器(杭州逸控科技有限公司,EC-PB20,测量范围-30~200 kPa,测试精度0.25 %)采集电池气压并由无纸记录仪采集数据。将适量的催化剂粘附于电池气室上方,氢氧催化重组后生成的水由于重力作用可直接返回至电解液中,从而使贫液铁镍电池能够密封和免维护(如图1)。电池性能测试在LandCT2001A型(武汉蓝电电子有限公司)电池测试仪上进行(额定1 C=200 mAg-1),充电倍率为0.5 C,充电2.5 h;放电倍率为0.2 C,放电截止电压为1.2 V。所有测试直接在室温下的密封电池中进行。采用程序升温脱附-质谱(TPD-MS,美国AutoChem II 2920)试验模拟铁镍电池中催化剂表面的氢氧催化重组,同时在线检测反应产物。测试前,在氩气保护条件下以10 ℃ min-1的升温速率将样品从室温升至300 ℃,从而将表面的吸附物杂质彻底脱附,然后冷却至室温;以氢氩混合气(H2∶Ar=1∶9 (v/v))为吸附剂保持90 min,使催化剂表面吸附饱和后,再用氩气对样品吹扫1 h至基线稳定后,同样以10 ℃ min-1的升温速率将温度从室温逐渐升至800 ℃进行程序升温脱附质谱试验。
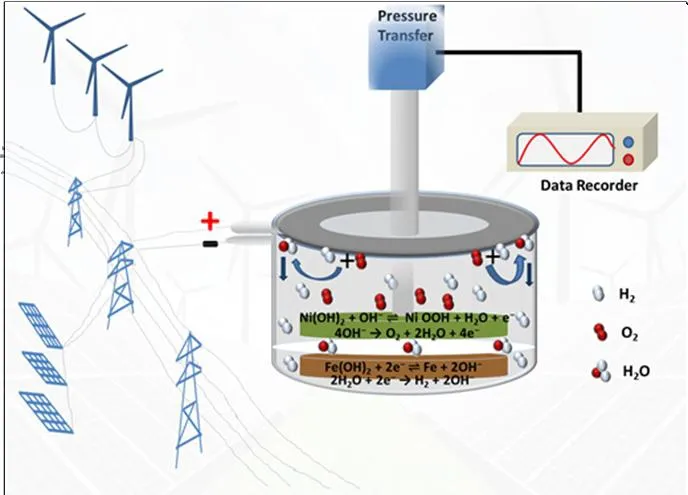
图1 铁镍电池氢氧复合催化反应示意Fig.1 The Diagrammatic Sketch of Hydrogen and oxygen Gas Recombination in the Nickel-Iron Battery
2 结果与讨论
2.1 材料的组成与结构特征
图2(a)、2(b)分别为制备的催化剂的XRD谱图及TGA曲线。衍射峰位置(2θ)与W2C(PDF#89-2371)和WC(PDF#89-2727)的特征峰相匹配,表明所制备的样品中同时存在W2C和WC;通过热重分析可知,金属含量为23.4 wt.%,比实验理论值20 wt.%高了3.4 wt.%,可能是由于在热重检测过程中WxC在600 ℃下,在空气氛围中被氧化为WOx所致。
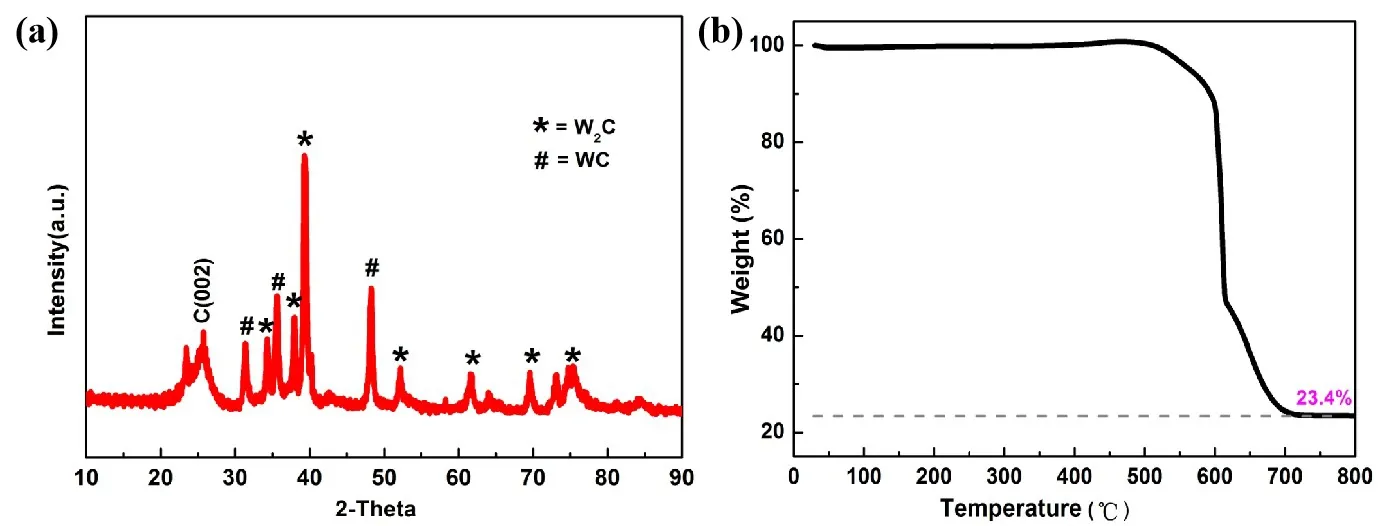
图2 所制备样品的(a)XRD谱图,(b)TGA曲线Fig.2 (a) XRD Pattern,(b) TGA Curve of the as-Prepared Sample
图3为20WxC/CA-AB的XPS分析谱图。图3a为全谱图,可以看出,样品中同时存在C、O和W三种元素,其中C峰很强,而O和W元素的峰强相对很弱。图3b为W 4f的拟合谱图,在31.8和34.0 eV的峰分别对应于W-C键的W 4f7/2和W 4f5/2轨道;另外两个在35.7和 37.9 eV的峰则对应于W-O键的W 4f7/2和W 4f5/2轨道[21],而在图2a的XRD中并没有检测到氧化钨,表明在催化剂表面检测到的W-O键可能是无定型态或是样品表面化学吸附态的氧。高温反应制备的WxC表面具有高浓度的碳缺陷,当暴露于氧气环境中时,这些碳的缺陷位很容易被氧原子所填满而形成W-O键[20,22],而此处的催化剂是在1000 ℃高温下进行的渗碳处理,表面也会具有高浓度的碳缺陷位,当其冷却至室温后再处于空气氛围中时,其中的氧会填补催化剂表面的碳缺陷位而产生W-O键,且如果碳缺陷浓度愈高,所形成的W-O键浓度也会愈高,这就是图3b中的W-O键峰强远高于W-C键的原因。
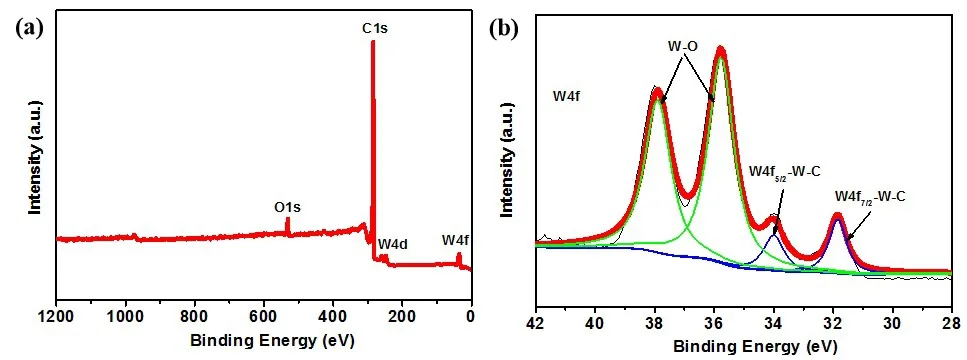
图3 20WxC/CA-AB的XPS谱图:(a) 全谱;(b) W4fFig.3 The XPS Spectra of 20WxC/CA-AB:The Wide Scan Spectra (a) and High-resolution XPS Spectra W 4f (b)
2.2 材料的微观形貌分析
图4为20WxC/CA-AB的微观形貌图,从图4(a)可以看出,催化剂整体呈现为均匀的颗粒状,同时,所生成的WxC纳米颗粒也较均匀地分散在碳载体上(图4(b)),颗粒直径符合正态分布,主要集中在6~8 nm范围内(图4(d));通过分析其高分辨透射扫描形貌图(图4(c)),可以得出,纳米颗粒的晶面间距为2.37和2.5 Å,分别与W2C(2 0 0)晶面和WC(1 0 0)晶面的晶面间距一致。
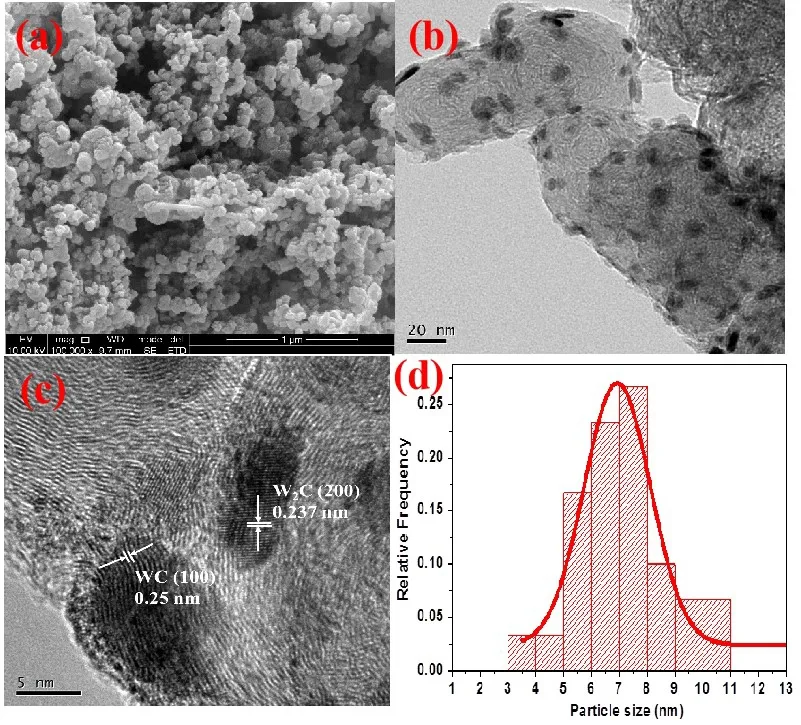
图4 20WxC/CA-AB的微观形貌及粒径分布: (a)SEM图;(b)TEM图;(c)HRTEM图;(d)粒径分布图Fig.4 Micrograph of 20WxC/CA-AB and Particle-Size Distribution:(a) SEM Image; (b) TEM Image; (c) HRTEM image; (d) Particle-Size Distribution
2.3 材料的氢氧复合催化性能
图5a、c、e为铁镍电池在无催化剂条件下在充放电过程中的气压变化曲线。在单独的1次充放电过程中,气压变化曲线由一段弧线和一段水平线组成(如图5c所示),其分别代表了铁镍电池在充、放电过程中的气压变化趋势。刚开始充电时,电池电压从1.38 V立刻升至1.5 V,在此种条件下,铁负极上既会发生氢氧化亚铁的还原反应,同时也会发生电解液的析氢反应,从而导致气压不断升高;充电继续,电极极化不断加剧,电极电压也不断升高,致使产气速率也不断增大;当充电至80%时,正极会析出氧气,氢气和氧气的同时析出,使产气速率进一步增大,电池气压急剧升高,在图5(c)中表现为曲线变陡,斜率不断增大,当停止充电时,电池气压达到了14 kPa。电池放电时,铁负极发生氧化反应,无法生成气体,因此电池的气压保持不变;随着循环的推进(图5(a)、5(e)),上述过程不断重复,从而使电池气压不断累积上升,只需经过5次循环,电池气压就能达到泄压值(100 kPa),导致电池无法密封(图5(a))。
当装上20WxC/CA-AB催化剂后(8.1 mg),铁镍电池在充放电过程中的气压变化如图5b、d、f所示。可以看出,电池气压呈锯齿状逐渐上升,当循环至第6次时,气压开始下降(图5b)。在化成循环中(图5f),由于大量非活性物质的存在,电极反应主要表现为析氢,从而导致电池气压升高;同时,由于充电容量较低导致放电时间也较短,只能完成少量的氢氧复合反应,大量的氢氧无法在放电阶段复合,气体的积聚使电池气压在循环过程中不断升高。当化成完成铁负极活化以后的正常循环过程中(图5d),电极反应主要表现为氢氧化亚铁的还原反应,析氢反应大大减弱,再加上氢氧复合反应的同步进行,充电结束时电池气压只升高了9 kPa;相应地,由于活化后电极容量的提高,放电时间较长,氢氧复合反应能够在放电阶段充分进行,放电截止时,电池气压较充电结束时下降了14 kPa,较上个循环下降了5 kPa(图5d),随着循环的推进,电池气压不断下降(图5b)。
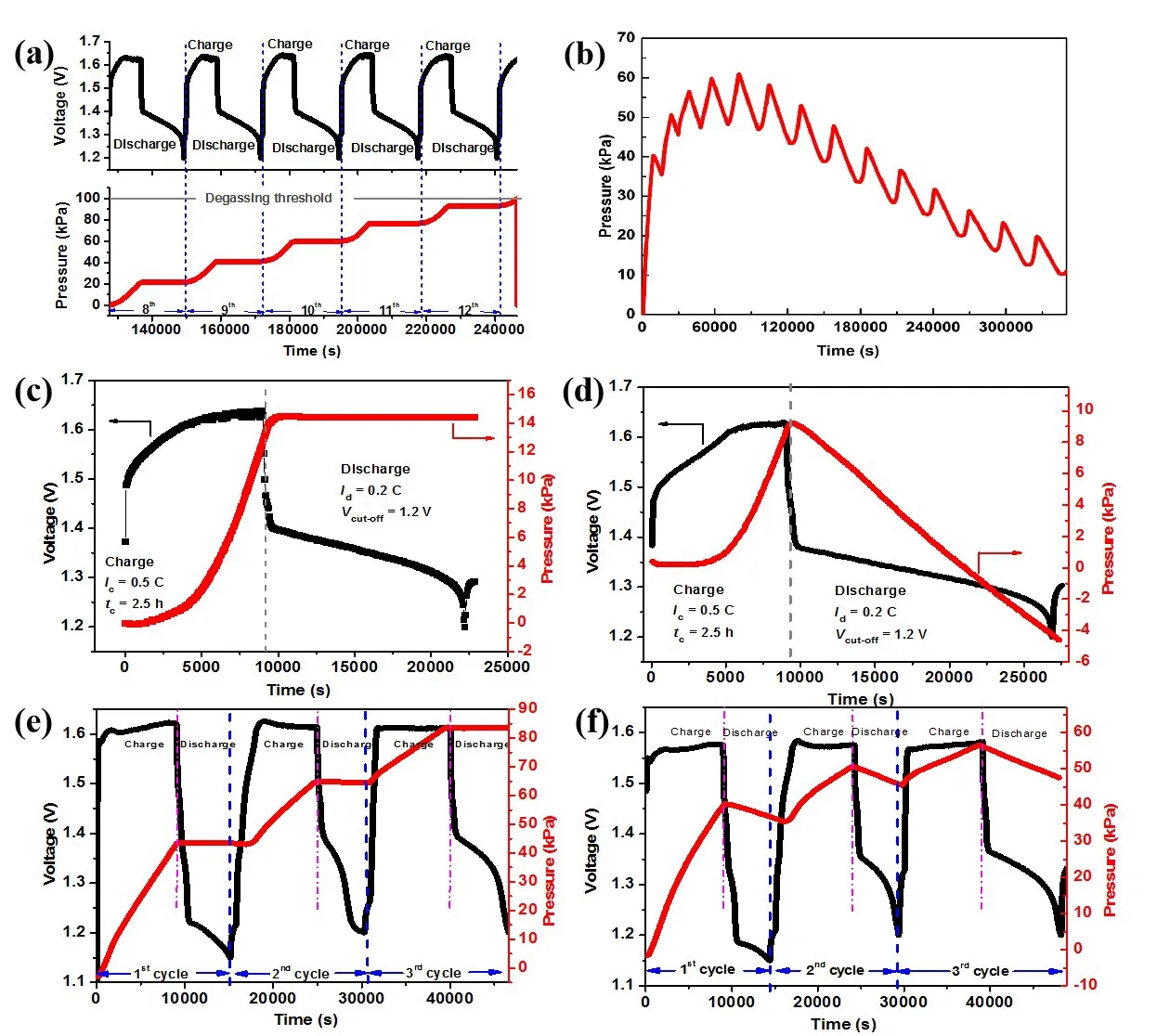
图5 空白铁镍电池的气压与充电态关系: (a)第8 ~ 13次循环;(c)第11次循环; (e)第1~ 3次化成循环;贫液、密封铁镍电池在 催化条件下的性能:(b)气压与充电态关系图; (d)第8次循环;(f)第1~3次化成循环Fig.5 The Pressure Versus State-of-Charge Results of a Nickel-Iron Battery Without Catalyst:(a) 8~ 13th cycles; (c) 11th cycle; (e) 1st ~ 3rd cycles;The performance of the Sealed,Starved-Electrolyte Nickel-Iron Battery with Catalyst: (b) the Pressure of the Battery; (d) Pressure Versus State of Charge Results of 8th Cycle; (f) Pressure Versus State of Charge Results of 1st ~ 3rd cycles
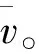
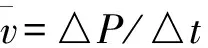
(3)
PV=nRT
(4)
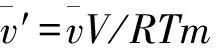
(5)
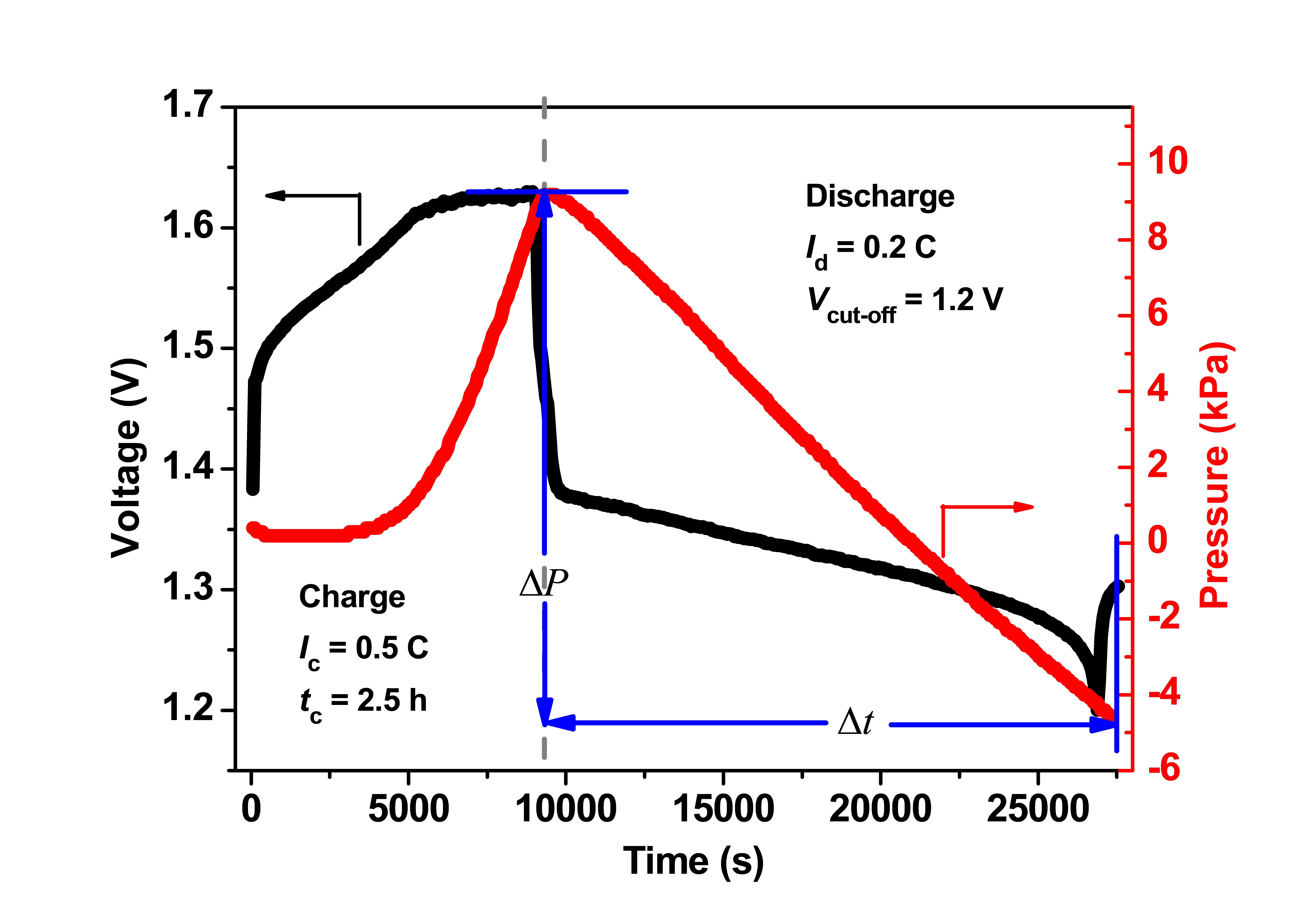
图6 20WxC/CA-AB在铁镍电池中的氢氧复合反应 动力学曲线Fig.6 The Kinetic Curve of the Recombinant reaction of Hydrogen and Oxygen in Nickel-Iron Battery with 20Wx C/CA-AB Nanocomposite Catalyst
2.4 氢氧复合催化机理
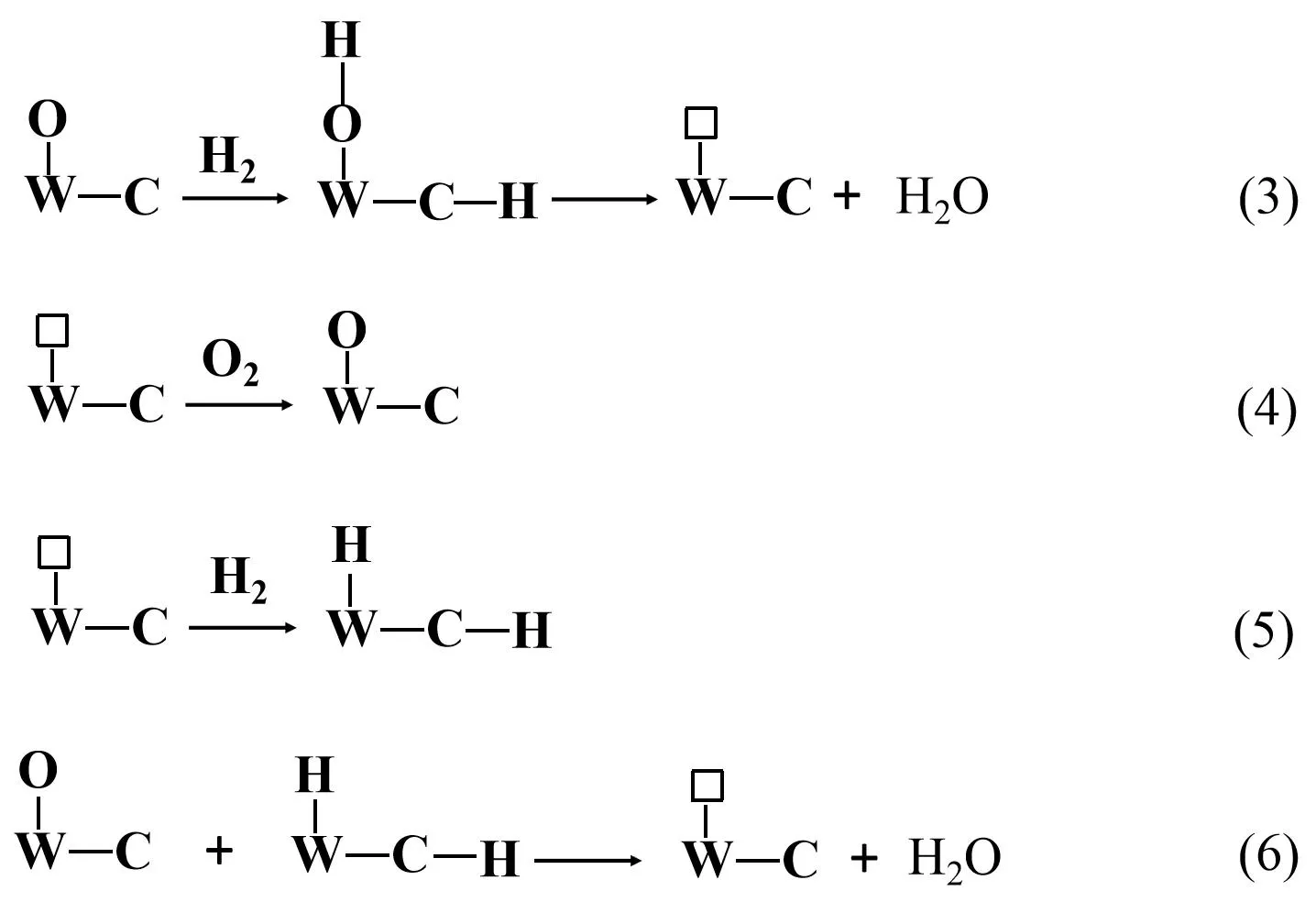
通过TPD-MS检测(图7),在室温下观察到了羟基自由基(OH)和水分子(H2O),表明WxC/CA-AB的确是氢和氧复合的活性催化剂。根据Furimsky E[22]阐述的碳化钨表面氢吸脱附机理,室温下,在铁镍电池中20WxC/CA-AB的氢氧复合催化机理可以表述如下(反应6~9所示):首先,氢气在催化剂表面被激活吸附形成中间体,然后氢氧根(OH)和激活吸附氢(H)转换为水分子(H2O),同时,在催化剂表面重新形成了W-碳缺陷位(用“□”表示)(反应6);在电池气室的富氧环境下,碳缺陷位会立刻被氧填补形成碳氧化钨(反应7),同时,产生的氢气会被□-W-C异裂解离而激活(反应8),在WxC颗粒表面的氢氧自由基被转换为水分子(反应9),再一次重新在催化剂表面形成W-碳缺陷位;氢气的活化吸附也会以反应6的方式同步进行;周而复始,氢氧复合反应在催化剂表面不断进行,实现了电池压力的降低及密封免维。
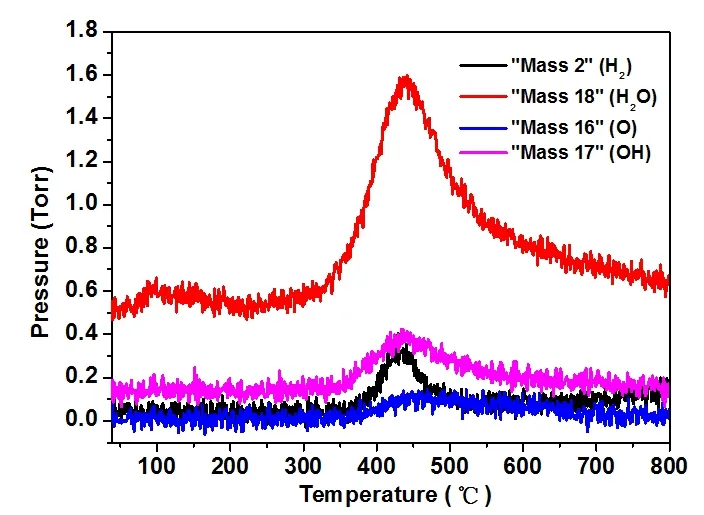
图7 20WxC/CA-AB纳米复合材料的TPD-MS谱图Fig.7 TPD-MS Test of 20WxC/CA-AB Catalyst
3 结论
(a)使用价格低廉的乙炔黑作为碳源及载体制备非贵金属纳米复合材料。为了能更好地锚定纳米催化材料,避免其团聚,用柠檬酸(CA)对乙炔黑进行功能化修饰,通过高温固相原位渗碳处理制备了WxC/CA-AB纳米复合材料,WxC颗粒粒径为6~8 nm,且均匀地分布在柠檬酸修饰的碳载体上;
(b)WxC/CA-AB纳米复合材料在铁镍电池中表现出了良好的氢氧复合催化性能,平均催化速率为1087 μmolh-1gcat-1(3901μmol h-1g活-1),且不间断测试了3.5×105s后,催化剂的催化性能依然没有衰减的迹象,说明催化剂具有良好的稳定性和长寿命性能;
(c)非贵金属催化剂的使用可以在常温常压下有效地将铁镍电池充电过程产生的氢气和氧气催化复合为水,使铁镍电池可以密封、免维护的同时,保持其低成本的优势,使其作为偏远地区大规模储能蓄电池成为可能。

