miR-135b-5p通过靶向下调XBP1增强MCF-7/DOXR细胞对阿霉素敏感性的机制*
毛俊峰 黄向华 卫颖泽 程春 陈橼 吴晓丹
(南通市肿瘤医院 1.外科,2.病理科,江苏 南通 226001)
乳腺癌是全球女性最常见的恶性肿瘤之一,占女性恶性肿瘤病例的25%。化疗药物在乳腺癌的治疗中起着举足轻重的作用,但化疗后近一半的患者对药物化疗产生了多药耐药性,使得临床化疗效果远不能令人满意[1-3]。因此,探索耐药发生的分子机制对于乳腺癌药物化疗具有至关重要的作用。研究证实,肿瘤细胞内蛋白分子的异常表达参与了肿瘤细胞的耐药,有文献报道,X盒结合蛋白1(XBP1)在乳腺癌[4]、结直肠癌[5]、膀胱癌[6]等多种肿瘤耐药细胞中高表达,此外,研究进一步发现XBP1促进乳腺癌细胞对他莫昔芬的耐药性[7]。miRNA是一类非编码小RNA,研究证实,miRNA的异常表达通过调控下游基因在乳腺癌细胞对阿霉素耐药过程中发挥作用,如,miR-452可以调节胰岛素样生长因子1受体(IGF-1R)缓解乳腺癌MCF-7细胞对阿霉素的耐药性[8]。近期研究发现miR-135b-5p在乳腺癌细胞中作为一类抑癌基因低表达[9-11],并通过调控下游基因参与乳腺癌的化疗敏感性[12]。但miR-135b-5p通过调控XBP1对乳腺癌细胞阿霉素耐药性敏感性的机制并不清楚。因此,本研究将通过检测XBP1对MCF-7/DOXR细胞化疗抵抗性细胞生物学行为的影响,并进一步探讨miR-135b-5p通过靶向调控下游XBP1影响对阿霉素敏感性的机制介导MCF-7/DOXR细胞放疗抵抗作用的机制。
1 材料和方法
1.1 细胞系和主要试剂 乳腺癌细胞系MCF-7(货号:ATCC HTB-22)、MDA-MB-231(货号:ATCC HTB-26)购买于ATCC细胞库;正常乳腺细胞珠Hs 578Bst(货号:BNCC337668)均购买于BNCC细胞库;DMEM培养基和TRIzol试剂盒购于Thermo Fisher Scientifi公司;10%FBS、青霉素和链霉素购于Biowest公司;阿霉素购自ApexBio公司;PrimeScript cDNA试剂盒和LipofectamineTM2000购于Takara公司;SYBR Green I Master qRT-PCR试剂盒购于Roche公司;免疫印迹一抗(Anti-XBP1)和二抗(羊抗兔IgG)从Cell Signaling Technology购买;CCK-8试剂盒购于日本同仁公司;miR-135b-5p mimics/inhibitor、sh-XBP1/pcDNA-XBP1载体以及引物由GenePharma公司构建和购买; Annexin V-FITC/PI购自KeyGENBioTECH公司;双荧光素酶载体和试剂盒购于Promega公司。
1.2 细胞培养、转染、药物处理及分组 MCF-7(亲本MCF-7细胞)、MDA-MB-231细胞系和Hs 578Bst细胞采用含10%FBS、青霉素(100 U/mL)和链霉素(100 μg/mL)的DMEM培养液中于37℃、5% CO2培养箱常规培养;随后将MCF-7细胞暴露于剂量递增的阿霉素(0.1、0.5、1.0、2.0和5.0 μm)中,当MCF-7细胞无凋亡并能稳定增殖是表明MCF-7/DOXR构建成功。取对数生长期的MCF-7/DOXR细胞接种于6孔板中,调整细胞密度为1×104细胞/孔,于培养箱培养24 h,之后按照LipofectamineTM2000说明书转染阴性对照(NC组)、sh-XBP1(sh-XBP1组)、miR-135b-5p mimics/inhibitor(miR-135bp-5p mimices/inhibitor组),待转染72 h后于荧光显微镜下观察细胞的转染效果。为了探究MCF-7/DOXR细胞对阿霉素的敏感性,细胞成功转染NC、sh-XBP1(敲降XBP1)、miR-135b-5p mimics后经过阿霉素处理,即NC+DOXR组、sh-XBP1+DOXR组、miR-135b-5p mimics+DOXR组。为了探究MCF-7/DOXR细胞对阿霉素的敏感性的机制,细胞成功转染NC、miR-135b-5p mimics、pcDNA XBP1(过表达XBP1)+miR-135b-5p mimics后经过阿霉素处理,即NC+DOXR组、miR-135b-5p mimics+DOXR组、pcDNA XBP1+miR-135b-5p mimics+DOXR组。
1.3 RT-qPCR检测miR-135b-5p和XBP1 mRNA的表达 使用TRIzol试剂分离总RNA。使用PrimeScript cDNA合成试剂盒逆转录合成cDNA,采用SYBR Green I Master qRT-PCR试剂盒将逆转录产物进行PCR,分别以β-actin和U6为内参检测miR-135b-5p和XBP1 mRNA的表达,引物序列如下:miR-135b-5p F: 5′-CGGGCTATGGCTTTTTATTCC-3′、miR-135b-5p R: 5′-CAGCCACAAAAGAGCACAAT-3′;U6 F: 5′-CTCGCTTCGGCAGCACA -3′,U6-R: 5′-AACGCTTCACGAATTTGCGT-3′;XBP1 F: 5′-TCCTGTTGGGCATTCTGGAC-3′,XBP1 R: 5′-GG CTGGTAAGGAACTGGGTC-3′;β-actin F: 5′-CCG TTCCGAAAGTTGCCTTTT-3′,β-actin R: 5′-ATC ATCCATGGTGAGCTGGC-3′;PCR热循环参数:95℃ 5 min,94℃ 30 s,60℃ 30 s,进行40个循环。检测结果采用2-ΔΔCt法进行计算。
1.4 Western bolt检测细胞XBP1蛋白表达水平 收集经处理的MCF-7/DOXR细胞,采用RIPA裂解30 min,4 ℃下以14,000×g离心15 min去除细胞沉淀。用Nanodrop 2000分光光度法对蛋白质进行定量,10%SDS-PAGE分离蛋白,并将其转移至聚偏二氟乙烯(PVDF)膜。在5%脱脂奶粉中封闭2 h后4°C下用一抗(1∶1500)孵育过夜,次日缓冲液冲洗膜3次后加入二抗(1∶5000)室温孵育1h。用TBST洗涤后,加入ECL化学发光液显色,采用Image J软件分析靶带的灰度水平。
1.5 CCK-8实验检测MCF-7/DOXR细胞增殖活力 收集经处理并处于对数生长期的MCF-7/DOXR细胞接种于96孔板,调整细胞密度为1×104细胞/孔,于37℃,5% CO2培养箱常规培养培养,在检测前,向每孔加10 μL CCK-8溶液后避光孵育4 h,采用酶标仪检测450nm处的OD值。
1.6 Annexin-V-FITC双染流式术检测MCF-7/DOXR细胞凋亡水平 收集经处理并处于对数生长期的MCF-7/DOXR细胞,PBS清洗2次后与500 μL预冷的1×结合缓冲液混合,室温下将溶液与5 μL Annexin-V-FITC和10 μL Propidium Iodide均匀混合避光双染15 min后检测MCF-7/DOXR细胞的凋亡情况。
1.7 双荧光素酶报告基因实验验证miR-135b-5p与XBP1靶向关系 合成XBP1 mRNA的3,-UTR并将其克隆到pmirGLO双荧光素酶报告基因载体上构建pmirGLO-XBP1-WT/MUT载体,将NC/miR-135b-5p mimics与pmirGLO-XBP1-WT/MUT构建重组质粒,将构建的质粒与对照组与LipofectamineTM2000混合后转染293T细胞,在37℃、5% CO2培养箱培养48 h后采用双荧光素酶报告基因检测细胞荧光素酶活性。

2 结果
2.1 XBP1在乳腺癌细胞系和阿霉素耐药细胞珠MCF-7/DOXR中高表达 RT-qPCR检测结果表明,在乳腺癌细胞系中XBP1 mRNA的表达显著高于Hs 578Bst细胞(P<0.05),MCF-7/DOXR细胞中XBP1 mRNA的表达显著高于亲本MCF-7细胞(P<0.05)(见图1A)。Westernblot结果表明,与Hs 578Bst细胞相比,XBP1在乳腺癌细胞系中的表达水平显著升高(P<0.05),MCF-7/DOXR细胞中XBP1的表达显著高于亲本MCF-7细胞(P<0.05)(见图1B)。CCK-8检测结果表明,不同浓度的阿霉素对MCF-7/DOXR细胞增殖活力有显著的抑制作用,IC50值为1.91 μmol/L(P<0.05)(见图1C),后续实验采用2.0 μmol/L的阿霉素处理MCF-7/DOXR细胞。实验结果表明,XBP1在乳腺癌细胞系和阿霉素耐药细胞珠株MCF-7/DOXR中高表达。
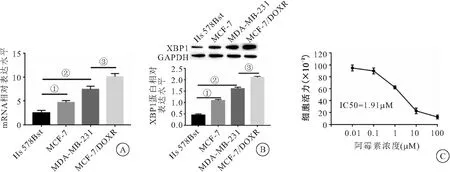
图1 XBP1在乳腺癌细胞系和顺铂耐药细胞珠MCF-7/DOXR中高表达
2.2 敲降XBP1促进MCF-7/DOXR细胞对阿霉素的敏感性 Westernblot结果表明,敲降XBP1显著下调了MCF-7/DOXR细胞中XBP1的表达水平(P<0.05)(见图2A)。CCK-8检测细胞增殖结果表明,与NC+DOXR组相比,sh-XBP1+ DOXR组显著抑制MCF-7/DOXR细胞增殖活力(P<0.05)(见图2B)。Annexin V-FITC /PI检测细胞凋亡结果表明,与NC+DOXR组相比,sh-XBP1+ DOXR组显著促进MCF-7/DOXR细胞凋亡水平(P<0.05)(见图2C)。结果表明敲降XBP1促进MCF-7/DOXR细胞对阿霉素的敏感性。

图2 敲降XBP1促进MCF-7/DOXR细胞对阿霉素的敏感性
2.3 miR-135b-5p与XBP1的靶向关系 通过Starbase(http://www.starbase.sysu.edu.cn)数据库预测结果发现,XBP1是miR-135b-5p下游潜在靶标(见图3A)。同时,双荧光素酶报告基因验证发现,过表达miR-135b-5p可显著下调XBP1野生型质粒内荧光强度(P<0.05)(见图3B)。Western blot检测结果表明,在MCF-7/DOXR细胞中敲降miR-135b-5p显著上调XBP1的表达(P<0.05)(见图3C)。结果表明,miR-135b-5p下调XBP1的表达。

图3 miR-135b-5p下调XBP1的表达
2.4 过表达miR-135b-5p 通过下调XBP1促进促进MCF-7/DOXR细胞对阿霉素的敏感性,RT-qPCR检测结果表明,在MCF-7/DOXR细胞中转染miR-135b-5p mimics可显著上调miR-135b-5p的表达水平(P<0.05)(见图4A);Westernblot检测结果表明,在MCF-7/DOXR细胞中转染miR-135b-5p mimics可显著下调XBP1的表达水平;而同时过表达XBP1和miR-135b-5p的MCF-7/DOXR细胞中XBP1的表达水平与对NC组相比差异无统计学意义(P>0.05)。CCK-8检测MCF-7/DOXR细胞增殖结果表明,与NC+DOXR组相比,miR-135b-5p mimic+DOXR组处理后显著抑制MCF-7/DOXR细胞增殖活力(P<0.05)(见图4B),pcDNAXBP1+miR-135b-5p mimics+DOXR组MCF-7/DOXR细胞增殖活力与NC+DOXR组相比差异无统计学意义(P>0.05)。Annexin V-FITC/PI检测MCF-7/DOXR细胞凋亡结果表明,与NC组与DOXR组相比,miR-135b-5p mimic+DOXR组显著促进MCF-7/DOXR细胞凋亡水平(P<0.05)(见图4C),而pcDNA XBP1+miR-135b-5p mimics+DOXR组的MCF-7/DOXR细胞凋亡水平与NC组与DOXR组相比差异无统计学意义(P<0.05)(见图4D)。结果表明,过表达miR-135b-5p通过下调XBP1促进MCF-7/DOXR细胞对阿霉素的敏感性。

图4 miR-135b-5p靶向XBP1调控MCF-7/DOXR细胞对阿霉素的敏感性
3 讨论
XBP1是一种碱性亮氨酸拉链结构蛋白,参与了未折叠的蛋白应答(UPR)和内质网(ER)应激激活,UPR是由ER应激激活的一组信号传导途径,已被证明是治疗肿瘤耐药的关键机制之一[7,13-14],研究证实XBP1能效诱导UPR发生进而在乳腺癌[13-14],膀胱癌[6]等多种肿瘤细胞耐药机制中发挥重要调控,Clarke等[15]发现XBP1过表达导致乳腺癌细胞对他莫昔芬和faslodex的敏感性降低;Chen等[4]证实当下调XBP1时通过抑制HIF途径抑制了肿瘤的生长和药物化疗后的复发,Ding等[16]及团队也证实XBP1表达在抗雌激素治疗的乳腺癌细胞系中增加,并且在乳腺癌肿瘤中与雌激素受体α(ERα)共表达促进乳腺癌细胞的耐药,在本研究中,发现XBP1的表达水平与乳腺癌细胞对阿霉素的敏感性有关,当上调XBP1时能促进MCF-7/DOXR细胞凋亡并抑制起增殖,增加了对阿霉素敏感性,此外,有文献[17]报道,细胞角蛋白19通过上调XBP1表达增强乳腺癌BT549细胞的耐药;miR-34a通过下调XBP1促进性髓细胞白血病(AML)细胞系对硼替佐米等药物化疗的敏感性[18],这表明其他分子机制能通过调节XBP1的表达进而在肿瘤耐药机制中发挥作用。本研究进一步发现miR-135b-5p可以靶向下调XBP1的表达。
miRNA在多种细胞过程(例如增殖和分化)中发挥重要作用,同时,研究发现miRNA可作为肿瘤耐药性的预测指标在包括乳腺癌的多种恶性肿瘤耐药中异常表达[19-20]。如Hu等[8]证实miR-452可以调节胰岛素样生长因子1受体(IGF-1R)缓解乳腺癌MCF-7细胞对阿霉素的耐药性,Zeng等[21]发现miR-129-5p通过靶向下调SOX2抑制乳腺癌中的阿霉素耐药性。然而,miRNA介导的XBP1在乳腺癌中耐药中的调控尚不清楚。本研究根据生物信息学预测并结合双荧光素报告基因实验发现miR-135b-5p可以靶向负调控XBP1的表达。此外,近期研究发现miR-135b-5p在乳腺癌细胞中作为一类抑癌基因低表达[9];Zhang等[12]研究也发现上调miR-135b-5p能促进乳腺癌细胞的对阿霉素的化疗敏感性;此结果和本研究结果一致,同时本研究证实miR-135b-5p在细胞中低表达并靶向下调XBP1蛋白表达水平,当上调miR-135b-5p能增强MCF-7/DOXR细胞对阿霉素敏感性。
4 结论
本研究结果提示,miR-135b-5p通过下调XBP1促进细胞凋亡并抑制其增殖,此次实验结果在一定程度上将为今后临床上乳腺癌阿霉素耐药的治疗提供新的研究思路。

