干旱对甜菜叶丛期光系统Ⅱ及光合作用的影响
李思忠,高卫时,张立明,白晓山,刘 军,董心久,杨洪泽,沙 红,高 燕
(新疆农业科学院经济作物研究所,新疆乌鲁木齐 830091)
干旱胁迫是影响干旱区或半干旱区甜菜生产力的主要非生物胁迫之一[1]。新疆甜菜总产及产糖量仅次于内蒙古[2]。虽然甜菜采用膜下滴灌技术,使得甜菜产量和水分利用效率得到进一步提高,但新疆水资源分布不均、土壤保水保肥能力弱等特点,部分地区在甜菜生长关键期常遭遇持续性干旱[3]。加之甜菜需水量大,极端天气(干旱、高温)频发等,严重影响植株的光合作用[4-5]。因此,干旱仍然是制约新疆甜菜产量形成的最大逆境生态因子之一[6]。
干旱胁迫对植物的影响是多方面的,缺水会降低叶片气孔开度,导致叶片蒸腾速率和二氧化碳同化能力的降低,反过来,又会影响光反应和二氧化碳固定途径之间的内在平衡,从而导致叶片吸收的能量过度被激发,并对PSⅡ造成氧化损伤,进一步降低叶片的光合能力,抑制叶片的新陈代谢[7-10]。干旱胁迫直接或间接的影响了叶片光系统,特别是对光系统Ⅱ,从而改变了叶绿素a 的荧光动力学特性[11-12]。快速叶绿素a 荧光测定因其无破坏,高度灵敏,快速且极易操作等特性,已被广泛用于分析植物对不同类型逆境的响应[13]。如高温胁迫、盐胁迫、重金属胁迫、营养缺乏等[14-15]。科研工作者基于生物膜能量流动理论,开发了JIP-test 数据分析方法[16],通过该方法量化了最终反映整个光合作用机制活动的结构和功能参数,可以得到关于光系统Ⅱ(PSⅡ)、反应中心(RC)和放氧复合体等丰富的信息,被广泛应用筛选不同物种和基因型的抗逆性[17]。例如,性能指数(PI)是可作为评估植株抗旱能力的敏感指标[18]。干旱胁迫导致叶绿素a 瞬变荧光迅速上升,PSⅡ单位之间能量连接性变差,光合酶受到抑制,PSⅡ活性和稳定性降低,电子传递反应和碳同化代谢之间的内在平衡被破坏,从而限制叶片光合能力[10]。大量研究表明,甜菜叶丛生长期供水不足下叶片光合能力降低,产量下降。前人对干旱胁迫下甜菜叶片光合生理特性进行了一些研究,但有关干旱区滴灌甜菜叶丛生长期叶片光系统Ⅱ结构和功能对干旱胁迫的响应机制研究报道似乎较少。因此,本试验采用两个对干旱胁迫有不同敏感性的品种,在甜菜水分敏感期叶丛生长期进行控水,利用植物效率分析 仪(Handy-PEA,Hansatech, Norfolk, UK),同 时 通过JIP-test 数据分析方法评估了干旱胁迫对叶片光合系统的影响,以期为滴灌甜菜高产栽培管理提供理论依据。
1 材料与方法
1.1 试验条件及试验设计
试验于2018年在新疆农业科学院玛纳斯甜菜试验基地进行。试验区土壤为壤土,耕层土壤速效磷含量0.02 g·kg−1,速效钾含量0.023 g·kg−1,碱解氮含量0.07 g·kg−1,田间持水量为16%(质量含水量)。试验采用随机区组设计,3次重复,小区面积为10 m2,每小区长5 m,宽2 m,各小区间间隔1 m。供试甜菜品种分别为XJT9907(旱敏感型)、XJT9916(耐旱型)。4月15日施磷酸二铵375 kg·hm−2和硫酸钾150 kg·hm−2后春翻整地覆膜,4月17日播种,一膜两行,滴灌带铺于两行甜菜中间,即1条毛管控制2行甜菜,行距为50 cm,株距为20 cm,株数为11.12 ×104株·hm−2。于甜菜叶丛生长期进行控水,每隔3至4 d 利用土钻采集土壤样品测定土壤含水量,当土壤含水量低于设置的土壤水分控制下限时,通过水表控制灌水量,使0−50 cm 土层含水量为田间持水量的45%~50%持续7 d 作为干旱胁迫处理,然后测定相关荧光参数。对照含水量始终保持为田间持水量的70%~75%。
1.2 指标测定及方法
快速叶绿素a 荧光诱导曲线的测定:根据Strasser等[19]的 方 法,在11:00−13:30,利用植物效率分析仪(Handy-PEA,Hansatech, Norfolk,UK),于室温下测量了各处理第15片全完展开叶的荧光参数。在测量之前,每个处理选取5株,用叶夹固定(Hansatech)暗适应30 min。然后打开叶夹,用3个发光二极管(波长650 nm)提供3 000μmol·(m2·s)−1的饱和光脉冲照射各处理2 s。从10μs到1 s记录快速叶绿素a 荧光动力学,采集20μs(FO)、300μs(FK)、2 ms (FJ)、30 ms(FI)和最大荧光强度(Fm)的荧光强度,所有数据用PEA Plus软件进行分析,得到OJIP测试参数,具体参数计算方法及含义详见文献[19-20],具体指标的含义如表1所列。为了进一步分析不同处理间荧光动力学的差异,将初始叶绿素a 荧光(OJIP)瞬变在FO和Fm之间进行归一化,确定相对可变荧光VOX=(Ft−FO)/(FX−FO),X分别表示K、I、J、P和t为自变量(照射时间); ∆VOX=VOX(干旱处理)−VOX(对照);VIP=(Ft−FI)/(Fm−FI)。

表1 叶绿素荧光动力学参数Table 1 Kinetic parametersof chlorophyll fluorescence
叶片净光合速率的测定:在自然光强下,于11:00到13:00,用CIRAS-3便携式光合仪(PP Systems,USA)在田间活体测定各处理甜菜倒三全完展开叶的净光合速率[Pn,μmol·(m2·s)−1],参比室CO2浓度为400μmol·mol−1,流速设置为300μmol·s−1。每个处理测定4株,以3 片叶的平均值为该处理的测定值。
1.3 数据分析
数据分析均采用SPSS19.0统计软件进行,用平均值± 标准误表示测定结果,分别对同一品种不同干处理进行双因素方差分析,并用Duncan 法对各测定数据进行多重比较;采用Excel 2016制图。
2 结果
2.1 干旱处理对快速叶绿素a 荧光诱导动力学曲线的影响
各处理叶片快速荧光瞬变过程均呈现出典型的多相上升OJIP(图1)。暗适应植株开始照光后,XJT9907品种处理间瞬态荧光就表现出明显的变化,而XJT9916品种叶片处理间在照光后0.01 s之前差异不明显。为了进一步分析不同处理间荧光动力学的差异,对F0和Fm之间的初始叶绿素荧光进行标准化处理,确定了相对荧光VOP,在OJ 相干旱处理叶片相对荧光迅速增加,随后增加放缓,在I点后又迅速增加,于P点达最大值。另外,XJT9907和XJT9916品种干旱处理叶片叶绿素a 相对荧光值在K 点分别比对照高25.9%和23.1%。这表明,干旱胁迫破坏了PSⅡ的反应中心,PSⅡ放氧复合体供体侧受到了损伤,抑制了PSⅡ的光化学反应;相对XJT9916品种,XJT9907品种在干旱胁迫下损伤更严重。
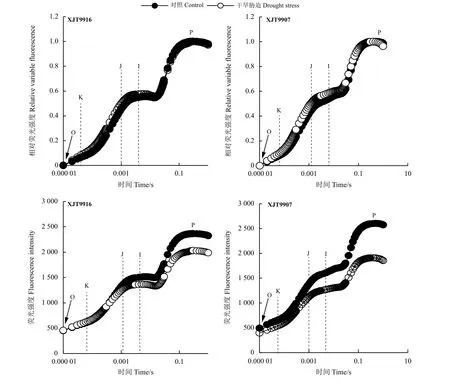
图1 干旱胁迫下叶片荧光诱导曲线Figure 1 Fluorescence induction curve of leaves under drought stress
2.2 干旱处理对快速叶绿素a 荧光诱导动力学曲线OK 和OJ 相的影响
K 带反映了放氧复合体的失活或功能性PSⅡ天线尺寸的大小,L 带是反映PSⅡ单元之间能量连接或分组情况。两品种在干旱条件下L 带和K 带均清晰可见,并分别在0.15 ms和0.25 ms附近有一个峰值(图2)。干旱胁迫处理可变荧光值均高于对照处理。这说明,干旱胁迫下叶片PSⅡ单元之间能量连接性变低,PSⅡ供体侧与受体侧间电子传递不平衡,利用激发能的能力和光合系统稳定性降低。

图2 干旱胁迫下叶片荧光OK 相及OJ 相Figure 2 Fluorescence OK phase and OJ phase of leavesunder drought stress
2.3 干旱处理对快速叶绿素a 荧光诱导动力学曲线OI 相的影响
为了评估OI相,对0.03~30 ms的荧光瞬态数据进行标准化处理[VOI= (Ft−F0)/ (FI−F0)],得到荧光动力学差曲线[ΔVOI=VOI(处理)−VOI(对照)]。植株VOI可变瞬态荧光曲线当VOI< 1可反映PSⅡ捕获的能量到质体醌的情况,当VOI≥1可反映质体醌至PSⅠ最终电子受体的电子转移情况。如图3所示,干旱胁迫均增加了可变荧光值(VOI< 1),ΔVOI动力学差曲线均表现出明显的正偏差。在可变荧光值VOI≥1时,干旱胁迫下XJT9907可变荧光值明显高于对照;与XJT9907相比,XJT9916品种处理间差异不是很明显。这说明,干旱处理的植物捕获的能量传递到传递到电子链的末端降低,PSⅠ末端电子受体容量减小,尤其XJT9907品种。

图3 干旱胁迫下叶片荧光OI 相Figure 3 Fluorescence OI phase of leaves under drought stress
2.4 干旱处理对快速叶绿素a 荧光诱导动力学曲线IP相的影响
为了评估IP相,对30~180 ms的瞬态荧光数据进行标准化处理[VIP=(Ft−FI)/(Fm−FI)],作出荧光动力学差曲线[ΔVIP=VIP(处理)−VIP(对照)],这可反映出到达PSⅠ受体的电子通量的情况(图4),其中达到VIP=0.5的时间的倒数可估计PSⅠ电子受体整体被还原的速率。干旱胁迫对VIP可变瞬态荧光值的影响较小,处理间差异较小,无法判断出干旱胁迫对PSⅠ末端电子受体的还原速率的影响。
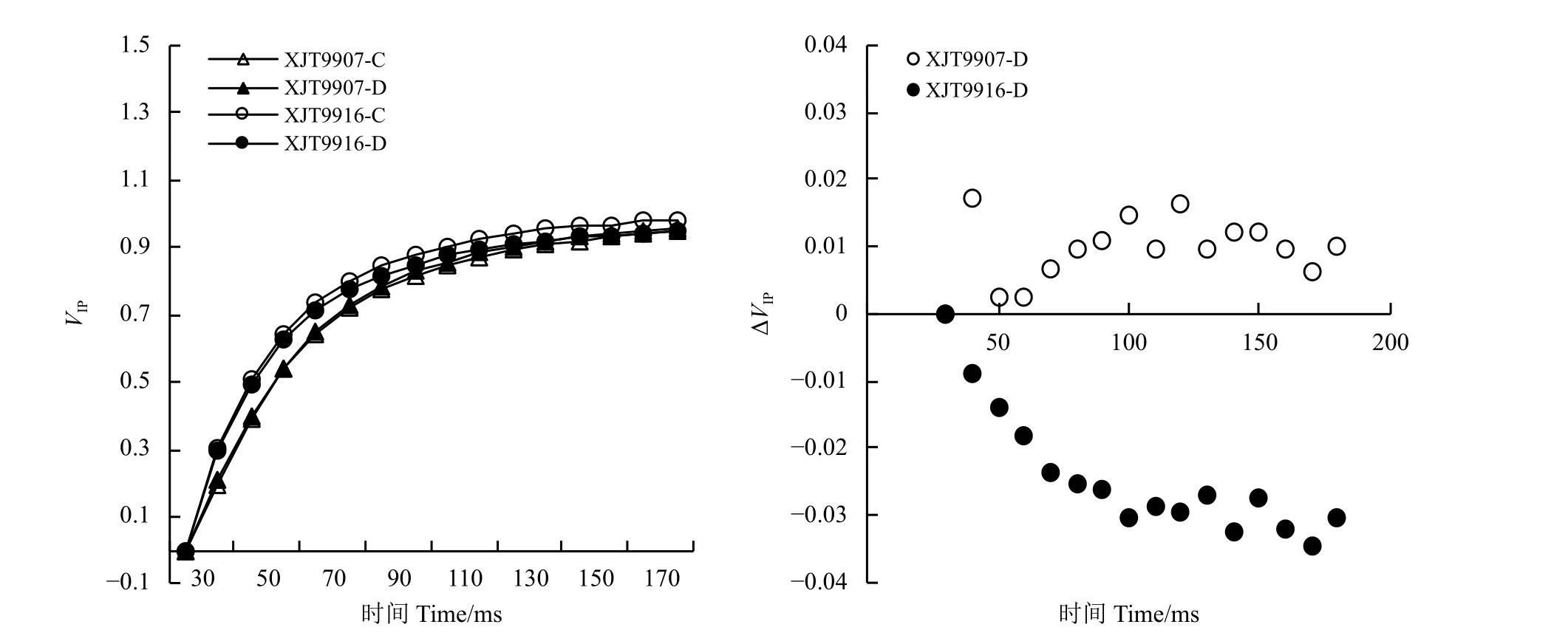
图4 干旱胁迫下叶片荧光IP 相Figure 4 Fluorescence IPphase of leaves under drought stress
2.5 干旱处理对叶绿素a荧光参数的影响
利用JIP-test 数据分析方法,得出干旱胁迫条件下叶片光系统的大量信息如表2所示。干旱胁迫下XJT9907和XJT9916品种的Fv/Fm分别比对照降低2.6%和5.1%,而ABS/RC却增加了16.7%和23.0%。干旱胁迫下XJT9907品种PSⅡ功能降低幅度高于XJT9916,XJT9907和XJT9916品种的RC/CSO分别比对照降低31.0%和17.1%,表现为PSⅡ反应中心失活。XJT9907和XJT9916品种的TRO/CSO分别比对照降低21.9%和3.5%,ETO/CSO分别降低29.8%和9.4%,表现为植株对激发能的捕获和电子传递降低。干旱胁迫下XJT9907品种ABS/CSO、DIO/CSO、REO/CSO分别比对照低19.7%、12.2%和31.4%, 而XJT9916品种ABS/CSO、REO/CSO值略高于对照,处理间DIO/CSO值差异显著。干旱胁迫增加了两品种的DIO/RC、TRO/RC和ETO/RC值,但与对照相比,干旱胁迫降低了XJT9916品种的ΨEO和φEO值,但增加δRO值,对φRO值没有影响。表现为吸收的光能和电子传递到PSⅠ末端的效率降低。干旱胁迫下XJT9907和XJT9916品种的PIabs值分别比对照降低37.9%和42.3%,PItotal值分别比对照降低43.6%和12.0%。这表明,干旱胁迫下叶片光合系统光化学活性和电子传递效率降低,光能转化效率较低,XJT9907品种降低幅度高于XJT9916。
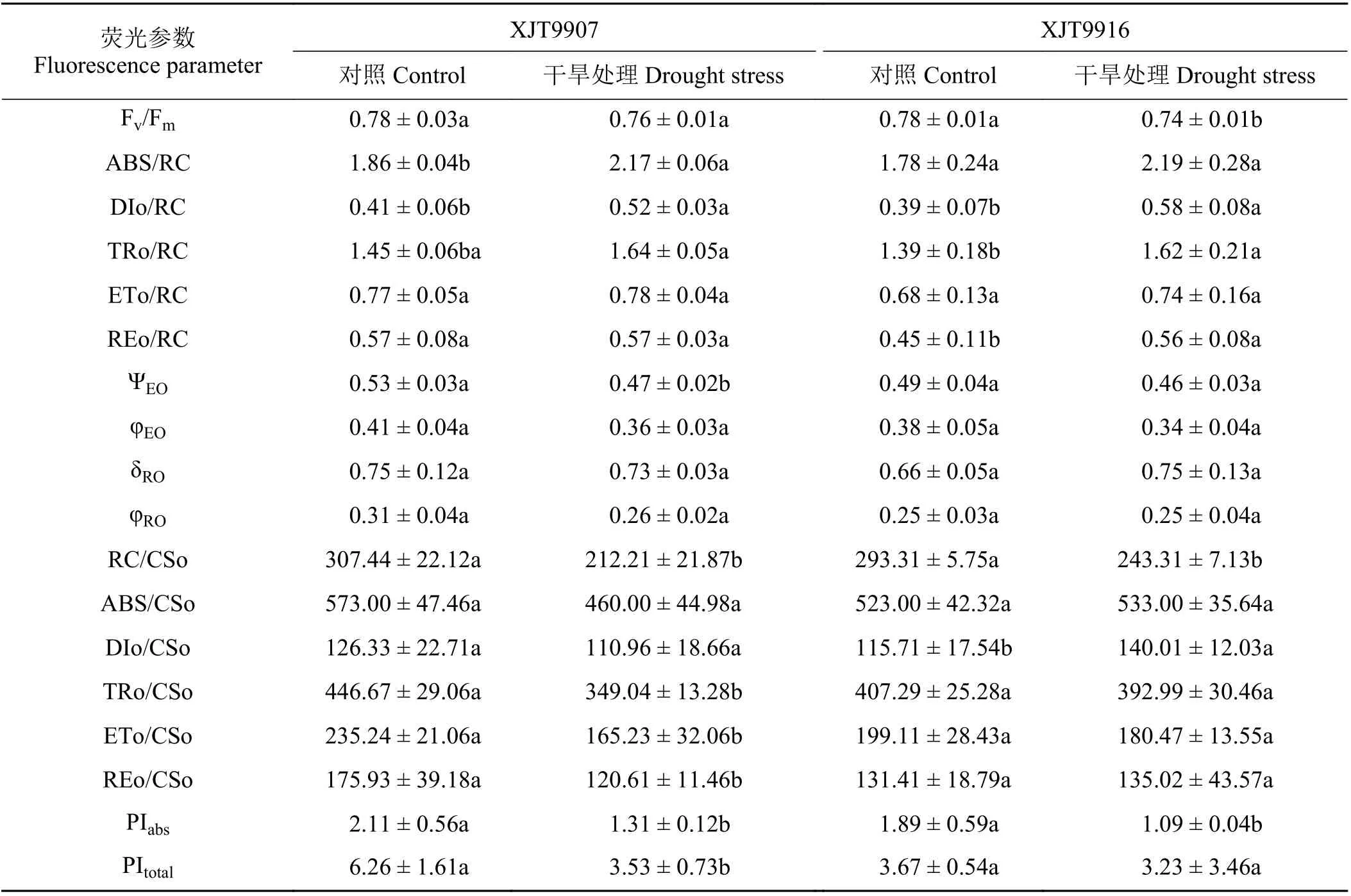
表2 干旱胁迫下叶绿素a 荧光参数Table 2 Chlorophyll a fluorescence parameters under drought stress
2.6 干旱处理对叶片净光合速率的影响
干旱胁迫显著的影响了叶片的光合能力,与对照相比,干旱胁迫下XJT9916和XJT9907品种的净光合速率分别降低了10.3%和32.2%。这说明,干旱胁迫降低叶片净光速率,XJT9916品种降低幅度高于XJT9907(图5)。

图5 干旱胁迫下叶片净光合速率Figure 5 Net photosynthetic rate of leaves under drought stress
3 讨论与结论
干旱胁迫会影响植物的光合系统,从而改变叶绿素a 荧光动力学特征[21]。OJ 相揭示了PSⅡ反应中心QA的光化学还原变化[16]。在本研究中,干旱胁迫下植株叶绿素a 荧光诱导曲线呈现典型的OJIP,其中干旱处理叶片的OJ 相可变荧光强度明显高于对照,这可能是由于QA−的积累所导致[22-23]。一般来说,与正常植物相比,干旱胁迫会导致PSⅠ区域的末端电子受体容量降低[24]。本研究也表明,干旱胁迫降低了植株总电子受体容量的大小,向PSⅠ受体侧转移电子的能力降低,且XJT9907品种降低幅度高于XJT9916,这与Adamski 等[25]的研究类似。在严重的非生物胁迫过程中植株叶片荧光诱导曲线中会显示出L 带和K 带[14,26]。根据Yusuf 等[27]的观点,明显的正L 带则说明PSⅡ单元之间的能量连接或分组的减少,K 带的出现则表明放氧复合物(OEC)失活和/或功能性PSⅡ天线尺寸增加。在本研究中,干旱处理叶片的L 带和K 带均清晰可见,分别在0.15和0.25 ms左右出现峰值。这些结果说明,干旱胁迫导致叶片放氧复合体(OEC)失活,PSⅡ单位之间的能量连接性降低,PSⅡ内受体侧和供体侧电子之间的不平衡。植株为应对干旱胁迫对自身的伤害,会通过关闭气孔避免过多的水分流失,来维持碳同化的平衡[28],但气孔的关闭必然升高叶片温度,从而降低PSⅡ的光化学活性,这也是导致干旱胁迫处理叶片出现明显的L带和K 带的原因[29]。
ABS/RC是对天线尺寸大小的度量,干旱胁迫通常会导致ABS/RC值的增加[14,17]。在本研究中,干旱处理叶片的ABS/RC 值比对照高16.7%~23.0%,这与Jedmowski 等[30]的结果一致。ABS/RC的可能的解释为天线尺寸的大小增加或活性反应中心减少所导致[17]。在本研究中,荧光曲线OJIP在干旱处理中表现出明显的L 带和K 带,且RC/CSO显著降低,进一步部分支持了上述解释。干旱胁迫条件下叶片的DIO/RC、TRO/RC、ETO/RC和REO/RC值升高,与旱敏感型品种XJT9907相比,耐旱型品种XJT9916品种具有较高的单位反应中心电子传递效率(ETO/RC),这可能与能量耗散能力高(DIO/RC),避免了能量的过度被激发,保持了较高的光系统活性(RC/CSo)有关[10,18];干旱胁迫均导致两品种ΨEO、φEO下降;干旱胁迫下XJT9907品种φRO值低于对照,但对XJT9916品种φRO值没有影响,但耐旱型品种降低幅度低于旱敏感型品种。另外,旱敏感型品种具有较低的热耗散能力(DIO/RC,DIO/CSO)可能会增加活性氧类物质(O2−)形成的风险,从而抑制植株D1蛋白的合成及光合酶的活性,并增强氧化损伤[31]。本研究中,干旱胁迫显著降低了旱敏感型品种的TRO/CSO、ETO/CSO和REO/CSO值,降低了ABS/CSO值,而对耐旱型品种的影响较小,DIO/CSO反而高于对照,这有利于耗散过多的能量,维持光合系统的稳定性。旱敏感型品种单位面积电子传递(ETO/CSO)能力较低主要是由于单位面积光能的吸收(ABS/CSO)、捕获的光能(TRO/CSO)较低所导致[18]。
本研究结果表明,干旱胁迫降低了Fv/Fm比值。有研究者指出,PSⅡ比PSⅠ对干旱胁迫更敏感[25],这说明,在本研究条件下干旱胁迫已经对叶片光合系统造成了损伤。与Fv/Fm相比,性能指数(PIabs, PItotal)是反映植物对环境胁迫反应的敏感性指标[18],这是因为性能指数与植物的PSⅡ反应中心、光化学反应和电子传递相联系起来,而Fv/Fm仅与Fv和Fm值的大小有关[32-33]。在本研究中,干旱胁迫下XJT9907和XJT9916品种的PI abs值分别比对照降低37.9%和42.3%,PItotal值分别比对照降低43.6%和12.0%,Fv/Fm仅分别降低了2.6%和5.1%,干旱胁迫下性能指数降低的主要原因是光合电子传递的光化学效率降低。此外,还有研究者认为,L 带、K 带、达到最大荧光的时间和减少的质体醌池(面积)的大小也有助于鉴定植物的抗逆性和光合机构状态[10,18]。
严重干旱胁迫会降低了叶片的净光合速率。本研究结果表明,干旱胁迫显著降低了叶片的净光合速率,这可能是因为叶片主动减小气孔开度来避免过度蒸腾和减少水分散失的一种干旱适应机制,但严重的干旱胁迫会通过气孔限制和叶肉限制共同降低了叶片的同化能力[9,34]。光合能力的降低也会影响光合原初反应和Calvin-Benson 循环之间的平衡,导致存在更多的过剩激发能量,从而对PSⅡ造成光抑制损害[35]。在本研究中,干旱胁迫降低了PSⅡ的光化学活性和电子传递能力。有研究者指出,甜菜碱和脯氨酸等调节剂的应用能够通过提高PSⅡ的耐受性来减轻植物受干旱胁迫的损伤[36],后期将使用甜菜碱和脯氨酸等进行试验研究,以探索减轻干旱胁迫对光合结构的损害的可能途径。
综上所述,甜菜叶丛期土壤含水量为45%~50%田间持水量时,导致XJT9907和XJT9916叶片PSⅡ单元之间的能量连接变差,抑制光系统之间的电子传递,放氧复合体(OEC)失活,PSⅡ内受体侧和供体侧电子不平衡,电子传递反应和Calvin-Benson循环不平衡,导致光抑制破坏,从而降低了叶片的CO2同化能力和光合系统的稳定性,但抗旱品种降低幅度低于敏感型品种。

