王不留行对脂多糖和H2 O2诱导RAW264.7 细胞炎性反应和氧化反应的影响
袁德俊,吴康郁,黄晓冰
(广州中医药大学第三附属医院,广东 广州 510378)
王不留行为石竹科植物麦蓝菜Vaccaria segetalis(Neck.)Garcke 的干燥成熟种子,别名奶米、王不留、麦蓝子、剪金子、留行子,是我国传统常用中药,性味苦,平,归肝、胃经。具有活血通经,下乳消肿,利尿通淋功能,用于乳汁不下、经闭、痛经、乳痈肿痛等症[1]。现代药理学研究表明王不留行具有广泛的药理学作用,包括抗肿瘤、抗炎镇痛、抗氧化、抑制血管生成等药理作用[2]。
目前王不留行抗炎活性研究较少。因此开展中药王不留行相关药效活性研究,有助于王不留行的发展与利用。脂多糖(lipopolysaccharide,LPS)刺激RAW264.7 巨噬细胞是经典体外炎症模型,常用于研究药物抗炎活性;过氧化氢(H2O2)可以造成细胞氧化损伤。本实验将以LPS 刺激RAW264.7 巨噬细胞作为研究载体,通过测定相关炎性因子,探讨王不留行抗炎药效活性;以H2O2造成RAW264.7 巨噬细胞氧化损伤,探讨王不留行抗氧化活性。本实验将为王不留行抗炎抗氧化作用提供实验依据。
1 材料
1.1 药物和试剂 RPMI⁃1640 培养基(批号#8113920)、胎牛血清(批号#42A0378K)、青霉素(批号#J160035)均购买于美国 Gibco 公司;脂多糖(LPS,批号#019M4009V)、二甲基亚砜(DMSO,货号D2650)为美国Sigma 公司;MTT(货号G4000,美国Progema 公司);PBS(货号ST447)、一氧化氮(NO,货号S0021S)检测试剂盒(上海碧云天生物技术有限公司);小鼠TNF⁃α(货号ml002095)、IL⁃1β(货号 ml063132)、IL⁃6(货号ml002293)、PGE2(货号 ml037542)、COX⁃2(货号ml057994)ELISA 试剂盒(上海酶联生物科技有限公司);SOD(货号A001⁃3⁃2)、CAT(货号A007⁃1⁃1)、GSH⁃PX(货号A005⁃1⁃2)、MDA(货号A003⁃4⁃1)试剂盒(南京建成生物工程研究所有限公司)。王不留行来源于岭南中药饮片有限公司,经广州中医药大学第三附属医院吴康郁副主任中药师鉴定为石竹科植物麦蓝菜Vaccaria segetalis(Neck.)Garcke 的干燥成熟种子。
1.2 细胞 RAW 264.7 小鼠单核巨噬细胞,购自American Type Culture Collection(ATCC,USA)细胞资源中心。
1.3 仪器 SW⁃CJ⁃1FD 型超净工作台(苏州安泰空气技术有限公司);DYS⁃810 型显微镜(上海点应光学仪器有限公司);HH4Y 型恒温水浴锅(上海启前电子科技有限公司);Neofuge 15R 型高速冷冻离心机(力康生物医疗科技控股有限公司);DOI⁃50 型恒温培养箱(上海三腾仪器有限公司);LDZX⁃40BI 型立式自动电热压力蒸汽灭菌器(上海申安医疗器械厂);酶标仪和PCR 扩增仪(美国Thermo Scientific 公司)。
2 方法
2.1 王不留行醇提物制备 取药材王不留行于高速中药粉碎机中打成药材粉末,过3 号筛(60 目筛),按1 ∶10 料液比用石油醚回流脱脂2 h,加热蒸发至没有石油醚味,按料液比1 ∶10 加入80%乙醇,回流提取3 次,每次2 h,将所得滤液合并,减压浓缩至没有醇味,冷冻干燥,即得[3]。
2.2 RPMI⁃1640 完全培养基配制 RPMI⁃1640 培养基中添加10%灭活FBS 和1%青霉素,即得。
2.3 LPS 溶液配制 称取5 mg LPS 至量瓶中,加入PBS定容至10 mL,制成500 mg/L LPS 溶液,-20 ℃避光保存。取适量LPS 溶液,RPMI⁃1640 完全培养基稀释至500 ng/mL后,0.22 μm 微孔滤膜过滤,即得。
2.4 王不留行醇提物配制 称取100 mg 王不留行醇提物溶于1.0 mL DMSO,制得100 mg/mL 母液,0.22 μm 微孔滤膜过滤,分别用RPMI⁃1640 完全培养基制成孔内终质量浓度为80、40、20、10 μg/mL,即得。
2.5 MTT 法测定王不留行醇提物对RAW264.7 巨噬细胞细胞活力的影响 取对数生长期的RAW264.7 巨噬细胞,按照4.0×104/孔的细胞浓度接种在96 孔板中,之后放置在5% CO2、37 ℃的恒温培养箱中培养24 h。第2 天弃去原培养基,进行分组处理,正常组加入含0.1% DMSO 的完全培养基,不同浓度给药组分别加入80、40、20、10 μg/mL含完全培养基药液培养24 h,每组6 个复孔。次日,每孔加入20 μL MTT 溶液,置于恒温箱中继续培养4 h,吸弃培养液,并加入150 μL/孔DMSO 溶解,水平振荡器摇动10 min后收集DMSO 溶液,测定490 nm 波长下的OD。
2.6 MTT 法测定H2O2对RAW264.7 巨噬细胞的细胞活力影响 取对数生长期的RAW264.7 巨噬细胞,按照4.0×104/孔的细胞浓度接种在96 孔板中,之后放置在5% CO2、37 ℃的恒温培养箱中培养24 h。第2 天弃去原培养基,进行分组处理,正常组加入含0.1% DMSO 的完全培养基,其余各组分别加入不同浓度的H2O2溶液,每组6 个复孔。次日,每孔加入20 μL 的MTT 溶液,置于恒温箱中继续培养4 h。4 h 后吸弃培养液,并加入150 μL/孔的DMSO 溶解,水平振荡器摇动10 min 后收集DMSO 溶液,测定490 nm 波长下的吸光度[4]。
2.7 Griess 法测定王不留行醇提物对RAW264.7 的NO 水平影响 取对数生长期的RAW264.7 巨噬细胞,按照4.0×104/孔的细胞浓度接种在96 孔板中,5% CO2、37 ℃的恒温培养箱中培养24 h 后弃去原培养基,进行分组处理,正常组和模型组加入含0.1% DMSO 的完全培养基,不同浓度给药组分别加入40、20、10 μg/mL 含完全培养基药液培养2 h,每组6 个复孔,2 h 后除了正常组,其余均加入500 ng/mL LPS 造模并继续培养24 h。次日,收集各孔培养基100 μL,并依照一氧化氮检测试剂盒说明,测定540 nm波长下OD,计算各组NO 水平。
2.8 王不留 行醇提物对TNF⁃α、IL⁃1β、IL⁃6 和iNOS mRNA 表达影响 取对数生长期的RAW264.7 巨噬细胞,按照4.0×104/孔的细胞浓度接种在96 孔板中,5% CO2、37 ℃的恒温培养箱中培养24 h 后弃去原培养基,进行分组处理,正常组和模型组加入含0.1% DMSO 的完全培养基,不同浓度给药组分别加入40、20、10 μg/mL 含完全培养基药液培养2 h,除了正常组其余各组均加入500 ng/mL LPS造模并继续培养24 h。按照Total RNA 提取试剂盒,反转录试剂盒以及荧光定量PCR 试剂盒说明书进行操作,测定各样品的TNF⁃α、IL⁃1β、IL⁃6、iNOSmRNA 表达。RT⁃PCR扩增反应采用CFX 96TM Real⁃Time PCR Detection System 扩增仪对cDNA 进行扩增,条件为95 ℃、10 min;95 ℃、15 s,40 个循环;60 ℃、60 s,40 个循环,引物序列如表1 所示。以β⁃actin为内参基因,计算相对表达量2-ΔΔCt:ΔCt(对照组)=Ct(对照组目的基因)-Ct(对照组β⁃actin),ΔCt(正常组)=Ct(正常组目的基因)-Ct(正常组β⁃actin),ΔΔCt=ΔCt(对照组)-ΔCt(正常组),相对表达量=2-ΔΔCt。

表1 目标基因引物序列
2.9 王不留 行醇提物对TNF⁃α、IL⁃1β、IL⁃6、PGE2、COX⁃2 表达影响 取对数生长期的RAW264.7 巨噬细胞,按4.0×104/孔接种在96 孔板中,5% CO2、37 ℃恒温培养箱中培养24 h 后弃去原培养基,进行分组处理,正常组和模型组加入含0.1%DMSO 的完全培养基,不同浓度给药组分别加入40、20、10 μg/mL 含完全培养基药液培养2 h,每组6 个复孔,2 h 后除了正常组,其余各组均加入500 ng/mL LPS 培养24 h。次日,收集各孔培养基,依照ELISA 试剂盒说明测定TNF⁃α、IL⁃1β、IL⁃6、PGE2、COX⁃2 水平。
2.10 王不留行醇提物对CAT、SOD、GSH⁃PX、MDA 水平的影响 取对数生长期的RAW264.7 巨噬细胞,按4.0×104/孔接种在96 孔板中,5% CO2、37 ℃恒温培养箱中培养24 h 后弃去原培养基,进行分组处理,正常组和模型组加入含0.1% DMSO 的完全培养基,不同浓度给药组分别加入40、20、10 μg/mL 含完全培养基药液培养24 h,每组6 个复孔,24 h 后除了正常组,其余各组均加入600 μmol/L H2O2培养4 h。4 h 后收集各孔培养基,依照试剂盒说明测定CAT、SOD、GSH⁃PX、MDA 水平。
2.11 统计学分析 分别采用Graphpad Prism 6、SPSS 23.0软件进行制图、统计学分析,数据以()表示。多组间比较采用单因素方差分析,两两比较满足方差齐性则用LSD 分析,不满足方差齐性则用Dunnett T3 分析。以P<0.05 为差异具有统计学意义。
3 结果
3.1 王不留行醇提物对RAW264.7 巨噬细胞的细胞活力影响 如图1 所示,10、20、40 μg/mL 王不留行醇提物对RAW264.7 细胞的细胞活力具有较好的维持作用,分别达到95.73%、96.89%、92.77%;80 μg/mL 王不留行醇提物给药组细胞活力为89.14%,但相比其余3 个较弱,因此本实验选择给药剂量为10、20、40 μg/mL。结果表明,10~80 μg/mL 王不留行醇提物对RAW264.7 细胞没有毒性。

图1 王不留行醇提物对RAW264.7细胞的细胞活力影响(n=6)
3.2 王不留行醇提物对RAW264.7 细胞TNF⁃α、IL⁃1β、IL⁃6 表达的影响 如图2 所示,与正常组比较,RAW264.7细胞受到LPS 刺激后,TNF⁃α、IL⁃1β、IL⁃6 蛋白和mRNA表达均提高(P<0.01);给予王不留行醇提物干预后,TNF⁃α、IL⁃1β、IL⁃6 蛋白和mRNA 表达下调(P<0.05,P<0.01),其中40 μg/mL 王不留行醇提物给药组下调效果最为突出,TNF⁃α mRNA 相对表达下降至42.46 倍,蛋白表达下降至505.00 pg/mL。
3.3 王不留行醇提物对RAW264.7 细胞iNOS 和COX⁃2 信号通路表达影响 如图3 所示,与正常组相比,模型组iNOSmRNA 表达及NO、COX⁃2、PGE2水平增 加(P<0.01);给予20、40 μg/mL 王不留行醇提物干预后,iNOSmRNA 表达和NO 分泌水平受到抑制(P<0.05,P<0.01),10、20、40 μg/mL 王不留行醇提物对RAW264.7 可抑制COX⁃2、PGE2表达(P<0.01)。

图3 王不留行醇提物对RAW264.7 细胞iNOS 和COX⁃2 表达的影响(n=6)
3.4 H2O2对RAW264.7 巨噬细胞的细胞活力影响 如图4所示,不同浓度H2O2对RAW264.7 细胞活力造成不同影响,且随着H2O2浓度增大,其对细胞的损伤越大。当H2O2浓度低于600 μmol/L 对细胞造成的损伤不显著,浓度超过600 μmol/L 则对细胞造成过度死亡。因此本次实验选择600 μmol/L H2O2作为诱导RAW264.7 细胞体外氧化损伤模型的浓度药物。

图4 不同浓度H2O2 对RAW264.7 细胞活力影响(n=6)
3.5 王不留行醇提物对RAW264.7 细胞CAT,SOD 和GSH⁃PX活性和MDA 水平影响 如图5 所示,H2O2刺激RAW264.7 巨噬细胞后,细胞CAT、SOD、GSH⁃PX 水平均下调,MDA 水平升高(P<0.01);给予王不留行醇提物干预后,细胞CAT、SOD、GSH⁃PX、MDA 水平降低(P<0.05,P<0.01),其中40 μg/mL王不留行醇提物给药组药效最好,CAT 水平由6.38 U/mL涨 至17.15 U/mL,SOD 水平由1.50 U/mL 涨 至17.15 U/mL,GSH⁃PX 水平由11.98 涨至44.52 U/L,MDA 水平由21.10 nmol/mL 降至12.00 nmol/mL。
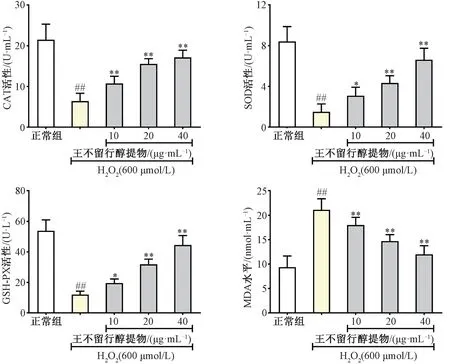
图5 王不留行醇提物对RAW264.7 巨噬细胞CAT、SOD、GSH⁃PX、MDA 水平的影响(n=6)
4 讨论
采用小鼠RAW264.7 巨噬细胞作为实验载体,探讨药物是否对细胞活性具有干扰作用。结果说明10~80 μg/mL王不留行醇提物对RAW264.7 细胞没有细胞毒性。接着采用LPS 诱导RAW264.7 巨噬细胞作为体外炎症模型,采用H2O2诱导RAW264.7 巨噬细胞作为体外氧化损伤模型,探讨王不留行醇提物抗炎抗氧化活性。
肿瘤坏死因子(TNF⁃α)是炎症级联反应中最重要的因子之一,能诱发白介素1β(IL⁃1β),白介素6(IL⁃6)等炎性因子的分泌并参与组织、器官以及机体的损伤等重要的炎症反应过程[5⁃6]。实验结果显示,给予王不留行醇提物干预后,TNF⁃α、IL⁃1β 及IL⁃6 mRNA 转录水平和蛋白表达显著下调,表明了王不留行具有抗炎活性。进一步探讨研究发现王不留行醇提物抗炎活性与其调控调控诱导型一氧化氮合成酶(iNOS)和环氧化酶2(COX⁃2)信号通路蛋白表达有关。iNOS 和COX⁃2 在体内分别诱导一氧化氮(NO)和前列腺素E2(PGE2)生成。过高含量NO 和PGE2引起氧化反应并损伤细胞,造成多种炎症疾病[7⁃8]。因此,调控iNOS 和COX⁃2 表达,抑制NO 和PGE2的过度生成,可以抑制炎性反应的进程[9⁃11]。本实验结果显示,给予王不留行醇提物干预后,iNOS mRNA 水平和COX⁃2 表达显著下降。实验结果表明王不留行醇提物能够调控iNOS 和COX⁃2 信号通路蛋白表达,抑制下游的TNF⁃α,IL⁃1β 及IL⁃6 mRNA 转录水平和蛋白表达,发挥抗炎活性。
过氧化氢酶(CAT),超氧化物歧化酶(SOD),谷胱甘肽过氧化物酶(GSH⁃PX)是机体内调控氧化应激的重要相关酶,对机体的氧化与抗氧化的平衡起着至关重要的作用[12⁃14]。丙二醛(MDA)为不饱和脂肪酸脂质过氧化产物,其在体内的堆积会造成细胞和组织损伤。本研究结果显示,在给予王不留行醇提物后,细胞中CAT,SOD 和GSH⁃PX 活性明显提高,同时MDA 含量显著降低,说明王不留行醇提物具有促进抗氧化酶活性,抑制脂质过氧化反应的药物活性。
综上所述,本研究证明了王不留行通过抑制iNOS 和COX⁃2 信号通路发挥抗炎活性,以及通过促进抗氧化酶活性,恢复体内氧化与抗氧化平衡,发挥抗氧化活性。

