成都平原豇豆根腐病菌的分离与鉴定
陈 玲,向 娟,张河庆, 席亚东,罗小波,付绍红
1. 成都市农林科学院,成都 611130; 2. 四川省农业科学院 植物保护研究所/蔬菜品种改良与种质创新四川省重点实验室,成都 610066
豇豆是深受人们喜爱的一种豆类蔬菜,鲜食与加工需求量大.近年来,随着豇豆种植集约化程度与复种指数增高,土传豇豆根腐病发生严重,成为制约豇豆产业发展的重要因素[1].据报道,引起豇豆根腐病的病原菌种类较多,如镰孢菌(Fusariumspp.)、腐霉菌(Phythiumsp.)、菜豆壳球孢菌(Macrophominaphaseolina)、立枯丝核菌(Rhizoctoniasolani)等[2-4],其中,镰孢菌是主要致病菌,在各种植区均有发生,已发现的豇豆根腐病镰孢菌包括茄腐镰孢菌(F.solani)、尖镰孢菌(F.oxysporum)、腐皮镰孢菌(F.solani)等11种镰孢菌[5-8].受镰孢菌侵染后,植株根茎部和主根变成红褐色,病部稍凹陷,有的开裂深达皮层内;剖视茎部,可见维管束变褐,病株侧根脱落或腐烂死亡;当主根全部腐烂时,病株即枯萎死亡[9].由于镰孢菌可在田间病残体、土壤表面或耕作层中越冬,且其种类复杂,寄主范围广,使得豇豆镰孢菌根腐病防治困难[10].虽然使用抗性品种是防治豇豆根腐病最理想的方法,但目前生产上可用的抗镰孢根腐病菌的豇豆品种仍十分缺乏.
豇豆作为四川成都平原的主要栽培蔬菜之一,主要用于鲜食和泡菜加工.近年来,成都平原豇豆规模化种植面积达到5万hm2,年总产量约70万t,均明显高于菜豆[1].但因当地凉爽、潮湿的气候特点,加之集约化、规模化种植,使得豇豆根腐病发生普遍,特别是成都平原的双流、彭州、金堂等地有些田块发病率达到100%[11].2018年,张河庆等[11]首次发现并报道了成都地区豇豆根腐病一种新病原菌——共享镰孢菌(Fusariumcommune),但关于成都平原豇豆根腐病的病原种类还未见报道.本研究对成都平原豇豆主产区的根腐病株进行收集,通过对病原菌的分离纯化,采用形态学与分子生物学方面进行鉴定,旨在明确引起该地区豇豆根腐病的主要致病菌类群,为生产上有针对性地防治该病以及抗病育种提供一定的科学依据.
1 材料与方法
1.1 病害调查与病株采集
2016-2019年课题组对成都平原豇豆主产区开展了调查,在发病严重的彭州、崇州、双流、眉山、乐山、金堂等6个采样点采集了田间病害样本.
1.2 病原菌的分离与鉴定
1.2.1 病原菌分离与致病性测定
参照方中达[12]《植病研究方法》中的方法进行病原菌的分离与鉴定.选取新发病豇豆植株茎基部的根茎进行常规组织分离,经纯化培养后进行单孢分离,获得单孢菌株,并置于4 ℃马铃薯葡萄糖琼脂(PDA)斜面培养基上保存.采用柯赫氏法则(Koch’s Rules)对分离得到的菌株进行致病性测定.将分离到的菌株培养5 d,制成孢子悬浮液(106~107个孢子/mL),于豇豆幼苗两叶一心期采用浸根法接种,使根部完全浸泡在孢子悬浮液中30 min,以清水为对照,每个菌株接种10株幼苗,试验重复3次.接种后将植株定植于装有无菌泥炭土的营养杯中,于25 ℃气候箱中培养,12 h光照,8 h暗培养,每隔1~2 d观察1次.待发病后,从病斑处再次分离病原菌,通过形态及分子鉴定,确认再分离物和接种物的一致性.
1.2.2 病原鉴定
形态学鉴定: 将供试的致病菌株接种到PDA培养基上,25 ℃恒温黑暗培养,7 d后观察培养基上的菌落形态及色素产生情况.参照Skovgaard等[13]的报道,进行病原菌种的形态学鉴定.
分子鉴定: 采用改良的CTAB法提取基因组DNA[13],以核糖体内转录区域间隔区(rDNA-ITS)的通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[14]进行PCR扩增,1%琼脂糖凝胶电泳检测其PCR产物,并委托上海生物工程技术服务有限公司进行测序;将所得ITS序列在GenBank数据库中比对,获得相似度较高且已报道的病原菌序列;运用软件MEGA 6.0,采用最大似然法(Maximum likeihood)构建系统发育树,以确定各病原菌的分类地位.
2 结果与分析
2.1 病原菌的分离和培养
调查发现田间豇豆根腐病发病症状为: 受害根茎部和主根红褐色,病部稍凹陷,侧根脱落或腐烂死亡(图1).根据发病症状采集病样进行组织分离,分离物经纯化并单孢分离后共获得122株单孢菌株.通过观察菌株在PDA培养基上的培养特征,发现分离菌株的气生菌丝均较茂盛,菌丝初为白色,随菌龄增长,不同菌株菌落产生颜色不同,根据色素产生情况,大致将病原菌分为12类(表1).所有菌株在PDA培养基上均不易产生大孢子,小孢子卵圆形至短杆形,有些菌株容易产生厚垣孢子(图2),这些特征与镰孢属真菌的形态特征相符.因此,初步认定这些病原菌均属于镰孢属(Fusarium).

图1 豇豆根腐病田间症状
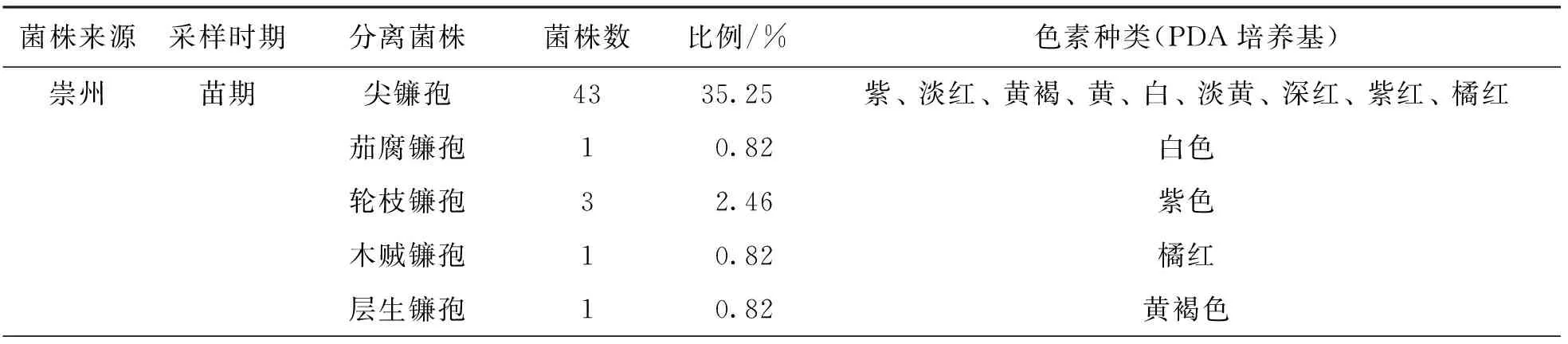
表1 成都平原鉴定出的122株豇豆根腐病病原菌信息

续表1
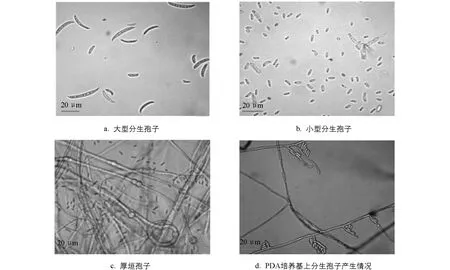
图2 豇豆根腐病病原菌的形态学特征
2.2 致病性测定
孢子悬浮液接种在健康豇豆植株上15 d后,观察植株发病情况.结果看出,部分植株萎蔫、落叶、倒伏,根部开始出现褐色病变,根系坏死腐烂,且维管束呈红褐色并可延及根茎部,而对照植株不发病.依据柯赫氏法则,从病斑处再次分离菌株经ITS序列分析和病原形态显微镜镜检发现,病原菌均与原菌株一致(图3).

图3 病原菌回接豇豆后的典型症状
再次从回接发病植株上分离的4种镰孢菌形态特征如下: 尖镰孢菌小型分生孢子,量大,卵圆形或肾形,5.2~10.2 μm×2.4~3.6 μm;大型分生孢子镰刀型,1~7隔膜,多数3隔膜,12.1~59 μm×2.5~5.1 μm(图4a).茄腐镰孢菌小型分生孢子,卵形或肾形,8.6~15.5 μm×2.4~3.9 μm;大型分生孢子镰刀型,孢子形态较短胖,2~8隔膜,多数3隔膜,18.2~45.3 μm×3.2~6.3 μm(图4b).轮枝镰孢菌小型分生孢子串生,2.5~4.2 μm×2.0~2.8 μm;大型分生孢子镰刀型,2~3隔膜,22.5~41.3 μm×2.6~5.5 μm(图4c).层生镰孢菌小型分生孢子卵形或短棒形,5.2~10.3 μm×2.3~3.5 μm;大型分生孢子舟型,长而直,两端略弯,20.5~43.5 μm×3.6~4.9 μm(图4d).木贼镰孢菌未在PDA培养基上观察到小型分生孢子.

图4 豇豆病根部再分离物形态特征
2.3 病原菌的分子生物学鉴定
对122株分离物进行分子鉴定,分别将株菌PCR产物进行1%琼脂糖凝胶电泳,获得约520 bp的扩增条带(图5).将测序所得序列与NCBI中相关序列进行比对,并结合MEGA软件进行聚类分析.最后根据形态学和分子生物学特征将122株病原菌分为5种,即茄腐镰孢、尖镰孢、轮枝镰孢、层生镰孢、木贼镰孢菌(图6).
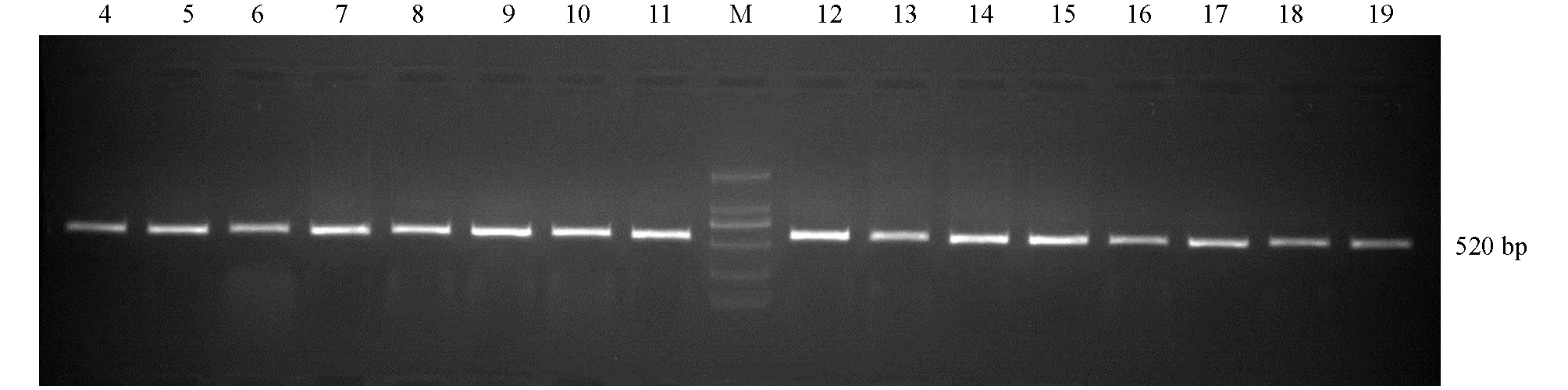
M: DL2000;4: CY28441;5: CY22813;6: CY2812;7: CY23522;8: CY1.12;9: CY2.51;10: CY22821;11: CY22912;12: CY28443;13: JG2-2.11;14: JG2-3.12;15: JG1-3.31;16: JG2-3.23;17: JG2-4.21;18: LJ2.13;19: LD13.图5 菌株PCR产物的1%琼脂糖凝胶电泳
其中尖镰孢共有99个分离物,分离频率最高,为81.1%,其他病原菌的分离频率均小于11%(表2);5类菌株在崇州地区均有出现,且分离的菌株数量最多,双流分离病原菌只有1种,为尖镰孢.来自豇豆成株期的17株病原菌均为尖镰孢,而分离纯化自豇豆苗期的105株菌株隶属于5种不同的镰孢菌,这表明引起成都平原豇豆根腐病的病原菌主要为镰孢菌,且多为尖镰孢,在6个主产区均有分布,并导致植株在苗期和成株期发病.

表2 成都平原豇豆根腐病原菌属种分布
3 结论与讨论
根腐病在四川省豇豆产区扩展很快,严重制约了豇豆生产和绿色发展.本研究针对成都平原豇豆根腐病发生严重、病原不清的问题,通过采集该地区主要种植地的根腐病病样,基于形态学和分子鉴定,明确了引起该地区豇豆根腐病的病原菌为镰孢菌,包括茄腐镰孢、尖镰孢、轮枝镰孢、层生镰孢、木贼镰刀菌等5类镰孢菌,其中以尖镰孢为优势致病菌.
目前,国内外已报道可引起豇豆根腐病的镰孢菌有11 种(https: //nt.ars-grin.gov/fungaldatabases/),如茄腐镰孢、尖镰孢、轮枝镰孢等[8].但豇豆根腐病的致病菌类群及病害发生与栽培方式、品种抗性、土壤菌源量等均有关系.杨玉洁等[15]通过鉴定得出江苏省如皋市豇豆根腐病原菌主要有茄腐镰孢、尖孢镰孢和立枯丝核菌.吴仁峰等[16]鉴定出湖北武汉地区的豇豆根腐病原菌为茄腐镰孢.李秋洁等[17]从海南省三亚市豇豆主要种植区的19份根腐病病样中分离到的23株菌株,其中以茄腐镰孢菌和尖孢镰孢菌为主.本研究鉴定发现,成都平原豇豆根腐病病原菌主要为茄腐镰孢、尖镰孢、轮枝镰孢、层生镰孢、木贼镰刀菌等5类镰孢菌,其中尖孢镰孢在豇豆各主产区出现的频率最高(81.1%)、分布最广,为豇豆根腐病的主要病原,其次为茄腐镰孢菌和轮枝镰孢菌,研究结果与上述报道地区有所不同.这可能与成都平原特殊的气候条件和栽培品种有关.成都平原属亚热带季风性湿润气候,夏季高温多雨,土壤质地以黑壤土、黄黏土为主,长年连作、化肥过施等因素造成土壤板结、质量下降,为多种植物根腐病的流行性发生提供了环境条件[11,18];同时,规模化连续种植导致致病镰孢菌的厚垣孢子能够在土壤及病残体中长期积累存活,增加土壤菌源量,从而加重病情.此外,因成都平原种植的豇豆多为绿荚、肉厚、细长品种,尤其以适宜泡渍加工特性的品种为主,这些品种缺乏对根腐病的抗性.
本研究主要针对成都平原发病较为严重的豇豆主产区的豇豆根腐病菌进行分离和鉴定,在地理分布和区域方面具有一定的代表性,结果表明崇州地区发现的根腐病病原菌种类、数量最多.闫文雪等[8]对采自山东省和甘肃省的16份豇豆标样进行分离获得16个病原,经鉴定均为茄腐镰孢菌,吴仁锋等[16]报道的豇豆根腐病种类也为茄腐镰孢菌(F.solani).上述两篇文章并未明确标样来源为成株期还是苗期,本研究所采的豇豆成株期根腐病病原菌株的17株均为尖镰孢菌,而苗期根腐病包含上述5种不同的镰孢菌,表明成株期的根腐病原种类和苗期的根腐病原种群具有一定的差异性.以尖镰孢菌为主造成其他作物发生根腐病的也有报道,如四川省的大豆根腐病[18],甘肃省的百合根腐病[19],黑龙江省的大豆根腐病[20-21],以及山西省植物病原镰孢菌以尖镰孢为优势种[22],而成都平原地区还未有此病原菌侵染豇豆的报道.
在本研究中,疑似病原菌的鉴定采用了形态特征结合rDNA-ITS序列分析的分子方法,弥补了形态特征无法有效鉴定镰孢菌属内种的缺陷.但也有人发现,镰孢菌各种的rDNA-ITS序列相对保守,差异变异区域较少,无法准确区分镰孢菌各种及复合种[23-25],因此,未来对于镰孢菌种,特别是复合种的鉴定工作需要补充其他的核酸序列,如翻译延伸因子基因EF1-α和RNA聚合酶Ⅱ基因RPB2[26].同时,前人研究发现镰孢菌属多种镰孢菌都能产生色素,且色素颜色多变,甚至同种镰孢菌能产生多种色素[27-30],如Menezes等[27]报道茄腐镰孢菌BRM054066菌株能够产生红色素,Zheng等[28]报道暗培养下茄腐镰孢菌产生橄榄绿色素.鉴于此,本研究以镰孢菌产生的色素颜色作为培养的主要指标,结果发现,茄腐镰孢菌产生淡黄色色素,尖镰孢菌观察到的色素达12种,表明色素不能作为镰孢菌分类的依据.
综上,本文研究厘清了造成成都地区豇豆根腐病的病原,特别是崇州地区的豇豆根腐病原种类的多样性,为豇豆的抗根腐病提供了依据.为了更好地防治豇豆根腐病,应该针对不同地区不同病原菌种群制定科学的防治策略,合理选用抗病品种,提高田间管理水平,尽可能采用生物防治方法实现对豇豆根腐病的综合防治.

