miR-598靶向FGFR2对乳腺癌细胞增殖、凋亡及糖代谢的调控作用①
张 方 张淑艳 高雅琪 孙培胜 刘玉林 (鹤壁职业技术学院,鹤壁458030)
乳腺癌是导致全球女性癌症死亡的主要原因之一,2018 年全球有2 088 849 例新发乳腺癌病例,占女性死亡人数的15.0%[1-2]。目前,乳腺癌已被认为是一种异质性疾病,根据雌激素受体、孕激素受体和人表皮生长因子受体2 的状态,可分为不同的病理亚型[3]。对于晚期乳腺癌患者,当肿瘤切除不可行时,可考虑全身化疗[4]。然而,不幸的是全身化疗大多是无效的,因为化疗的耐药性。顺铂是一种广泛应用于晚期乳腺癌治疗的化疗药物[5]。然而,高剂量的顺铂会导致严重的副作用,也会杀死正常细胞,尤其是那些频繁再生的细胞。更严重的是顺铂的长期副作用,也是致癌的,可以导致继发性癌症[6]。因此,探寻具有潜在治疗效果的新疗法是必要的。
microRNA(miRNA)是一个大的基因表达转录后调节家族,其长度约为21 个核苷酸,参与真核生物的发育和细胞过程[7]。过去十年的研究已经确定了参与miRNA生物发生的主要因素,并确立了miRNA功能的基本原理。miRNA 的代谢和功能通过一系列机制的调节,这些机制涉及大量的蛋白-蛋白和蛋白-RNA 的相互作用[8]。这种调控在 miRNA 的环境特异性功能中起着重要作用[9]。miRNA与包括癌症在内的许多疾病有关[10]。miR-598 在某些肿瘤中发挥相应功能。有报道称miR-598 通过靶向IGF-1R在人胃癌中发挥抑癌作用[11]。YANG等[12]揭示miR-598 通过负调控Derlin-1 和上皮-间质转化(EMT)抑制非小细胞肺癌(NSCLC)的侵袭和迁移。CHEN等[13]的研究表明 miR-598 通过抑制 JAG1/Notch2 通路刺激EMT 来抑制结直肠癌的转移。还有报道发现miR-598 的表达通过靶向URI 抑制卵巢癌细胞的增殖和转移[14]。然而,miR-598 在乳腺中的作用鲜有报道。
FGFR2 是受体酪氨酸激酶亚家族的成员,该家族还包括 FGFR1、FGFR3 和 FGFR4[15]。越来越多的证据表明,FGF-FGFR2 信号通路在乳腺癌中发挥重要作用。FGFR2 在乳腺癌组织中的基因扩增和过表达也被描述,特别是在三阴性乳腺癌中[16]。因此,使用人类细胞模型的FGFR2 过表达和抑制剂研究支持FGFR2在乳腺癌中的促肿瘤形成功能[17]。
本研究考察miR-598与FGFR2在乳腺癌MCF-7细胞中的关系,并探讨miR-598 对乳腺癌细胞糖代谢和细胞增殖的影响。
1 材料与方法
1.1 材料
1.1.1 标本获取 选取2018年7月至2019年12月在新乡医学院第一附属医院行乳腺癌切除术的患者21 例,入组患者术前均未接受放疗或者化疗,平均年龄(54.8±6.7)岁。非浸润性癌5 例,浸润性癌16 例。组织标本包括患者原发性乳腺癌组织和癌旁组织(距离病灶>5 cm,并有病理证实无肿瘤细胞浸润),切取后迅速冷冻在液氮中,随后转移至-80℃冰箱中保存。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
1.1.2 主要试剂和仪器 乳酸检测试剂盒购自上海酶联生物科技有限公司;葡萄糖检测试剂盒购自上海金畔生物科技有限公司;人乳腺癌细胞株MCF-7、MDA-MB-231、HCC1937 和人正常乳腺细胞Hs 578Bst 均购自 Procell 公司;RPMI1640 培养基、DMEM 培养液、青霉素、链霉素购自美国Gibco 公司;miR-598 mimic 购自上海生工;pmirGLO 载体、双荧光素酶报告基因检测试剂盒购自美国Promega 公司;FGFR2 质粒购自 RiboBio 公司;Lipofectamine®2000、Superscript RNase H-逆转录酶、抗体 Bcl-2(1 μg/ml)购自美国 Invitrogen 公司;RNA purifica⁃tion system 购自德国 Qiagen 公司;DNase-Ⅰ购自瑞士罗氏公司;随机六聚体购自美国Sigma-Aldrich 公司;SYBR Green Master Mix 购自美国Thermo Fisher公司;JC-1 试剂盒、10% SDS-PAGE、PVDF 膜、ECL化学发光检测试剂盒、羊抗兔IgG-HRP 购自北京索莱宝科技有限公司;抗体Bax(1∶1 000)、Caspase-3(1∶1 000)、Caspase-9(1∶1 000)、FGFR2(1∶1 000)、Actin(1∶1 000)购自美国 CST 公司;ABI Prism 7000系统购自美国Applied Biosystems公司。
1.2 方法
1.2.1 细胞培养 人乳腺癌细胞株MCF-7、MDAMB-231、HCC1937和人正常乳腺细胞Hs 578Bst常规培养于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养基,置于37℃、5%CO2饱和湿度培养箱中,取对数生长期的细胞进行实验。
1.2.2 qRT-PCR 总RNA用RNA purification system提取。用DNase-Ⅰ去除基因组DNA。用Superscript RNase H-逆转录酶和随机六聚体从5 mg 总RNA 中制备cDNA。用SYBR Premix Ex Taq RT-PCR 试剂盒和miRNA 引物进行qRT-PCR 反应。检测基因的引物序列如下:miR-598 正向引物5'-AGCTACGT⁃CATCGTTGTCATC-3',反 向 引 物 5'-GTGTCGTC⁃GAGTCGGCAATTC-3';FGFR2 正向引物 5'-CGCTG⁃GTGAGGATAACAACACG-3',反向引物 5'-TGGAAGTTCATACTCGGAGACCC-3';β-actin 正向引物 5'-AGTGTGACGTGGACATCCGCAAAG-3',反 向 引 物5'-ATCCACATCTGCTGGAAGGTGGAC-3'。每个基因均生成标准曲线,扩增效率为90%~100%。通过阈值比较,确定基因表达的相对定量。所有结果均以β-actin为基准进行归一化。
1.2.3 荧光素报告基因实验 通过TargetScan 软件在线预测miR-598 与FGFR2 的靶向关系。将FG⁃FR2 的3'UTR 片段(wt 和mut)构建到荧光素酶报告载体(pmirGLO):Luc-FGFR2 3'UTR wt、Luc-FGFR2 3'UTR mut。然后 miR-NC 或 miR-598 mimic 与 pmir⁃GLO(wt 和 mut)共转染 MCF-7 细胞。荧光素酶活性由双荧光素酶报告基因检测试剂盒测定。
1.2.4 细胞转染及分组 乳腺癌细胞系MCF-7 在含有5%胎牛血清、50 μg/ml 链霉素的DMEM 培养液中培养,置于37℃、5%CO2环境中。48 h 后按照Lipofectamine®2000 操作说明,将 miR-598 mimic 和pcDNA-FGFR2 及其对应的对照(miR-NC、pcDNA)转染进入MCF-7 细胞。细胞分为4 组:对照组(Con⁃trol)、miR-598 mimic 组、pcDNA-FGFR2 组和 mimic+FGFR2组。
1.2.5 葡萄糖摄取量检测 4 组细胞培养24 h 后,收集培养液上清,按照葡萄糖检测试剂盒使用说明进行操作。根据普通糖标准品绘制的标准曲线,计算出各组培养液上清中葡萄糖含量,各组细胞的葡萄糖摄取量=空白对照组葡萄糖含量-各组培养液中葡萄糖含量。
1.2.6 乳酸生成量检测 4 组细胞培养24 h 后,收集培养液上清,按照乳酸检测试剂盒使用说明进行操作。用酶标仪在530 nm 波长处测定样品吸光度。乳酸生成量计算:乳酸生成量(mmol/L)=3×(OD样品-OD空白对照)/(OD标准品-OD空白对照)。
1.2.7 克隆形成实验 将不同组的MCF-7 细胞接种于6孔板中,250个/孔细胞,每3~4 d换液,10~14 d后结晶紫染色。每个孔用PBS 仔细洗2 次,将菌落在1 ml 甲醇中固定20 min,然后1 ml 结晶紫染色20 min,细流水冲洗干净。统计≥50个细胞的克隆数,计算克隆形成效率,克隆百分比(%)=克隆形成数/接种细胞数×100%。
1.2.8 流式细胞术 4组MCF-7细胞(1×106个/ml)胰蛋白酶化后在1 ml 培养液中重悬,用10 μg/ml JC-1 在 37℃、5%CO2条件下孵育 30 min。经 JC-1 染色后,用流式细胞术分析红色和绿色发射荧光。
1.2.9 Western blot 用10%SDS-PAGE 分离细胞和肿瘤中的蛋白,并转移到PVDF 膜上。5%脱脂牛奶阻断后,蛋白质与第一抗体在4℃条件下孵育过夜。主要抗体如下:Bax、Bcl-2、Caspase-3、Caspase-9、FGFR2和Actin。PBS洗涤,羊抗兔IgG-HRP孵育1 h。用ECL化学发光检测试剂盒观察条带。
2 结果
2.1 miR-598 在乳腺癌组织及细胞系中的表达 通过qRT-PCR 检测乳腺癌组织及不同乳腺癌细胞系中miR-598 的表达。如图1A 所示,与癌旁组织比较,乳腺癌组织中miR-598 的表达显著下调(P<0.05)。如图1B所示,与人正常乳腺细胞比较,乳腺癌细胞系 MCF-7、MDA-MB-231 及 HCC1937 中 miR-598的表达也显著下调(P<0.05)。

图1 miR-598在乳腺癌组织及细胞系中的表达水平Fig.1 Relative expressions of miR-598 in breast tissues and cell lines
2.2 miR-598 靶向 FGFR2 基因 如图 2A 所示,生物信息学软件预测miR-598靶向FGFR2 3'UTR存在多个碱基结合位点,位置为552~558,FGFR2 可能是miR-598 的靶基因。为了揭示 miR-598 与 FGFR2 的相互作用,用 miR-598 mimic 与 pcDNA-FGFR2 单独或联合转染至乳腺癌MCF-7 细胞,构建过表达体系,qRT-PCR 检测转染效率。如图 2B、C 所示,miR-598和FGFR2 mRNA 相对表达水平较之各自对照组均显著上调(P<0.05),表明过表达体系构建成功。如图2D 所示,与对照组比较,miR-598 mimic 组的miR-598 相对表达水平显著上调(P<0.05),pcDNA-FGFR2 组显著下调(P<0.05);与 pcDNA-FGFR2 组比较,mimic+FGFR2 组的miR-598 相对表达水平显著上调(P<0.05)。如图2E 所示,与对照组比较,miR-598 mimic 组的FGFR2 mRNA 相对表达水平显著下调(P<0.05),pcDNA-FGFR2 组显著下调(P<0.05);与 pcDNA-FGFR2 组比较,mimic+FGFR2 组的FGFR2 mRNA 相对表达水平显著下调(P<0.05)。上述结果表明,miR-598 与 FGFR2 在 MCF-7 细胞中呈负相关表达。双荧光素酶报告基因实验进一步验证了miR-598 和FGFR2 的靶向关系。如图2F 所示,在 Luc-FGFR2 3'UTR wt 中,与 miR-NC 组比较,miR-598 组的相对荧光素酶活性显著降低(P<0.05);而在 Luc-FGFR2 3'UTR mut 中,与 miR-NC 组比,miR-598 组的相对荧光素酶活性无显著变化。由此证实miR-598靶向FGFR2基因。

图2 miR-598与FGFR2基因的靶向关系Fig.2 Targeting relationship between miR-598 and FG⁃FR2 gene
2.3 miR-598 对乳腺癌细胞增殖的影响 克隆形成实验检测MCF-7细胞的生长情况。如图3A所示,与对照组比,miR-598 mimic组的克隆形成率显著降低(P<0.05),而 pcDNA-FGFR2 组显著升高(P<0.05);与 pcDNA-FGFR2 组比,mimic+FGFR2 组的克隆形成率显著降低(P<0.05)。蛋白印迹实验检测增殖相关蛋白表达,如图3B 所示,与对照组比,miR-598 mimic 组的 Ki67 和 PCNA 蛋白表达显著下调(P<0.05),而 pcDNA-FGFR2 组显著上调(P<0.05);与 pcDNA-FGFR2 组比,mimic+FGFR2 组的Ki67 和 PCNA 蛋白表达显著下调(P<0.05)。由此可见,miR-598 可通过靶向 FGFR2 抑制 MCF-7 细胞增殖。

图3 miR-598通过靶向FGFR2对MCF-7细胞增殖的影响Fig.3 Effects of miR-598 by targeting FGFR2 on prolifer⁃ation of MCF-7 cells
2.4 miR-598 对乳腺癌细胞线粒体膜电位及凋亡的影响 流式细胞术检测MCF-7 细胞线粒体膜电位变化及细胞凋亡。如图4A 所示,与对照组比较,miR-598 mimic 组的红绿荧光比例明显下降,而pcDNA-FGFR2 组的红绿荧光比例无显著差异;与pcDNA-FGFR2组比,mimic+FGFR2组的红绿荧光比例明显降低。如图4B 所示,与对照组比较,miR-598 mimic 组的细胞凋亡率显著升高(P<0.05),而pcDNA-FGFR2组的细胞凋亡率显著降低(P<0.05);与 pcDNA-FGFR2 组比,mimic+FGFR2 组的细胞凋亡率显著升高(P<0.05)。蛋白印迹实验检测线粒体凋亡途径相关蛋白Bax/Bcl-2 及外源性凋亡途径相关蛋白Caspase-3和Caspase-9,如图4C所示,与对照组比较,miR-598 mimic 组的 Bax/Bcl-2、cleaved cas3/cas3 和cleaved cas9/cas9 表达比例显著升高(P<0.05),而pcDNA-FGFR2 组显著降低(P<0.05);与 pcDNA-FGFR2 组比较,mimic+FGFR2 组的 Bax/Bcl-2、cleaved cas3/cas3 和 cleaved cas9/cas9 表达比例显著回升(P<0.05)。由此表明,miR-598 可通过靶向FGFR2 导致MCF-7 细胞线粒体膜去极化,促进细胞凋亡。
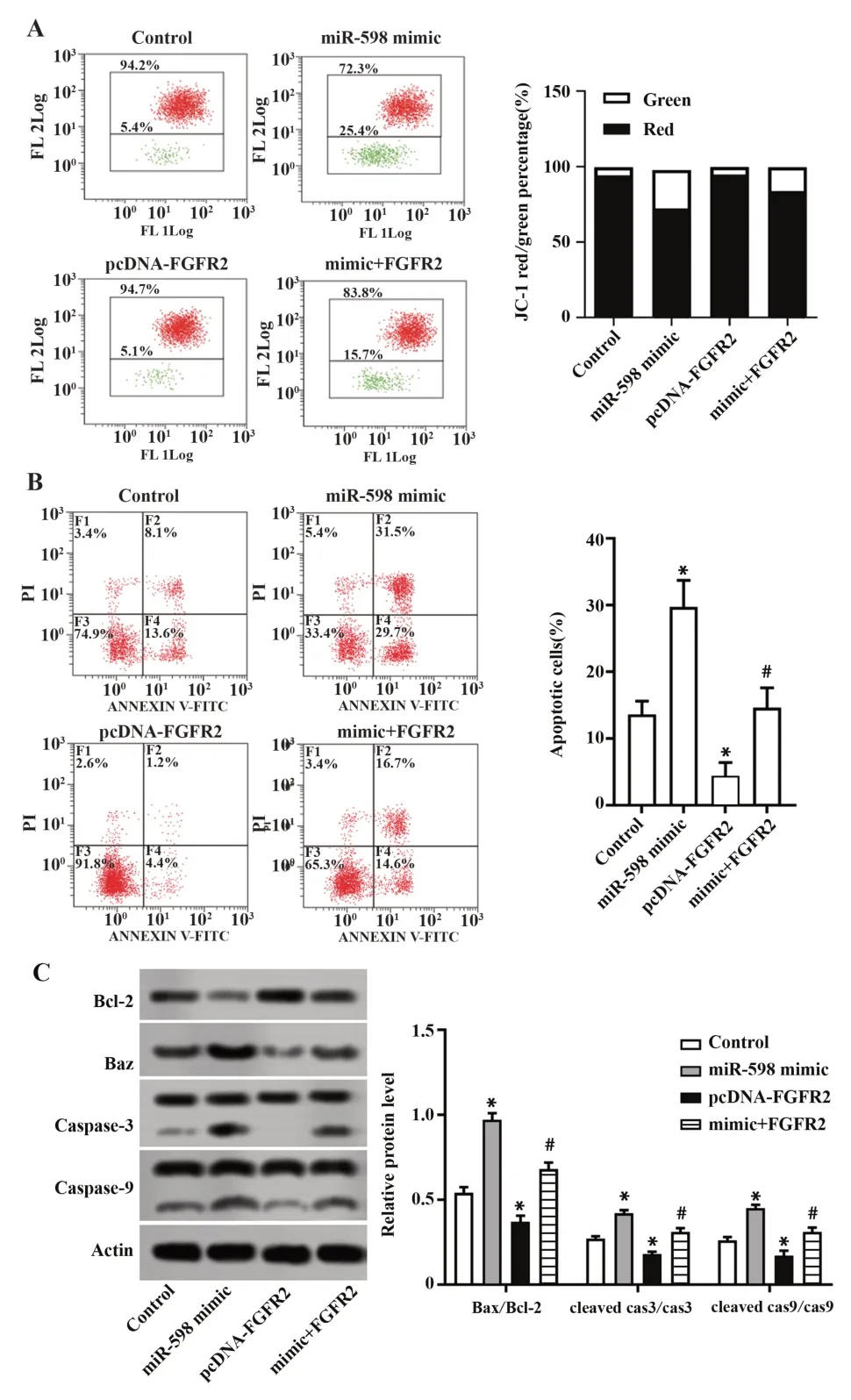
图4 miR-598 通过靶向FGFR2 对MCF-7 细胞线粒体膜电位及凋亡的影响Fig.4 Effects of miR-598 on mitochondrial membrane po⁃tential and apoptosis of MCF-7 cells by targeting FGFR2
2.5 miR-598 对MCF-7 细胞的葡萄糖摄取量和乳酸生成量的影响 试剂盒检测MCF-7 细胞的葡萄糖摄取量和乳酸生成量。如图5A、B 所示,与对照组比较,miR-598 mimic组的葡萄糖摄取量和乳酸生成量显著降低(P<0.05),而pcDNA-FGFR2 组的葡萄糖摄取量和乳酸生成量显著升高(P<0.05);与pcDNA-FGFR2组比较,mimic+FGFR2组的葡萄糖摄取量和乳酸生成量显著回降(P<0.05)。由此表明,miR-598 可通过靶向FGFR2 抑制MCF-7 细胞的糖代谢。
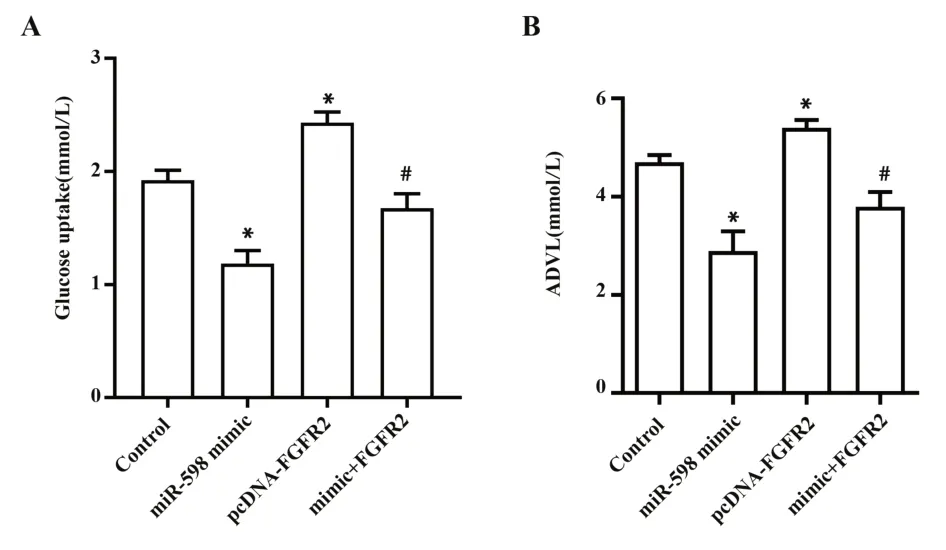
图5 miR-598通过靶向FGFR2对MCF-7细胞糖代谢的影响Fig.5 Effects of miR-598 on glucose metabolism in MCF-7 cells by targeting FGFR2
3 讨论
近十多年来,对miRNA 在疾病发展中的作用,特别是在癌症中的作用研究,使miRNA 成为新治疗方法的有力工具和靶点[18]。功能研究证实,miRNA失调在许多癌症病例中具有因果关系,miRNA 可作为肿瘤抑制因子或致癌基因(oncomiRs),而针对miRNA的模拟物和靶向miRNA的分子(anti-miRs)已在临床前开发中显示出希望[19]。正如前面提及的miR-598 在胃癌、NSCLC 和结直肠癌中异常表达,上调miR-598有抑制肿瘤的作用。而FGFR2被证实与乳腺癌风险高度相关。本研究发现miR-598在乳腺癌组织及乳腺癌细胞系中均下调表达。在MCF-7细胞中miR-598与FGFR2的表达呈负相关。进一步证实FGFR2为miR-598的靶基因。
已有报道显示,成纤维细胞生长因子受体2(FGFR2)导致酪氨酸激酶结构域通过与成纤维细胞生长因子(FGFs)结合及二聚体化启动细胞内信号的级联反应,后者参与了肿瘤的发生和发展[20]。HUANG 等[21]报道,FGFR2 通过 PI3K-Akt-Mtor 途径抑制血小板反应蛋白4的表达,促进细胞增殖,从而促进胃癌进展。CHANG 等[22]研究揭示 FGF9/FG⁃FR2 通过激活小鼠间质瘤细胞中的ERK1/2、Rb/E2F1 和细胞周期通路来增加细胞增殖。YANG等[23]结果表明,miR-381 通过直接靶向 FGFR2 抑制口腔鳞状细胞癌细胞的增殖。在本研究中,FGFR2同样促进乳腺癌细胞增殖,阻碍线粒体膜电位去极化,抑制凋亡。而miR-598 逆转了FGFR2 的效应。miR-598 过表达能抑制细胞增殖,促进线粒体膜电位去极化,从而导致细胞凋亡。肿瘤细胞将葡萄糖作为获取ATP 的主要来源,进行能量代谢,其中糖酵解为其主要方式。由于肿瘤增殖迅速,其长期处于缺氧环境下,而糖酵解可在缺氧条件下正常进行。糖代谢异常是肿瘤细胞的一个重要特性[24]。在本研究中,miR-598抑制FGFR2表达,进而减少葡萄糖摄入量和乳酸生成量。
综上所述,miR-598通过靶向FGFR2基因,阻碍其表达,从而抑制乳腺癌细胞增殖和糖代谢,并且促进细胞凋亡。

