CADM2抑制宫颈癌细胞增殖和转移的作用机制研究①
李婷娜 韩一栩 韦秋圆 王晓暖 周小飞 (海口市妇幼保健院妇产科,海口570311)
宫颈癌是女性生殖道最常见的恶性肿瘤之一,在女性恶性肿瘤中的发病率和死亡率排名第四,在全世界生殖道恶性肿瘤中排名第一[1]。尽管医疗技术在不断地进步,宫颈癌治疗手段取得了一定的疗效,但是宫颈癌患者的长期生存率仍然较差,并且放化疗存在严重的副作用[2]。分子靶向治疗是治疗宫颈癌最有前景的新型治疗方法,其治疗关键是寻找分子靶点[3]。研究报道在宫颈癌发生过程中存在某些癌基因和抑癌基因的异常表达,在宫颈癌的恶性进展中发挥重要作用,具有成为抗肿瘤治疗靶标的潜力[4]。免疫球蛋白超家族成员细胞黏附分子2(cell adhesion molecule 2,CADM2)在体内能量稳态的维持过程中发挥重要作用[5]。最近的研究表明CADM2 可以作为肿瘤抑制因子,在神经胶质瘤、肾透明细胞癌和食管鳞状细胞癌等多种肿瘤组织中低表达或者表达缺乏,抑制肿瘤的增殖、侵袭和转移等多种恶性生物学行为,可能是抗肿瘤治疗的潜在分子靶点[6-8]。但是CADM2 在宫颈癌中发挥的功能及作用机制鲜有报道。本文旨在研究CADM2 的异常表达在宫颈癌发生发展过程中的重要作用,为CADM2 作为宫颈癌治疗潜在分子靶标提供理论依据。
1 材料与方法
1.1 材料 Trizol 试剂购自美国Invitrogen 公司;RNA 提取试剂盒、SYBR Green Mastermix 试剂盒和蛋白裂解液购自北京索莱宝公司;RevertAid First Strand cDNA Synthesis Kit 逆转录购自美国Thermo公司;CADM2 和GAPDH 引物由上海捷瑞生物工程有限公司合成;宫颈癌细胞HeLa、SiHa、C33A 和正常宫颈上皮鳞状细胞H8 购自上海中国科学院;FBS和胰酶购自美国Hyclone 公司;细胞培养基购自北京清大天一生物技术有限公司;过表达CADM2 慢病毒购自上海吉凯基因有限公司;CCK8 试剂购自美国GlpBio 公司;细胞周期检测试剂盒和BCA 检测试剂盒购自上海碧云天试剂有限公司;Transwell 小室购自美国corning公司;PVDF膜购自迈博瑞生物膜技术有限公司;兔多克隆CADM2(ab64873)、兔多克隆cyclin D1(ab16663)、兔多克隆CDK4(ab108357)和MMP2(ab92536)抗体购自英国Abcam 公司;ECL化学发光试剂盒购自上海慧颖生物科技有限公司。
1.2 方法
1.2.1 细胞培养 宫颈癌细胞HeLa、SiHa、C33A和正常宫颈上皮鳞状细胞H8 立即复苏后重悬至FBS 浓度为10%的细胞培养基中,放置在37℃、5%CO2的全湿度培养箱中生长。细胞培养基颜色变化时,弃掉培养基,PBS 洗涤1 次,进行细胞换液。细胞长满时,弃掉培养基,PBS 洗涤1 次,胰酶消化进行细胞传代。
1.2.2 qRT-PCR 宫颈癌细胞经PBS 洗涤1 次,之后将PBS 吸除,加入Trizol 试剂裂解细胞,采用RNA提取试剂盒提取细胞裂解液中的细胞总RNA。采用RevertAid First Strand cDNA Synthesis Kit 逆转录试剂盒将RNA 逆转录为cDNA。并以cDNA 为模板,加入CADM2上下游引物,采用SYBR Green Mas⁃termix 试剂盒获得检测样品的循环阈值(cycle threshold,Ct),按照 2-ΔΔCt公式以 GAPDH 为内参计算CADM2 mRNA 的相对表达量。CADM2 引物序列F:5′-AAACTTCCAAGGCATATCTCACC-3′,R:5′-TGCGATTTGCATCCTCTTCTT-3′。GAPDH引物序列F:5′-CTGGGCTACACTGAGCACC-3′,R:5′-AAGTGGTCGTTGAGGGCAATG-3′。
1.2.3 细胞感染 宫颈癌细胞呈对数生长时,采用胰酶收集细胞,血球计数板进行计数。以1×105个/孔细胞接种至6 孔板中,分为LV 组和OE-CADM2 组。放置培养箱中培养12 h 后进行各组病毒的感染,将无关序列与病毒感染增强液混匀后加至LV 组细胞培养液中,过表达CADM2 慢病毒与病毒感染增强液混匀后加至OE-CADM2 组细胞培养液中,12 h 弃掉病毒液,更换新鲜培养基,继续培养96 h 后进行后续实验。
1.2.4 CCK8 实验 胰酶消化收集LV 组和OECADM2 组宫颈癌细胞,血球计数板进行计数。以1 500 个/孔细胞接种至96 孔板中,每组设置6 个复孔,放置培养箱中培养。在细胞接种的第0 h、24 h、48 h、72 h和96 h时,分别在每个样品孔中加入10 μl CCK8 试剂,放置培养箱中孵育1 h。采用酶标仪检测每个样品孔在450 nm处的吸光度值(OD值)。
1.2.5 流式细胞实验 胰酶消化收集LV 组和OECADM2组宫颈癌细胞,PBS洗涤2次,血球计数板进行计数。每管5×105个细胞,每组设置3 个复孔,加入预冷的无水乙醇进行细胞固定12 h。PBS 洗涤2 次后,加入细胞周期染色缓冲液和PI 染色液,37℃孵育15 min,流式上机进行细胞周期的检测。
1.2.6 Transwell 实验 胰酶消化收集LV 组和OECADM2 组宫颈癌细胞,无血清培养基洗涤2 次,血球计数板进行计数。以1×105个/孔细胞接种至24 孔板中 Transwell 小室的上室中,24 孔板中 Tran⁃swell 小室的下室中,加入含有 10%FBS 的 500 μl 细胞培养基,放置培养箱中培养。培养12 h 左右,PBS将Transwell 小室上未穿过的细胞洗去后,甲醇固定穿过的细胞,苏木素染色。显微镜下拍照,计数穿膜细胞的个数。
1.2.7 Western blot 检测蛋白表达 胰酶消化收集LV 组和 OE-CADM2 组宫颈癌细胞,PBS 洗涤 1 次,加入蛋白裂解液裂解细胞,高速低温离心30 min 提取细胞中的总蛋白。BCA 试剂盒检测细胞蛋白浓度后,加入上样缓冲液后沸水煮5 min。SDS-PAGE凝胶电泳分离变性后的蛋白,电泳后的蛋白经湿转移至PVDF膜上。PVDF膜依次与5%BSA常温孵育1 h、目的一抗稀释液(CADM2、cyclin D1、CDK4 和MMP2抗体稀释比均为1∶1 000)4℃孵育过夜、兔二抗稀释液(1∶10 000)室温孵育1 h。TBST 洗涤3 次后,采用ECL试剂盒显示蛋白条带。
1.3 统计学分析 采用SPSS17.0软件进行统计分析,数据均以表示,独立样本t检验比较两组间的统计学差异,方差分析比较两组以上的统计学差异。P<0.05为有统计学意义。
2 结果
2.1 CADM2 在宫颈癌组织中的表达水平 采用TCGA 数据库(http://ualcan. path. uab. edu/index.html)分析CADM2 在宫颈癌组织中的表达水平,结果显示CADM2 mRNA 在305 例宫颈癌组织中的表达水平显著低于其在3例正常宫颈组织中的表达水平(P<0.05,图1)。
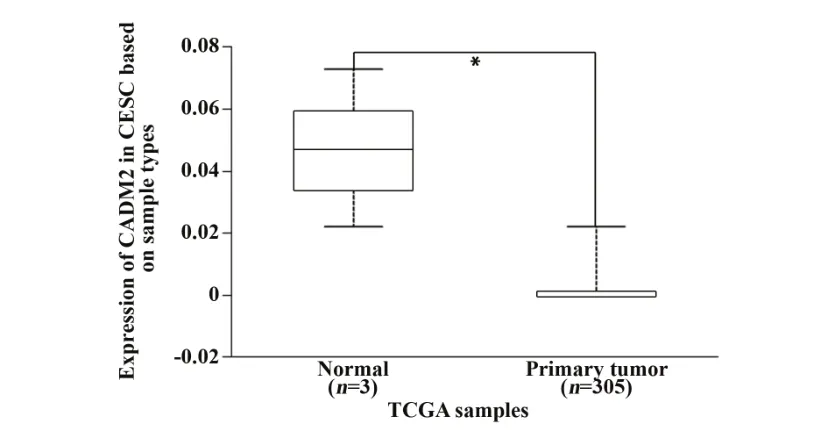
图1 TCGA数据库分析CADM2在宫颈癌组织中的表达情况Fig.1 Expression of CADM2 in cervical cancer tissues was analyzed by TCGA database
2.2 CADM2在宫颈癌细胞系中的表达水平 采用qRT-PCR 检测 CADM2 在人宫颈癌细胞系 HeLa、Si⁃Ha、C33A 和正常宫颈上皮鳞状细胞H8 中的表达水平,结果显示CADM2 在宫颈癌细胞系HeLa、SiHa、C33A 中的相对表达量分别为 1.07±0.09、1.45±0.06、0.76±0.08,在正常宫颈上皮鳞状细胞 H8 中的相对表达量为2.11±0.03。CADM2 在宫颈癌细胞中的表达均显著低于在正常宫颈上皮鳞状细胞H8 中的表达,其中在C33A 细胞中的表达最低(F=230.301,P<0.05,图2)。
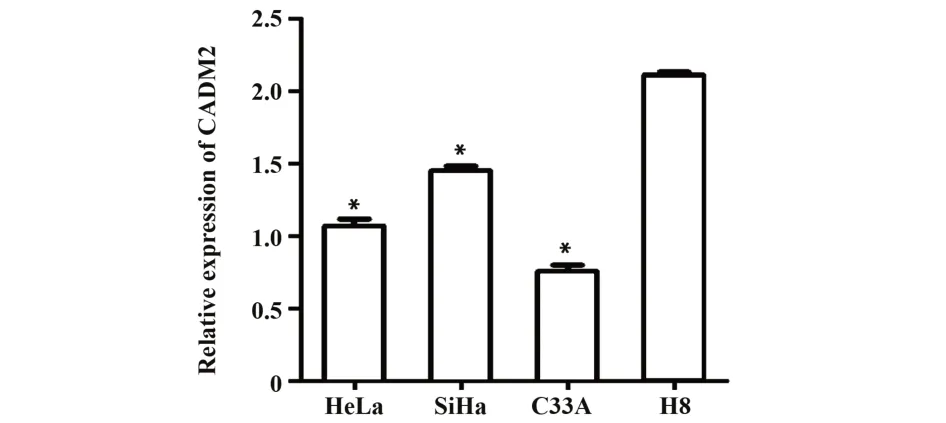
图2 qRT-PCR分析CADM2在宫颈癌细胞系中的表达水平Fig.2 Expression level of CADM2 in cervical cancer cell lines was analyzed by qRT-PCR
2.3 CADM2过表达慢病毒感染效果 选择CADM2表达较低的宫颈癌细胞系C33A 感染CADM2 过表达慢病毒,采用qRT-PCR 检测CADM2 过表达效果,结果显示LV 组C33A 细胞中CADM2 相对表达量为1.00±0.09,OE-CADM2 组 C33A 细胞中 CADM2 相对表达量为 9.74±1.45。OE-CADM2 组中 CADM2相对表达量显著高于LV组(t=10.40,P<0.05,图3)。

图3 qRT-PCR 验证CADM2过表达慢病毒感染效果Fig.3 qRT-PCR to verify effect of CADM2 overexpres⁃sion lentivirus infection
2.4 CCK8 检测细胞增殖能力 采用CCK8 实验检测CADM2 对宫颈癌细胞增殖能力的影响,结果显示,与 LV 组 C33A 细胞相比,OE-CADM2 组 C33A 细胞增殖能力显著降低,P<0.05,且随着时间的推移,两组的细胞增殖能力差异越显著,见图4。
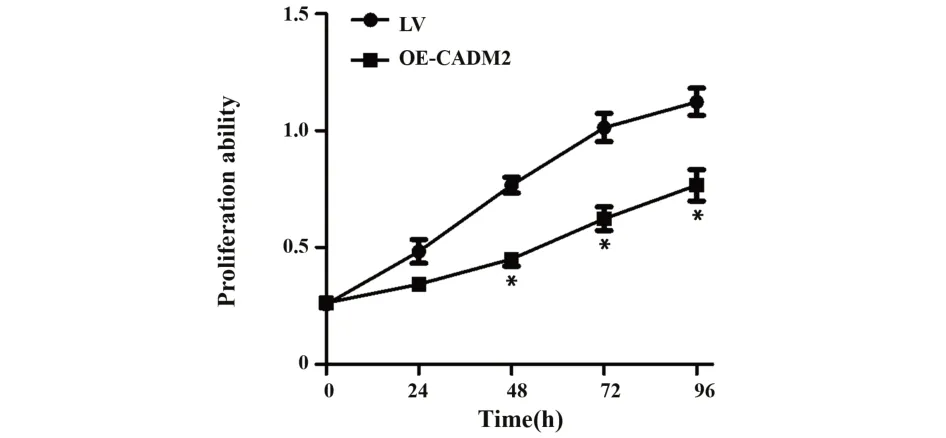
图4 CCK8 检测CADM2 对宫颈癌细胞C33A 增殖能力的影响Fig.4 Effect of CADM2 on proliferation ability of cervical cancer cells C33A was detected by CCK8
2.5 流式细胞仪检测细胞周期 采用流式细胞仪检测CADM2 对宫颈癌细胞周期的影响,结果显示,与 LV 组 C33A 细胞相比,OE-CADM2 组 C33A 细胞G0/G1期细胞比率显著增加(P<0.05,图5)。
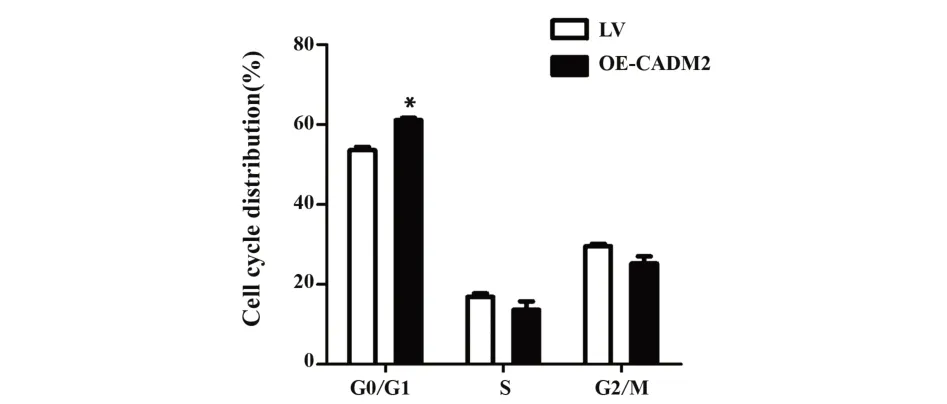
图5 流式细胞仪实验检测CADM2 对宫颈癌细胞C33A周期的影响Fig.5 Effect of CADM2 on cervical cancer cell C33A cy⁃cle was detected by flow cytometer
2.6 Transwell 实验检测细胞转移能力 采用Tran⁃swell 实验检测CADM2 对宫颈癌细胞转移的影响,结果显示,LV 组C33A 细胞穿膜细胞数为(256.67±23.42)个,OE-CADM2组细胞穿膜细胞数为(89.33±16.98)个。OE-CADM2 组细胞 C33A 转移能力显著低于LV组C33A细胞(t=13.95,P<0.001,图6)。

图6 Transwell实验检测CADM2对宫颈癌细胞C33A转移能力的影响(×200)Fig.6 Effect of CADM2 on metastatic ability of cervical cancer cells C33A was detected by Transwell test(×200)
2.7 Western blot 实验检测CADM2 对细胞周期蛋白和转移蛋白表达的影响 采用Western blot 实验检测CADM2对宫颈癌细胞周期相关蛋白cyclin D1、CDK4和转移相关蛋白MMP2表达的影响,结果显示与 LV 组 C33A 细 胞 相 比 ,OE-CADM2 组 细 胞 中CADM2 蛋白表达增加,cyclin D1、CDK4 和 MMP2 蛋白的表达降低,见图7。

图7 Western blot 检测 CADM2 对宫颈癌细胞 C33A 细胞周期蛋白和转移蛋白表达的影响。Fig.7 Effect of CADM2 on expression of cyclin and trans⁃fer protein in cervical cancer cell C33A was detect⁃ed by Western blot
3 讨论
宫颈癌是全世界最常见的妇科肿瘤,人类乳头瘤病毒(human papilloma virus,HPV)的持续感染在宫颈癌的发生和发展中起着至关重要的作用,尽管由于HPV 疫苗的广泛使用和诊断技术的发展,宫颈癌的发病率逐渐降低。但是在包括中国在内的发展中国家宫颈癌患者的人数每年都在增加,同时患者的年龄呈年轻化趋势,严重威胁着中国妇女的生命健康和安全[9]。目前根治性手术、补充放疗或放疗联合顺铂化疗是宫颈癌治疗的主要方法。然而由于晚期宫颈癌的最重要特征是局部浸润、远处转移和复发率较高,这些患者对目前治疗手段的临床反应欠佳,导致患者预后较差[2]。宫颈癌的发生和发展像一个网络系统一样复杂,其潜在机制仍然未知,因此在分子水平研究宫颈癌的发病机制是探索有效治疗策略的重要方法。
CADM2(也称为 SynCAM2、Igsf4d 和 Nectin 样分子3)位于3号染色体上,在多个正常组织中表达,在整个中枢神经系统中富集,并通过其细胞外结构域形成寡聚体,已经建立了CADM2 及包括CADM1 等相关家族成员,共同参与大脑神经元中突触前特化的组装,以指导新生和成熟突触裂之间的同源和异源相互作用[10]。研究表明敲除CADM2 的转基因小鼠的全身葡萄糖水平、肥胖程度均显著降低,而对胰岛素敏感性、运动能力和能量消耗率均显著增加[5]。表明CADM2 密切参与神经系统和能量代谢等正常生理过程[5,10]。CADM2主要表达在大脑组织中,研究报道其在脑组织中表达异常引起神经胶质瘤的发生,与正常脑组织相比,CADM2 在人脑胶质瘤组织中显著下调,并且在高级别胶质瘤组织中CADM2 表达水平显著降低。CADM2 过表达在体外和体内均抑制神经胶质瘤细胞的增殖、迁移和侵袭能力[6]。CADM2 肾透明细胞癌中表达下调,且CADM2 的异位表达抵消了miR-146a 对肾透明细胞癌细胞增殖、迁移、侵袭和上皮-间质转化过程的促进作用[7]。而 DAI 等[11]报道在非小细胞肺癌中CADM2通过调控E-钙黏蛋白促进患者的脑转移,表明CADM2 的生物学功能较为复杂,可能发挥癌基因或者抑癌基因的功能。但CADM2 在宫颈癌中的作用未知,TCGA 数据库是分析肿瘤生物信息学最重要的公共基因表达来源数据库[12]。目前TCGA 发布了305 例诊断为宫颈癌患者的基因组、转录组和蛋白质组概况的综合分析。本文采用TCGA 数据库发现CADM2 在宫颈癌组织中的表达水平显著低于在正常宫颈组织中的表达,提示CADM2 在宫颈癌中可能同样发挥抑癌作用。
为了研究CADM2 在宫颈癌中发挥的具体作用,本文首先采用qRT-PCR 检测CADM2 在宫颈癌细胞系和正常宫颈上皮鳞状细胞中的表达,结果显示CADM2 在宫颈癌细胞系中表达下调,与TCGA 数据库分析CADM2 在宫颈癌组织中表达的结果一致。研究报道在神经胶质瘤、肾透明细胞癌和食管鳞状细胞癌中CADM2 与肿瘤细胞增殖、侵袭和转移能力相关[6-8]。本文采用慢病毒感染技术对CADM2 表达较低的宫颈癌细胞C33A 进行外源性CADM2 的表达,功能实验显示过表达CADM2 抑制宫颈癌细胞增殖和转移能力。细胞周期不受调控是导致肿瘤恶性增殖的重要作用机制,抑制细胞周期进展是抗肿瘤治疗的重要途径,流式细胞仪检测发现过表达CADM2 导致宫颈癌细胞周期阻滞在G0/G1 期[13]。与 LIU 等[6]在神经胶质瘤中的研究一致。在肾癌细胞和肝细胞肝癌细胞中CADM2 通过阻断AKT 信号通路调控肿瘤细胞的增殖和转移,CADM2 在宫颈癌中发挥作用的分子机制仍需进一步研究[14-15]。生理过程中细胞周期受到严格的调控,主要包括细胞周期蛋白和周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)的调控,其中cyclin D1和CDK4 形成复合物后,促进细胞由G0/G1 期进入S 期,进而促进细胞周期的进展[16]。本文采用 West⁃ern blot 实验检测发现CADM2 过表达抑制宫颈癌细胞中cyclin D1 和CDK4 蛋白的表达。MMP 家族通过降解细胞外基质,促进肿瘤细胞发生远处转移,MMP2 是MMP 家族的一种重要蛋白酶,在宫颈癌转移过程中发挥重要作用[17]。本文采用Western blot实验检测发现CADM2 过表达抑制宫颈癌细胞中MMP2 蛋白的表达。表明CADM2 通过调控细胞周期相关蛋白和转移相关蛋白抑制宫颈癌的恶性进展。
综上所述,CADM2抑制宫颈癌的增殖和转移能力,在宫颈癌中可能通过调控细胞周期相关蛋白和转移相关蛋白发挥抑癌作用。CADM2 是宫颈癌治疗的潜在分子靶点。

