外源H2O2 对NaCl 胁迫下苜蓿幼苗生理特性的影响
付 咪,何林卫,李鲜花,李 强
(1.榆林学院陕西省陕北矿区生态修复重点实验室,陕西榆林 719000;2.榆林学院生命科学学院,陕西榆林 719000)
自然界中很多环境因子如盐、重金属、干旱等都会影响植物的正常生长发育,其中,盐和重金属是影响最普遍的2 种胁迫因子[1]。盐胁迫对植物生长发育不同阶段的影响有明显差异,其中在植物种子萌发期受胁迫影响较为显著[2]。植被生长发育时,如果有盐胁迫存在,会使渗透胁迫增加而导致水分胁迫,从而造成土壤中其他植物毒素或离子增加[3]。除此以外,盐胁迫还会降低碳的利用效率,对代谢途径中的关键因子酶的活性造成抑制作用[4-5]。因此,对于盐胁迫下如何提高植物的萌发及生长,揭示其影响机制成为目前植物生理方向研究的热点[6]。有研究表明,盐胁迫会抑制苜蓿正常的光合作用及生长发育[7]。我国盐渍土面积范围较广,盐胁迫会一定程度威胁到植物细胞的正常代谢过程[8],对植物发芽率、发芽势和一些生理生化指标有明显的抑制作用。盐胁迫对种子萌发和幼苗生长的影响研究表明,对植物危害较大的以Na 盐和Ca 盐为主,其中最常见的为Na 盐[9]。大量研究表明,植物生长调节剂及矿质元素在提高植物抗逆性方面具有较大的应用潜力[10]。近年来,外源H2O2在提高植物发芽率、发芽势、叶绿素含量等方面的研究也日益增多,利用外源物质诱导植物产生抗逆性是提高植物抵御不良环境的有效方法。过氧化氢(H2O2)是生物体内的一种活性氧分子,也是生物细胞应答逆境胁迫的重要信号分子,广泛参与植物的抗性反应[11-12]。焦德志等[13]研究认为,植物在盐胁迫下的主要生理响应是合成渗透调节物质,提高酶活性及植物抗盐性。过氧化氢是植物代谢过程中重要的信号分子,对调节植物抗逆性具有重要作用[14]。有学者认为,外源H2O2可以改善植物生理特性,对提高植物抗盐性具有一定的作用[15]。刘建新等[16-17]研究认为,外源H2O2显著提高了燕麦保护酶活性,降低了电导率和MDA 含量,且外源H2O2可通过提高植物渗透物质含量以缓解盐碱胁迫对植物生长的危害。霍平慧等[18]研究表明,100 mmol/L NaCl 对苜蓿种子萌发和幼苗生长均有抑制作用。
本试验以不同品种的苜蓿种子为研究对象,探究外源H2O2对盐胁迫下苜蓿幼苗生长及生理特性的影响,旨在为榆林地区苜蓿优质高效育种提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为饱满、大小均一且品质优良的甘农三号(GN3)、劳勃(LB)、敖汉(AH)3 种苜蓿种子。
1.2 试验方法
试验于2020 年4—9 月在榆林学院恒温光照培养箱和生理生化实验室进行。试验共设7 个处理,分别为:CK1.不加NaCl 和H2O2营养液,为对照;CK2.100 mmol/L NaCl 溶液处理;T1.100 mmol/L NaCl 和0.05% H2O2;T2.100 mmol/L NaCl 和0.1%H2O2;T3.100 mmol/LNaCl 和0.5%H2O2;T4.100 mmol/L NaCl 和1% H2O2;T5.100 mmol/L NaCl 和2% H2O2。按照试验设计,将苜蓿种子置于培养皿内,放入恒温光照培养箱中培养,待种子萌发长出2 片子叶后,移植到装有等量干净沙土的花盆中,每盆移栽10 株,继续放置于恒温光照培养箱中培养。前期对所有盆栽进行Hoagland 营养液定期定量喷施[19],待幼苗长出3 片子叶时,每天用H2O2处理液进行叶面喷施(等量20 mL),连续处理10 d 后停止,每个处理3 个重复。在苜蓿幼苗生长7 d 后在每个处理的3 个重复中随机各取5 株采集叶片带回实验室进行各项生理指标的测定。
1.3 测定项目及方法
采用丙酮法[20]进行叶绿素含量测定;采用硫代巴比妥酸法[21]进行丙二醛(MDA)含量测定;采用紫外吸收法[22]进行过氧化氢酶(CAT)活性测定。
1.4 数据分析
所有数据均为3 次重复试验结果的平均值,采用Microsoft Excel 2010 制图,采用SPSS 23.0 软件进行显著性分析。
2 结果与分析
2.1 过氧化氢对苜蓿叶片叶绿素含量的影响
由图1 可知,与CK1 相比,3 种苜蓿种子在CK2处理下叶绿素含量均降低,LB 降低0.27 mg/g,GN3降低0.54 mg/g,AH 降低0.19 mg/g,说明100 mmol/L NaCl 胁迫下,能显著降低苜蓿幼苗叶绿素含量。3 个品种苜蓿在T1、T2、T3 处理下叶绿素含量分别高于CK2,且LB 的叶绿素含量在T2 处理最高,为0.92 mg/g,较CK2 增加0.46 mg/g,GN3 和AH 均在T3 处理下叶绿素含量最高,分别为1.03、0.66 mg/g,较CK2 分别显著增加0.55、0.21 mg/g,说明一定浓度范围的外源H2O2可提高苜蓿叶片叶绿素含量。对于3 个苜蓿品种来说,T2 和T3 处理对提高苜蓿叶绿素含量显著优于T1 处理。在外源H2O2浓度为0.1%时会显著提高100 mmol/L NaCl 胁迫下LB 叶绿素含量且叶绿素含量达到最大,外源H2O2超过该浓度叶绿素含量下降,与其他浓度外源H2O2处理相比,T5 处理叶绿素含量最低,为0.53 mg/g,但较CK2 增加0.12 mg/g。在外源H2O2浓度为0.5%时会显著提高100 mmol/L NaCl 胁迫下GN3 和AH 的叶绿素含量,对叶绿素含量提高程度达到最高值,超过该值叶绿素含量呈现下降趋势,说明外源H2O2超过一定浓度后会降低苜蓿叶绿素含量。
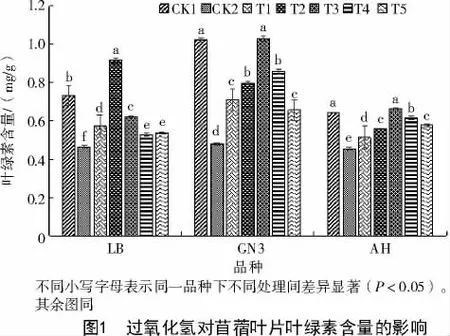
综上所述,各处理下3 个苜蓿品种叶片中叶绿素含量的变化趋势,与未经盐胁迫(CK1)下相比,盐胁迫(CK2)下,AH、GN3、LB 叶片中叶绿素含量均明显下降,与CK1 相比,分别减少了0.27、0.54、0.19 mg/g,说明盐胁迫会显著降低苜蓿叶片叶绿素含量。随着H2O2浓度的升高,3 个品种苜蓿叶片的叶绿素含量均呈现出先增后减的趋势,但始终高于CK2 下的叶绿素含量,说明外源H2O2对提高盐胁迫下苜蓿叶片叶绿素含量效果显著。
2.2 过氧化氢对盐胁迫下苜蓿叶片中CAT 活性的影响
由图2 可知,与CK1 相比,CK2 处理下3 个品种苜蓿叶片中CAT 活性均降低,LB 降低39.0%,GN3 降低22.5%,AH 降低37.6%,说明100 mmol/L NaCl 胁迫下,能显著降低苜蓿幼苗叶片CAT 活性。
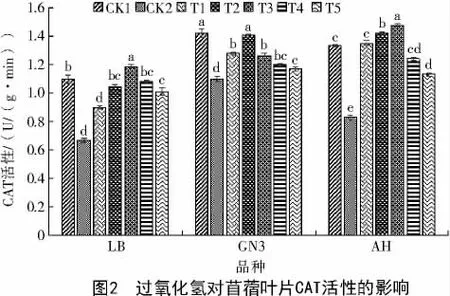
3 个品种苜蓿在T1、T2、T3 处理下CAT 活性分别高于CK2,且LB 和AH 叶片中CAT 活性均在T3处理最高,分别为1.19、1.48 U/(g·min),较CK2 分别显著增加68.7%和78.3%,GN3 的T2 处理下CAT 活性最高,为1.40 U/(g·min),较CK2 显著增加27.3%,说明不同浓度外源H2O2对苜蓿CAT 活性影响显著,一定浓度范围的外源H2O2可提高苜蓿叶片CAT 活性。
对于3 个苜蓿品种来说,T2 和T3 处理对提高苜蓿CAT 活性显著优于T1 处理,且达到峰值,当外源H2O2浓度超过0.5%时,LB 和AH 叶片中CAT活性均呈现下降趋势,当外源H2O2浓度超过0.1%时,GN3 叶片中CAT 活性呈现下降趋势且下降幅度最大,说明不同浓度外源H2O2对苜蓿CAT 活性影响显著性不同,H2O2超过一定浓度,在一定程度上会降低苜蓿CAT活性。T5 处理下LB、GN3、AH 的CAT活性均最低,分别为1.01、1.17、1.13 U/(g·min),较CK2分别增加50.7%、6.4%和36.1%。说明外源H2O2在盐胁迫下会显著提高苜蓿叶片中CAT 活性。
综上所述,与未经盐胁迫(CK1)相比,盐胁迫(CK2)下,AH、GN3、LB 这3 种苜蓿叶片中CAT 活性均明显下降,显著低于CK1,较CK1 分别下降39.1%、22.5%、37.6%;外源H2O2可显著提高盐胁迫下苜蓿叶片中CAT 活性,但随着H2O2浓度的升高,3 个品种苜蓿叶片的CAT 活性均呈现出先增后减的趋势,但始终高于CK2 下的CAT 活性,说明过高浓度的H2O2反而不利于苜蓿叶片CAT 活性的提升,但外源H2O2在一定程度上可缓解盐胁迫对苜蓿叶片CAT 活性的影响。
2.3 过氧化氢对盐胁迫下苜蓿叶片中MDA 含量的影响
由图3 可知,与未经盐胁迫的CK1 相比,CK2处理下3 个苜蓿品种的叶片MDA 含量均显著提高,说明在100 mmol/L NaCl 胁迫下,能显著提高苜蓿幼苗叶片MDA 含量。
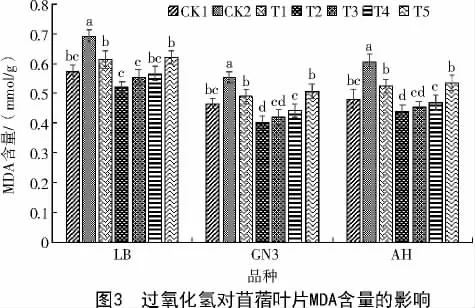
AH、GN3、LB 苜蓿叶片MDA 含量均在T1、T2处理下显著下降,且T2 处理下降幅度最大,较CK2分别下降0.17、0.15、0.17 mmol/g,说明一定浓度外源H2O2可降低盐胁迫下苜蓿叶片MDA 含量,从而较好地缓解盐胁迫对苜蓿生长的危害。当外源H2O2浓度超过0.1%时,3 个品种苜蓿MDA 含量均呈现上升趋势,说明过高浓度的H2O2处理反而加重了苜蓿幼苗的盐胁迫危害。与其他浓度的外源H2O2处理相比,T5 处理下的LB、GN3、AH 叶片MDA 含量均达到最高,分别为0.62、0.50、0.53 mmol/g,但均低于CK2 处理下苜蓿叶片的MDA 含量,分别较CK2降低了0.07、0.15、0.08 mmol/g,说明100 mmol/LNaCl胁迫下,外源H2O2可有效降低膜过氧化程度,缓解盐胁迫对苜蓿幼苗生长的危害。
3 结论与讨论
盐胁迫对植物细胞内叶绿素合成有抑制作用,植物光合作用主要依赖于叶绿素,其含量多少与植物光合作用的强弱直接相关。本研究表明,当H2O2浓度在0.1%~0.5%时,随着H2O2浓度升高,可明显提高苜蓿叶片中叶绿素含量,维护光合过程的稳定,增强植物的光合作用,这与赵萍萍[23]对小麦(Triticum aestivum)的研究结果相似。H2O2是细胞代谢过程中产生的一种废物,在CAT 作用下H2O2可分解成氧和水。而盐胁迫使得植物叶片内CAT 活性降低,因此,会造成H2O2的积累,从而对植物机体造成伤害。本研究结果表明,当H2O2浓度在0.1%~0.5%时,盐胁迫下苜蓿叶片内CAT 活性随着H2O2浓度升高而增强,从而有效缓解苜蓿幼苗的盐胁迫,这与李源[24]对板蓝根(Isatis indigotica Fort)的研究结果大致相同。在100 mmol/L NaCL 胁迫下,植物细胞内自由基产生和清理的稳定受到威胁,自由基过量会使细胞膜过氧化,MDA 含量增加,所以,叶片MDA 含量是衡量植物细胞膜脂过氧化的重要指标[25],其含量的高低可以表征细胞受胁迫严重程度。外源H2O2浓度为0.1%时,可有效降低苜蓿叶片中MDA 含量,从而较好地缓解苜蓿幼苗的盐胁迫危害,这与徐芬芬等[26]对水稻的研究结果相似。
综上所述,100 mmol/L NaCl 胁迫下苜蓿幼苗叶片叶绿素含量和CAT 活性均下降,叶片MDA 含量上升,幼苗生长明显受到抑制。添加一定浓度外源H2O2可显著提高100 mmol/L NaCl 胁迫下苜蓿叶片叶绿素含量、CAT 活性,有效降低膜脂过氧化,从而一定程度上缓解了100 mmol/L NaCl 对苜蓿幼苗生长的伤害,维持苜蓿幼苗的生长,提高苜蓿幼苗对盐胁迫的抗性,但高浓度的H2O2同样会不利于盐胁迫下幼苗的生长,且不同品种苜蓿对不同浓度外源H2O2响应效果不同,以H2O2浓度不大于0.5%的效果最好。

