金银花中氯虫苯甲酰胺残留的UPLC-PDA 分析
王建华,徐莉,蒋鑫,王晓,张颖,李广领
(河南科技学院资源与环境学院,河南新乡 453003)
金银花(Lonicerae Japonicae Flos)是忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾或初开的花[1],具有渲散风热、清热解毒和消炎退肿之功效[2],该中药材具有悠久的历史.近年来,随着金银花在治疗病毒性急性呼吸道疾病(如SARS、H7N9、COVID-19 等)方面的功效而倍受关注[3-4].
氯虫苯甲酰胺(Chlorantraniliprole)是美国杜邦公司于2000 年成功开发的邻甲酰氨基苯甲酰胺类杀虫剂,该杀虫剂对危害多种农作物的重要鳞翅目害虫防效优异[5].氯虫苯甲酰胺是昆虫鱼尼丁受体(RYR)的高效激活剂,二者结合后,将导致RYR 的钙离子通道异常开放,使贮存在肌肉细胞内的钙离子大量释放,引起肌肉调节功能衰弱、麻痹,最终导致害虫瘫痪死亡[6].氯虫苯甲酰胺纯品为白色晶体,熔点为208~210 ℃,分解温度为330 ℃,蒸气压(20 ℃)为6.3×10-12Pa,log Pow(pH 7.0,20 ℃)为2.86,pKa(20 ℃)为10.88,Henry 常数(20 ℃)为3.2×10-9Pa·m3,在水、丙酮、甲醇、乙腈中的溶解度(20 ℃)分别为1.023、3.446、1.714 和0.711 mg/L[7].
近年来,随着金银花在医疗、保健方面需求的不断增加,其种植面积逐年扩大[8],随之而来的病虫害问题开始凸显,药农不得不施用各种农药,给金银花产品品质带来了严重的农药残留安全风险.当前,氯虫苯甲酰胺在我国蔬菜、水果和粮食作物上获准登记使用,在金银花种植上尚未获得应用登记,我国、欧盟和美国等均无金银花中氯虫苯甲酰胺的残留限量标准.由于氯虫苯甲酰胺在害虫防控方面表现出的高效、广谱和持效性,其在金银花生产过程中的违规使用现象时有发生.
目前已报道的植物源样品中氯虫苯甲酰胺残留分析方法主要包括液相色谱法(样品基质涉及果蔬[9-11]、谷物[12-14]、中药材[15]和环境样品[16-17]等)、液质联用法(样品基质涉及果蔬[18-20]、谷物[21-22]、植物调味品[23]和中药材[24]等)、气相色谱法[25]、气质联用法[26-28]和毛细管电泳法[29-30]等.尽管基于单离子监测(SIM)或选择反应监控(SRM)模式的质谱检测技术可以大大简化样品前处理程序,但价格昂贵,而目前报道的气相色谱或液相色谱检测技术存在步骤繁琐、费时、费力等缺点.
截至目前,尚无金银花中氯虫苯甲酰胺残留分析方面的文献报道.本研究拟在已报道相关分析方法基础上,建立金银花中氯虫苯甲酰胺残留的QuEChERS 样品前处理程序和UPLC-PDA 分析方法,该研究对于保障以金银花为原材料的药材产品品质和健全氯虫苯甲酰胺的残留安全风险评估方面具有重要意义.
1 材料与方法
1.1 试验药品
氯虫苯甲酰胺标准溶液(100 mg/L,溶剂为乙腈),德国Dr.Ehrenstorfer 公司;HPLC 级的甲醇和乙腈,美国Mreda 公司;氯化钠、硫酸镁和乙酸铵,国药集团化学试剂有限公司;PSA、C18和GCB,天津博纳艾杰尔科技有限公司;MWCNTs-COOH 和MWCNTs-OH,北京德科岛金科技有限公司;MWCNTs-COOH 和MWCNTs-OH 使用前均在120 ℃下烘干2 h,硫酸镁使用前130 ℃烘干6 h.试验用水由Millipore 超纯水系统制备.
1.2 试验仪器
UPLC-PDA 系统,配置真空脱气机、瓶式自动进器、二元泵、四元溶剂分配系统、柱温箱和PDA 检测器;Empower 3 数据采集和处理系统,美国Waters 公司;VORTEX 3 涡旋混合仪,德国IKA 公司;TDL-5000B型低速冷冻大容量离心机,上海安亭科学仪器厂;GTR16-2 型高速冷冻离心机,北京时代北利离心机有限公司;JJ500Y 型电子天平,常熟市双杰测试仪器厂;FW100 型高速万能粉碎机,苏州江东精密仪器有限公司;Milli-Q 超纯水系统,美国Millipore 公司.
1.3 试验材料
金银花,河南省封丘县金银花种植基地.试验所用金银花样品经干燥、粉碎后用塑封袋封装,并于-20 ℃下保存,待测.
1.4 试验方法
1.4.1 色谱分析条件 色谱柱为Waters Acquity UPLC BEH C18柱(2.1×100 mm,1.7 μm);柱温30 ℃;流动相乙腈和浓度为5 mmoL/L 乙酸铵水溶液(体积比V∶V=60∶40),流速为0.4 mL/min;PDA 的检测波长范围200~400 nm,分析波长为254 nm;进样量为2 μL.
1.4.2 标准曲线绘制 将氯虫苯甲酰胺标准溶液用乙腈提取液稀释为系列工作溶液,在优化的色谱条件下,分别对所配制的标准溶液进行色谱测定,以质量浓度为横坐标、对应的色谱峰积分面积为纵坐标绘制标准曲线,求得线性回归方程和相关系数;分别以3 倍信噪比(S/N=3)和10 倍信噪比(S/N=10)测定方法的检出限(LOD)和定量限(LOQ).
1.4.3 回收率试验 预先配制0.1、1.0 和2.0 mg/L 质量浓度的氯虫苯甲酰胺标准溶液,各取1 mL 分别添加至盛装有2.0 g均质化金银花空白样品的50 mL离心管中,得到含量为0.05、0.50 和1.00 mg/kg三个添水平的标样添加样品,各添加水平均作3 次重复,涡旋混匀后静置30 min,使添加的农药标样与样品基质充分吸附;加入2 mL 去离子水和10 mL 乙腈,涡旋混匀2 min,再加入2 g 氯化钠,涡旋混匀1 min,5 000 r/min 离心5 min,小心移取1 mL 上清液至2 mL 聚四氟乙烯具塞离心管(预先盛装有25 mg PSA、25 mg C18、50 mg 硫酸镁和25 mgMWCNTs-OH),剧烈涡旋1 min,12 000 r/min 离心5 min,上清液通过0.22 μm 针头过滤器过滤;按照1.4.1 的UPLC-PDA 色谱条件进行样品检测,根据1.4.2 中求得的标准曲线进行外标法定量校准,并根据分析结果计算添加回收率及各添加水平3 个平行样品测定值间的相对标准偏差(RSD).
1.4.4 实际样品检测 实际样品严格按照与1.4.3 相同的方法制备,然后采用1.4.1 方法进行样品分析.
2 结果与分析
2.1 色谱分析条件
氯虫苯甲酰胺标准样品、金银花空白样品及氯虫苯甲酰胺空白添加样品色谱图如图2 所示.
在色谱方法优化过程中发现,以Acquity UPLC BEH C18柱(2.1×100 mm,1.7 μm)为分离分析柱,柱温30 ℃,乙腈和浓度5 mmoL/L 乙酸铵水溶液(体积比V∶V=60:40)为流动相,流速为0.4 mL/min,检测波长254 nm,进样量2 μL,可获得金银花样品中氯虫苯甲酰胺良好的分离效果.分离结果如图1 所示,色谱保留时间为1.05 min,且峰形良好、金银花样品基质无干扰.
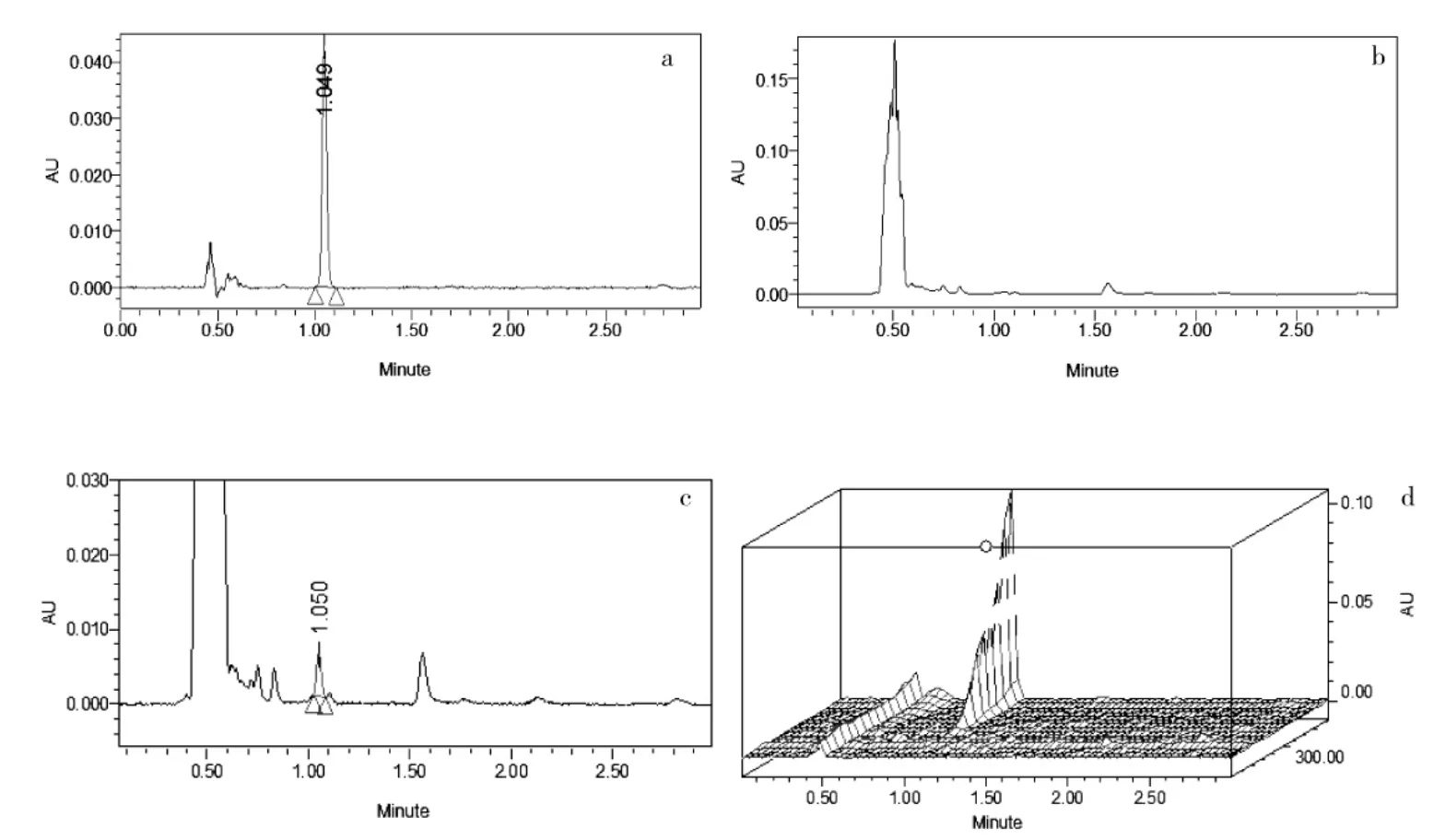
图1 氯虫苯甲酰胺标准样品、金银花空白样品及氯虫苯甲酰胺空白添加样品色谱图Fig.1 Chromatograms of chlorantraniliprole standard sample,Lonicera japonica blank sample and chlorantraniliprole fortified in Lonicera japonica blank sample
2.2 线性方程及相关系数
分析方法的线性方程及相关系数如图2 所示.

图2 氯虫苯甲酰胺在金银花样品中的基质标准曲线Fig.2 Matrix calibration curveof chlorantraniliprole in Lonicera japonica
由图2 可知,将溶解于乙腈的质量浓度为100 mg/L 氯虫苯甲酰胺标准溶液用金银花空白样品提取液逐级稀释为质量浓度分别为0.05、0.10、0.25、0.50、1.00、2.50 和5.00 mg/L 的基质标样,在最佳色谱条件下进样测定,以质量浓度为横坐标、以对应的色谱峰积分面积为纵坐标绘制标准曲线,拟合出线性回归方程为y=6842.6x+27.745,相关系数为R2=0.999.
2.3 准确度和精密度
通过加标回收率和相对标准偏差(RSD)来确定分析方法的准确度和精密度.图1-c 和图1-d 分别为金银花空白样品中氯虫苯甲酰胺含量为0.5 mg/kg 的标样添加色谱图和相应的紫外吸收光谱检测结果,表1 为金银花空白样品中氯虫苯甲酰胺含量分别在0.05、0.50 和1.00 mg/kg 三个添加水平时的回收率试验结果.由表1 可知,金银花空白样品中氯虫苯甲酰胺的平均回收率均在91%~104%,RSD 均小于6%.通过在金银花空白样品提取液中添加少量适当质量浓度的氯虫苯甲酰胺标准溶液进样分析,并分别以S/N=3和S/N=10 计算方法的LOD 和LOQ 为0.017μg/kg 和0.028 mg/kg.

表1 金银花样品中不同水平氯虫苯甲酰胺的添加回收率(n=3)Tab.1 Recoveries of chlorantraniliprole at the different spiked levels in Lonicera japonica(n=3)
2.4 实际样品分析
应用所开发残留样品前处理程序(1.4.3)和仪器分析方法(1.4.1)分别对源于8 个药材商家的8 份金银花样品进行氯虫苯甲酰胺残留量检测,结果显示,3 份金银花样品中含氯虫苯甲酰胺残留检测量分别为0.060 mg/kg、0.073 mg/kg 和0.130 mg/kg,其余5 份均为未检出.
3 结论与讨论
本研究在色谱分析方法开发过程中分别尝试用甲醇、乙腈及不同pH 的甲醇和乙腈作为流动相,试验可知,用体积比为60∶40 的乙腈和浓度为5 mmoL/L 的乙酸铵水溶液作流动相时不但保证氯虫苯甲酰胺有合适的色谱保留时间,而且峰形更加尖锐、对称性更好.此外,为避免因色谱柱温度变化造成重现性差,以及因流动相黏度高造成色谱柱柱压偏高、柱效降低,最终设定色谱柱柱温为30 ℃.
金银花样品中含有黄酮、有机酸、挥发油、环烯醚萜、甾醇和植物色素等[31],基质成分相对复杂,给金银花残留样品分析带来难度,本研究引入基质匹配标准曲线外标法进行定量校准.
传统的QuEChERS 方法使用PSA 和C18 作为净化材料,PSA 表面为极性官能团,主要吸附样品中较强极性的杂质,如有机酸、糖及部分色素等;C18 材料为弱极性吸附剂,对弱极性物质有较强的吸附能力,可去除样品中脂肪和蜡质等弱极性杂质,并对样品中硫化物等杂质有较好的去除效果;GCB 主要用于去除样品提取物中的大部分可见植物色素和固醇类物质,对平面型有机分子有较强的吸附能力[32].CNTs为新型碳纳米吸附材料,具有典型的层状中空结构,具有较大的比表面积、较好的热稳定性、机械稳定性及疏水性,CNTs 与样品基质间的疏水作用及π-π 相互作用使其对样品基质中的色素等极性成分有较好的吸附能力[33].本研究分别比较了25 mg MWCNTs-COOH、MWCNTs-OH 和GCB 对1 mL 金银花样品乙腈提取液中植物色素和目标分析物的去除效果和吸附情况,发现三种吸附材料对样品提取液中植物色素的净化效果无明显差别,它们对氯虫苯甲酰胺的吸附量依次为GCB>MWCNTs-COOH>MWCNTs-OH,MWCNTs-COOH 对氯虫苯甲酰胺的吸附能力与其易于和氯虫苯甲酰胺分子中的氨基形成酰胺键有关;而GCB 对氯虫苯甲酰胺较强的吸附能力应归因于氯虫苯甲酰胺近乎平面型的分子构型[34].
本研究建立的金银花中氯虫苯甲酰胺残留改良版QuEChER 样品前处理程序,不仅有效降低了影响定量分析结果的样品基质含量,而且与常规样品前处理方法相比大幅度减少了有机溶剂的消耗量,并且有效提高了分析样品制备效率.同时在UPLC-PDA 分析过程中,采用基质匹配标准曲线定量校准的方法有效降低了样品基质对残留检测结果的影响.本研究开发的残留分析方法可以作为氯虫苯甲酰胺在金银花种植上应用登记残留试验的方法选项.

