7 000 m海拔时不同缺氧时间对大鼠血液学及组织形态学的影响
高小敏,胡 彬,吴晓军,姜 一,孔秀梅,刘杜霞,赵 勤
(1.西藏民族大学藏药筛选实验室,陕西 咸阳 712082;2.南昌大学第二附属医院急诊科,江西 南昌 330027)
随着高原地区资源不断开发与利用,从平原地区进入高原地区的人越来越多。高海拔地区低气压、低氧、强紫外线的特殊环境[1]会使多数人出现急性高原反应,严重的可导致急性高原病,甚至危及生命的高原肺水肿、脑水肿[2,3]。因此,高原病的预防和治疗是众多科研工作者需要攻克的难题,但其特殊的地理、气候、条件等因素成了科研人员研究高原病的阻碍。有研究表示,通过低压氧舱可模拟高原低压缺氧环境,以方便研究者进行试验研究[4]。本文使用低压氧舱装置模拟7 000 m海拔低压缺氧环境,通过观察不同缺氧时间大鼠的血常规、血清生化指标,以及心脏、肺脏、脑组织H&E染色的变化,为进一步研究急性低压缺氧环境引起的急性高原病提供依据。
1 材料与方法
1.1 实验动物
SD大鼠40只,雄性,体重为180~220 g,由西安交大动物实验中心提供,动物合格证号:SCXK(陕)2017-003,饲养于西藏民族大学医学院动物房。
1.2 实验仪器
低压氧舱装置(西安富康空气净化设备工程有限公司);兽用血细胞分析仪(迈瑞生物医疗电子股份有限公司,型号BC-2800Vet);雪花制冰机(常熟市学科电器有限公司);电子天平(上海民桥精密科学仪器有限公司);Hettich高速冷冻离心机(德国Hettich科学仪器公司);全波长酶标仪(赛默飞世尔科技(中国)有限公司)。
1.3 药品与试剂
中性甲醛缓冲液(天津天力化学试剂有限公司);乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所(20170610);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所(20170615));丙二醛(MDA)试剂盒(南京建成生物工程研究所(20170612))。
1.4 急性低压缺氧大鼠模型的建立
将40只清洁级SD大鼠随机分为5组:急性低压缺氧0、6、12、24、36 h组,每组8只。设置低压氧舱装置海拔为7 000 m,上升速度为30 min,下降速度为30 min。按照拟定条件,将大鼠置入低压氧舱内进行低氧处理。
1.5 血液常规指标和血清生化指标测定
血液学常规指标测定按设置的缺氧时间结束后立即取出大鼠,使用1%戊巴比妥按大鼠体重×0.3%进行麻醉。大鼠麻醉后,在腹主动脉处取血5 mL,立即进行血液学常规检测。
血清试剂盒生化测定血常规检测后,将所取的血液放在4℃条件下静置24 h,分离血清进行生化指标检测。将静置血清分装后,按照各项试剂盒方法进行生化指标SOD、MDA和LDH检测。如果血清出现部分溶血,那么应使用高速离心机(3 000 r/min)进行10 min离心,然后取上清待测。
1.6 心脏、肺脏、脑组织H&E染色
取各组大鼠的心脏、肺脏、脑组织浸泡在备好的10%甲醛中,H&E染色后做病理学检查。
1.7 统计学处理
各组的结果数据使用统计学软件SPASS21.0进行统计分析处理,各组血常规和血液生化指标等数据使用(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 在7 000 m海拔条件下不同缺氧时间对大鼠血液学部分指标的影响
与缺氧0 h组相比,模拟在7 000 m海拔环境下,缺氧6 h组大鼠的WBC、Lymp、Gran、RBC指标的数量均减少,HGB、HCT、PLT指标的浓度降低。随着缺氧时间的延长,在缺氧12、24、36 h组大鼠的上述指标均增加,缺氧24 h组大鼠的RBC明显升高(P<0.05),见表1。
表1 各组血常规指标变化(n=8,±s)Tab 1 Changes of blood routine indexes(n=8,±s)
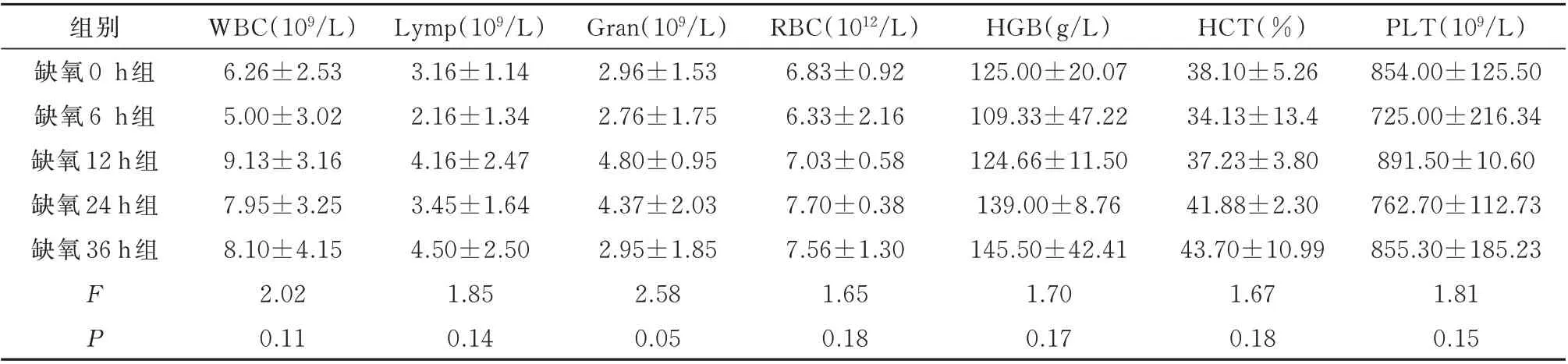
表1 各组血常规指标变化(n=8,±s)Tab 1 Changes of blood routine indexes(n=8,±s)
组别缺氧0 h组缺氧6 h组缺氧12 h组缺氧24 h组缺氧36 h组FP WBC(109/L)6.26±2.53 5.00±3.02 9.13±3.16 7.95±3.25 8.10±4.15 2.02 0.11 Lymp(109/L)3.16±1.14 2.16±1.34 4.16±2.47 3.45±1.64 4.50±2.50 1.85 0.14 Gran(109/L)2.96±1.53 2.76±1.75 4.80±0.95 4.37±2.03 2.95±1.85 2.58 0.05 RBC(1012/L)6.83±0.92 6.33±2.16 7.03±0.58 7.70±0.38 7.56±1.30 1.65 0.18 HGB(g/L)125.00±20.07 109.33±47.22 124.66±11.50 139.00±8.76 145.50±42.41 1.70 0.17 HCT(%)38.10±5.26 34.13±13.4 37.23±3.80 41.88±2.30 43.70±10.99 1.67 0.18 PLT(109/L)854.00±125.50 725.00±216.34 891.50±10.60 762.70±112.73 855.30±185.23 1.81 0.15
2.2 在7 000 m海拔条件下不同缺氧时间对大鼠血清生化指标的影响
与缺氧0 h组相比,各缺氧时间组的大鼠血清中SOD活力均降低,其中缺氧24 h组和36 h组降低明显,随着缺氧时间延长,SOD活力降低越明显,见表2。
与缺氧0 h组相比,各缺氧时间组的大鼠血清中MDA的含量呈波浪式升高,在缺氧12 h组的大鼠血清中MDA含量达最高,差异有统计学意义(P<0.05)。之后,随着缺氧时间的延长,MDA含量逐渐降低,缺氧24 h组与缺氧0 h组相比差异有统计学意义(P<0.01),缺氧36 h组的MDA含量与0 h组的水平(正常水平)较一致,见表2。
与缺氧0 h组相比,缺氧6 h组的大鼠血清LDH活力降低,其余各缺氧时间组的大鼠血清LDH活力均升高,在缺氧12 h时达到高峰。之后,随缺氧时间延长,LDH逐渐下降,缺氧36 h组接近正常,见表2。
表2 大鼠SOD、MDA、LDH生化指标的影响(n=8,±s)Tab 2 Effects of SOD,MDA and LDH biochemical indexes in rats(n=8,±s)
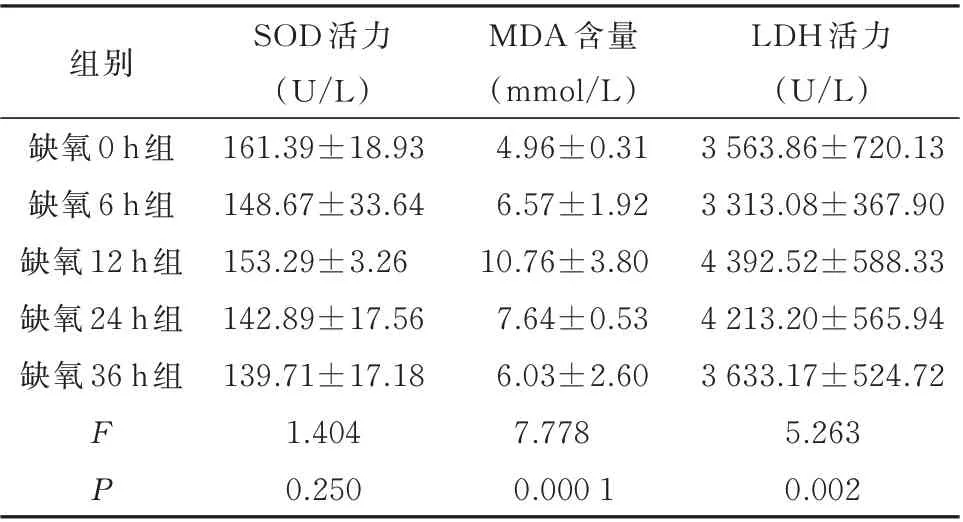
表2 大鼠SOD、MDA、LDH生化指标的影响(n=8,±s)Tab 2 Effects of SOD,MDA and LDH biochemical indexes in rats(n=8,±s)
组别缺氧0 h组缺氧6 h组缺氧12 h组缺氧24 h组缺氧36 h组FP SOD活力(U/L)161.39±18.93 148.67±33.64 153.29±3.26 142.89±17.56 139.71±17.18 1.404 0.250 MDA含量(mmol/L)4.96±0.31 6.57±1.92 10.76±3.80 7.64±0.53 6.03±2.60 7.778 0.000 1 LDH活力(U/L)3 563.86±720.13 3 313.08±367.90 4 392.52±588.33 4 213.20±565.94 3 633.17±524.72 5.263 0.002
2.3 在7 000 m海拔条件下不同缺氧时间对大鼠心脏、肺脏、脑组织结构的影响
2.3.1对大鼠肺脏显微结构的影响 由图1 H&E染色可见,与缺氧0 h组相比,在缺氧36 h内,随着缺氧时间的增加,肺脏出现间质性肺炎和血管周围炎,可见血管周围水肿和肺间质增宽,病理性损伤程度随着缺氧时间的增加越来越严重。
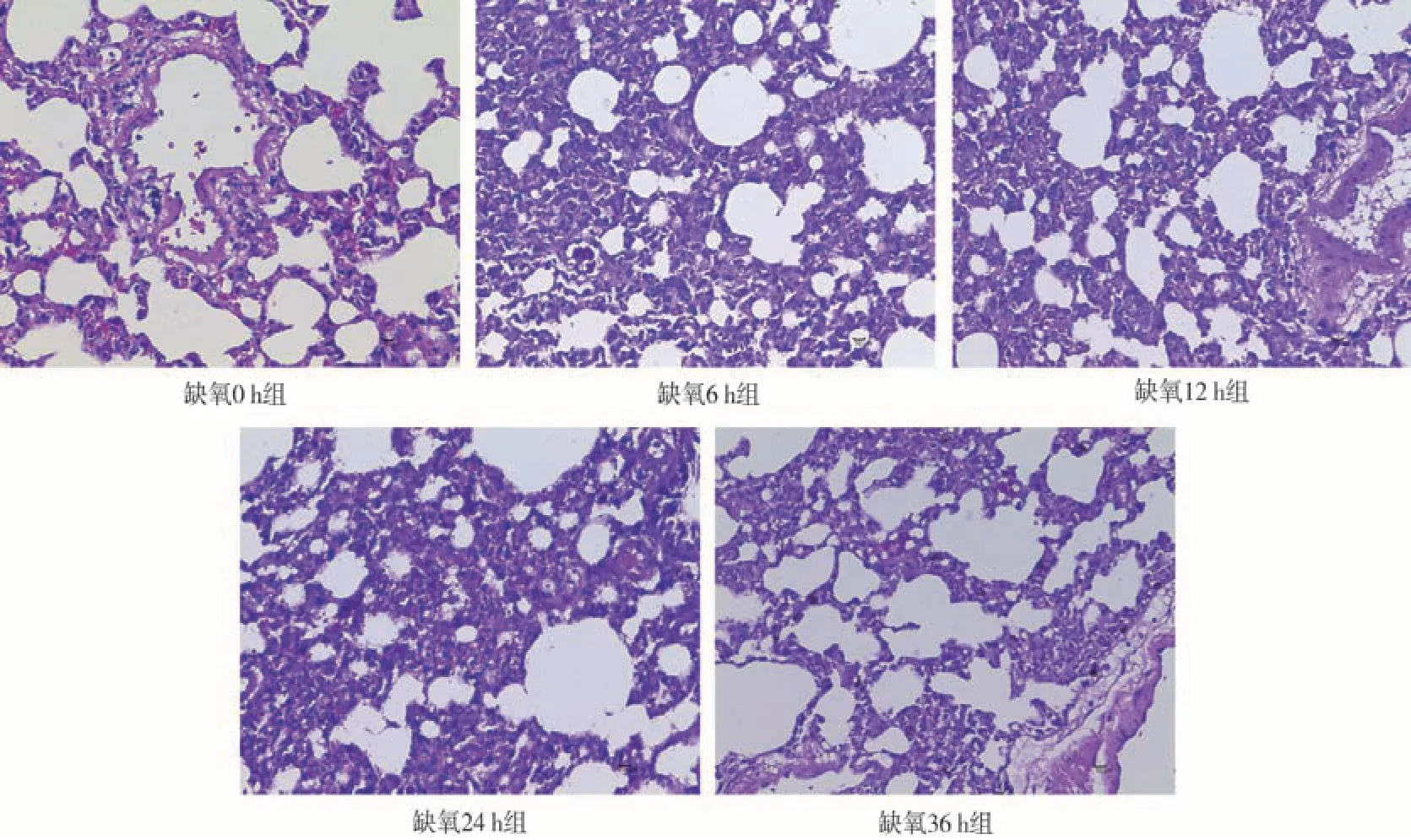
图1 不同缺氧时间大鼠肺脏显微结构(放大倍数400×)Fig 1 Microstructure of lung in rats with different hypoxia time(magnification 400×)
2.3.2对大鼠心脏显微结构的影响 由图2 H&E染色可见,缺氧0 h组心脏被膜完整,心室和心室肌轮廓较清晰;心肌细胞形态和肌纤维排列均正常。缺氧6 h组心室和心室肌轮廓较清晰;心肌纤维排列紊乱,纤维间隙扩张,变性的纤维细胞胞质染色不均;其他未见明显病理变化。缺氧12、24 h组心脏被膜完整,心室和心室肌轮廓较清晰;中膜层心肌变性,胞质染色不均,排列紊乱,纤维间隙扩张;心肌间隙可见大量炎细胞浸润,主要是嗜碱性较强的淋巴细胞;其他未见明显病理变化。缺氧36 h组中膜层心肌变性,胞质染色不均,排列紊乱,纤维间隙扩张;局部心肌间质和瓣膜纤维溶解、坏死;心肌内膜和心肌细胞间出现少量脂肪细胞。
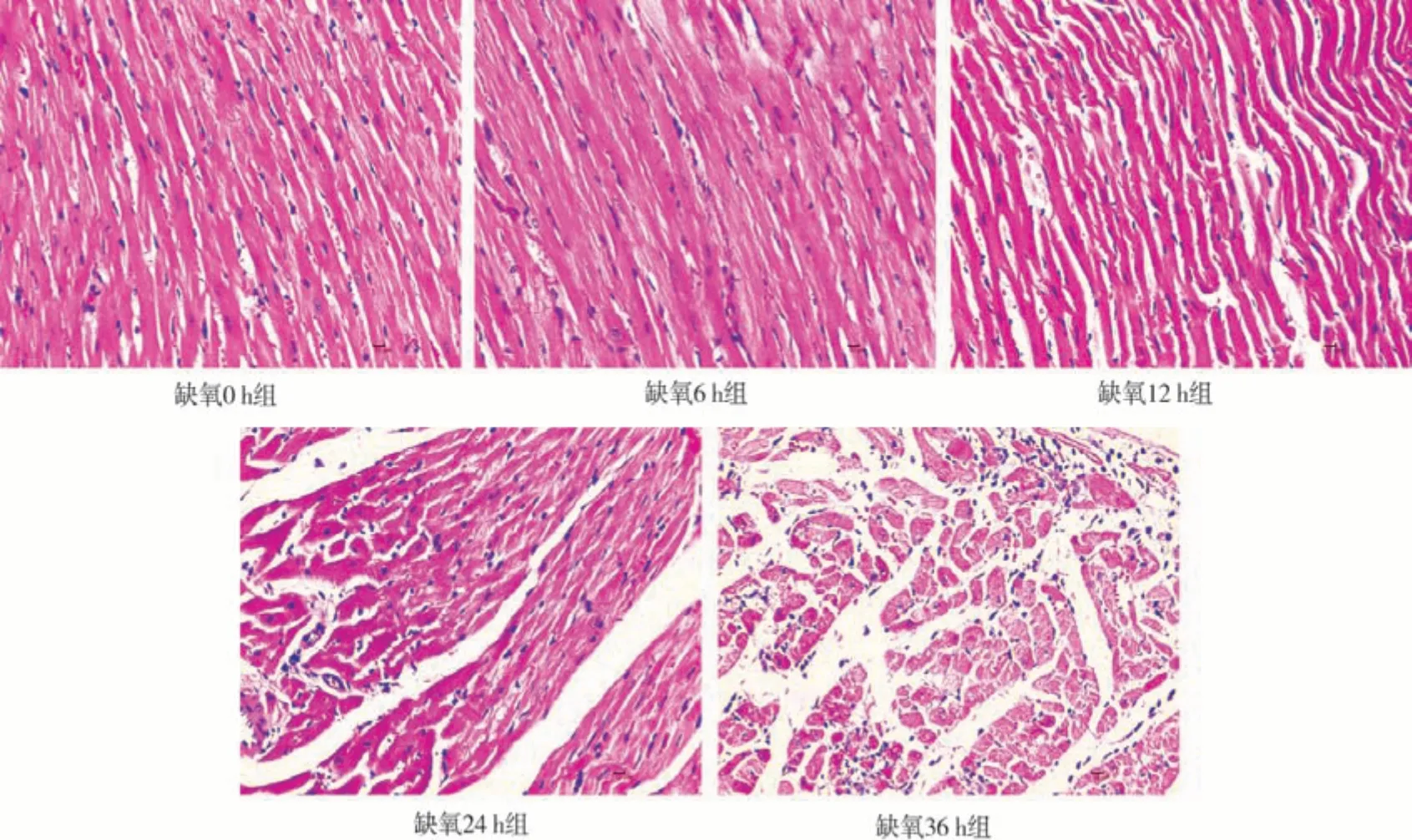
图2 不同缺氧时间大鼠心脏显微结构(放大倍数400×)Fig 2 Microstructure of heart in rats with different hypoxia time(magnification 400×)
2.3.3不同缺氧时间对大鼠脑组织显微结构的影响 由图3 H&E染色可见,缺氧0 h组海马组织结构形状完整,各区神经元细胞形态及数量正常;皮质细胞层少量神经元细胞嗜碱性增强,细胞体积正常,其他未见明显病理变化。缺氧6、12、24 h组海马组织结构形状完整,其中CA 1区神经元细胞变性,少量可见横轴结构;其他未见明显病理变化。缺氧36 h组海马组织结构形状完整,其中CA 2、CA 3、DG区神经元细胞变性,皮质细胞层可见少量神经元细胞变性,细胞固缩,嗜碱性增强,少量可见横轴结构;其他未见明显病理变化。
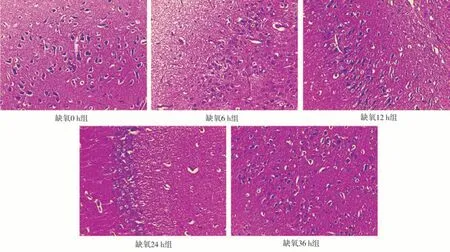
图3 不同缺氧时间大鼠脑组织显微结构(放大倍数400×)Fig 3 Microstructure of brain tissue of rats with different hypoxia time(magnification 400×)
3 讨论
数据显示,海拔3 500 m及以上会引起四分之一人群发生轻至重度高原病,而6 000 m以上的海拔会引起超过一半人群发生或轻或重的高原病[5]。随着海拔不断升高,大气压和氧分压会越来越低[6]。因此,随着海拔升高,大气氧分压和肺泡氧分压会降低,最终使经肺泡弥散入血液的氧随之减少,直接或间接引起肺脏、心脏、脑等重要脏器损伤[7]。据统计,目前我国高原居住人数达6 000万,而且越来越多的人因不同的需求进入高原地区,因此高原地区因其特殊的地理及环境条件引起的高原病越来越受到关注。然而,目前很难实现直接以具体的人为研究对象和进行实地海拔环境的研究。因此,模拟高原海拔环境的低压氧舱为相关研究提供了可能,通过随时设定低压低氧的海拔和时间,为探讨与建立低压缺氧模型的理想条件提供便利。本文主要探讨7 000 m海拔下的不同缺氧时间对大鼠造成的血液学、病理学等损伤。
心、脑组织是机体需氧最重要和最多的器官。当机体缺氧时,需要红细胞携带更多的氧以保证心、脑有足够的氧气利用,因此机体缺氧时,红细胞数量和血红蛋白含量会升高[8]。血红蛋白是机体内携氧的关键蛋白,当机体缺氧时会引起血红蛋白浓度增加,进而将氧气送至所需脏器组织[9]。但当红细胞过多时,例如成年男性细胞计数>6.0×1012/L,血红蛋白>170 g/L,成年女性红细胞计数>5.5×1012/L,血红蛋白>160 g/L时可认为是红细胞增多症,淤积的红细胞会损伤心、脑、肺等脏器,从而进一步加重各脏器的损伤[10]。血液学常规结果提示,随着缺氧时间的延长,红细胞数量增加且血红蛋白的浓度也随之增加。红细胞计数在各缺氧时间段均增加,在缺氧24 h后达到最高值,血红蛋白在24 h也显著升高,各类白细胞计数均有不同程度的增高。在7 000 m海拔环境下,不同缺氧时间对血液学常规的白细胞、红细胞、血红蛋白及血小板均有影响,除红细胞外其余指标随着缺氧时间的延长而增高。综合分析,在急性缺氧24 h时可能会引起机体血常规明显改变。
SOD是一类通过歧化反应将超氧化物转化为氧气和过氧化氢的酶。它是一种重要的抗氧化剂,保护暴露于氧气中的细胞,也是体内清除氧自由基重要的酶之一,其活力的高低间接反映体内自由基蓄积的多少[11]。氧自由基的蓄积会使其作用于脂质发生过氧化反应生成有毒性作用的MDA,MDA积累的越多其毒性越大[12]。氧自由基一方面通过生物膜多聚不饱和脂肪酸发生过氧化而损伤细胞,另一方面还可通过过氧化物产生的物质MDA引起细胞的损伤[13]。本研究结果显示,随着缺氧时间的延长,SOD的活力在不断下降,在36 h缺氧组达到最低,此时可能会急剧加重细胞的损伤。MDA的含量在缺氧12 h达到了峰值,之后逐渐降低,但均高于缺氧0 h组(空白组),在36 h缺氧组降至最低。缺氧会引起乳酸脱氢酶(LDH)活力升高,在缺氧12 h组达到高峰,随后下降并至缺氧36 h组接近正常。结合SOD、MDA、LDH三者的结果分析,考虑处于低氧环境时大鼠体内缺氧并需要更多能量来维持机体的能量平衡,当机体的葡萄糖供应不足时无氧糖酵解途径增加,此时会导致体内的乳酸蓄积,乳酸在细胞质内通过无氧氧化转变为丙酮酸需要LDH来发挥作用。因此,高原低氧环境会间接导致体内LDH活性的升高,同时可以根据LDH的高低来判断机体损伤的程度。本实验中,LDH的活力随时间延长先升高后降低,在缺氧12 h和24 h之间达到了峰值,之后呈下降趋势[14-16]。
急性高原缺氧会引起肺部血管收缩,导致肺部血液重新分布和肺泡-毛细血管屏障的损坏[17]。本实验结果发现,随着缺氧时间的延长,肺脏逐渐出现间质性肺炎和血管周围炎,可见血管周围水肿和肺间质增宽,且病理性损伤程度随着缺氧时间的增加越来越严重。心脏脏器随缺氧加重,中膜层心肌变性,胞质排列紊乱,纤维间隙扩张;心肌间隙可见大量炎细胞浸润,局部心肌间质和瓣膜纤维溶解、坏死。脑组织在缺氧36 h组CA 2、CA 3、DG区神经元细胞变性,皮质细胞层可见少量神经元细胞变性,细胞固缩,嗜碱性增强,少量可见横轴结构。因此,急性缺氧会引起肺脏、心脏、脑组织病理性损伤,且随着缺氧时间的延长各脏器的损伤程度越来越严重。
综上所述,在急性高原低压缺氧环境下,不同缺氧时间均会对血液常规学、血清SOD、MDA、LDH及心、脑、肺产生不同的影响。机体在急性缺氧时可通过增加红细胞数量、抗氧化反应和无氧呼吸等措施保证重要脏器的氧含量和能量供应。利用低压氧舱装置建立急性缺氧模型不仅操作简单便利,还可以保证实验的可行性、重复性、真实性,研究者可选取合适的缺氧时间建立不同程度的大鼠损伤模型。
作者贡献度说明:
高小敏和胡彬负责数据分析和撰写论文初稿,吴晓军和刘杜霞负责实验设计和处理动物,姜一和孔秀梅辅助数据处理作图及动物饲养等,赵勤负责本文的实验设计和论文审校。

