一种浮游植物快速浓缩及固定方法的可靠性分析
李亚莉,杨正健,*,田 盼,刘 毅,王从锋,纪道斌,刘德富
一种浮游植物快速浓缩及固定方法的可靠性分析
李亚莉1,杨正健1,2*,田 盼1,刘 毅1,王从锋1,纪道斌1,刘德富2
(1.三峡大学,三峡水库生态系统湖北省野外科学观测研究站,湖北 宜昌 443002;2.湖北工业大学,河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068)
为验证一种浮游植物快速浓缩固定方法——滤膜浓缩法的可靠性,采用“鲁戈氏液固定沉降法”和“滤膜浓缩法”同时鉴定了不同浮游植物浓度梯度水样,并进行了对比分析,结果表明:鲁戈氏液固定沉降法与滤膜浓缩法整体上均鉴定出7门,32属,但不同梯度上滤膜浓缩法鉴定出的浮游植物种类较多.两种方法门水平上除裸藻门(<0.05)外丰度均无明显差异(>0.05),属水平上相对丰度99%以内的浮游植物均无明显差异(>0.05),即无论是门还是属水平上,滤膜浓缩法对浮游植物丰度的鉴定是可行的.采用两种方法得到的不同梯度下藻密度拟合方程斜率差异较小(>0.05)且相关性显著(2=0.958,<0.01),但滤膜浓缩法鉴定出的浮游植物细胞密度更大. 整体来看, 滤膜浓缩法得到的藻类鉴定结果与鲁戈氏液固定沉降法基本一致.
鲁戈氏液固定沉降法;滤膜浓缩法;物种种类;物种丰度;线性拟合
浮游植物是指广泛分布于各种水体的悬浮藻类的总称,是水体初级生产力的主要贡献者,在水体物质与能量循环中起到重要作用[1].浮游植物的丰富程度及群落组成是反映水体富营养化的重要指标,所以很多学者会根据水体浮游植物情况来判断水体营养状态[2-3].
浮游植物个体微小,且种类繁多,对其快速固定与鉴定工作量较大,涉及因素较多,一直是水生态系统研究的难点[4-5].目前国际上最通用的方法为Utermhl计数法[6-7],该方法对浮游植物的监测稳定且准确,但是需要倒置显微镜和特制沉淀杯[8],所以我国并不推荐使用.超声震荡法会将微囊藻等群体浮游植物打散成单个细胞,还可能会造成细胞破裂碎片化,计数不稳定且影响计数结果[9].定性的浮游植物网在采集的过程中,粒径小于网绢孔径的部分浮游植物流失,网绢面积过大,在从网绢上清洗浮游植物时,也会有大量浮游植物残留于网绢上,造成损失[10-11].目前我国湖泊监测等标准推荐使用鲁戈氏液固定沉降法[12-13],该方法是利用鲁戈试剂将浮游植物全部固定后通过静置沉淀,得到浮游植物浓缩液,并在显微镜下计数[14].该方法利用浮游植物自身的重量沉淀到沉淀器底部以达到浓缩的效果,所以上清液中会残留部分自身重量较小的浮游植物,虹吸和多次转移会导致大量的细胞损失[15],并且需要控制虹吸速度,所有的操作都存在很大的经验性.利用该方法在浮游植物浓缩过程中,至少要沉淀24h,耗时过长.野外采样没有较好的沉淀环境,运输水样时很难保证沉淀浓缩过程不受扰动,扰动沉淀会导致已经沉淀到底部的浮游植物又回到上清液中,需要重新沉淀,拉长浓缩时间,对于野外采样天数较长的,会导致水样中的浮游植物分解,无法及时动态的了解浮游植物的演替情况[16].在比较大型的水体监测中,采集大量水体样品,需要耗费较大的人力和运输成本.
本文提出了一种浮游植物快速固定的方法——滤膜浓缩法,该方法利用滤膜的物理截留作用达到浓缩效果.该方法使用的滤膜孔径小,所以浮游植物流失量会更小,对环境条件要求小,且耗费的时间较少,能够满足浮游植物野外监测的时效性要求,对研究人员的经验性要求较小,可以简化采样过程,缩短时间,降低采样成本,解决“鲁戈氏液固定沉降法”固定并鉴定浮游植物过程中的问题.
1 材料与方法
1.1 浮游植物水样制备
为了使实验鉴定更为精确,需采用藻密度较大的水体配置不同浓度的样品,于是用采水器在含有不同藻种的香溪河取水8L,置于10L的藻类养殖框中,分别加入1mL浓度为1mg/mL的氨氮,总氮,总磷营养液,露天放置在有自然气候影响的场所培养一周,每天多次搅拌,使浮游植物密度增长且不生长附着藻并防止藻类絮凝,将此用作母液.配置样品时,分别取母液0、25、50、100、200、400、800mL于1L棕色定量瓶中,加入蒸馏水,定容至1L,形成7个体积相同,但浓度不同的浮游植物梯度样品,梯度为0、0.025、0.05、0.1、0.2、0.4、0.8,按照同样的方法配置两组,一组用于“鲁戈氏液固定沉降法”,一组用于“滤膜浓缩法”.
1.2 实验方法与过程
1.2.1 鲁戈氏液固定沉降法 按图1所示流程,取一组配置好梯度的样品(体积为1L),在每个样品中加入配置好的鲁戈试剂固定在干净的样品瓶中,用量为水样体积的1%~1.5%,避光静置沉淀8h后,用虹吸法吸去上清液,余下300mL沉淀物,将沉淀转移到300mL棕色沉淀瓶中,再避光静置沉淀8h,利用虹吸法吸去上清液,转为150mL,再避光自然沉淀8h,利用虹吸法吸去上清液,余下40~45mL沉积物,将沉淀转移至50mL棕色定量瓶,用少许上清液冲洗沉淀器几次, 冲洗液加到定量瓶中,最后定容至50mL,用于浮游植物分类鉴定和计数统计,每次转移用上清夜清洗3次沉淀器,且沉淀过程不可扰动,虹吸过程也不可扰动下层沉淀物,若有扰动,需重新静置沉淀.虹吸过程中流速不宜过大,且虹吸管应低于水面,避免漂浮于水面的微小生物进入虹吸管.

图1 鲁戈氏液固定沉降法流程
1.2.2 滤膜浓缩法 按图2所示流程,取另一组已配置好梯度的样品(体积为1L),利用抽滤装置,把每个样品分别用孔径为0.45mm的醋酸纤维膜抽滤(抽滤时避免抽干),得到滤纸,将要鉴定的浮游植物通过物理截留作用富集在滤膜上,直接取滤膜,用洗瓶装蒸馏水将滤膜上的浮游植物冲洗入50mL定量瓶中,并用玻璃棒捣下滤膜上的浮游植物,再将滤膜放入瓶中,加蒸馏水,用玻璃棒充分搅拌,使滤膜上的浮游植物全部到水中,取出滤膜,用蒸馏水冲洗滤膜上残留的浮游植物到定量瓶中,得到含有和采样水体一致浮游植物种类和数量的混合水样,定容到50mL,将样品混合均匀,这样得到的待检测的样品任取一定量,浓度和含量都一致,本实验将每个样品得到的滤纸上的浮游植物分别清洗进50mL棕色瓶中,加入蒸馏水定容至50mL,并用玻璃棒充分搅拌至膜上的浮游植物全部进入水体,再加入鲁戈试剂染色并摇匀,用量为浓缩水样体积的1%~1.5%(若要鉴定活体浮游植物可不加入鲁戈试剂并及时鉴定).

图2 滤膜浓缩法流程
1.2.3 计数与鉴定 浮游植物分类鉴定及计数之前,将浓缩样品震荡均匀,利用新S300藻类智能鉴定计数仪进行鉴定,在棕色试剂瓶中取0.1mL混合均匀的待测样品,置于光学显微镜载玻片生物计数框的计数区上,然后轻轻盖上盖玻片,注意不能在盖玻片下产生气泡,调整光学显微镜的物镜、目镜、反光镜等,使视野清晰,选用视野计数法,在光学显微镜下选取100个视野拍照记录,并鉴定得到最终的种类和数量,计数两片取平均值,若两片的数值与其平均值之差大于±15%,需进行第3片计数[19].
1.3 数据统计与分析
每升水体中浮游植物数量按下式计算[17]:
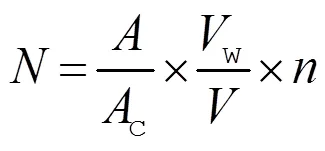
2 结果与分析
2.1 浮游植物种类鉴定结果比较分析
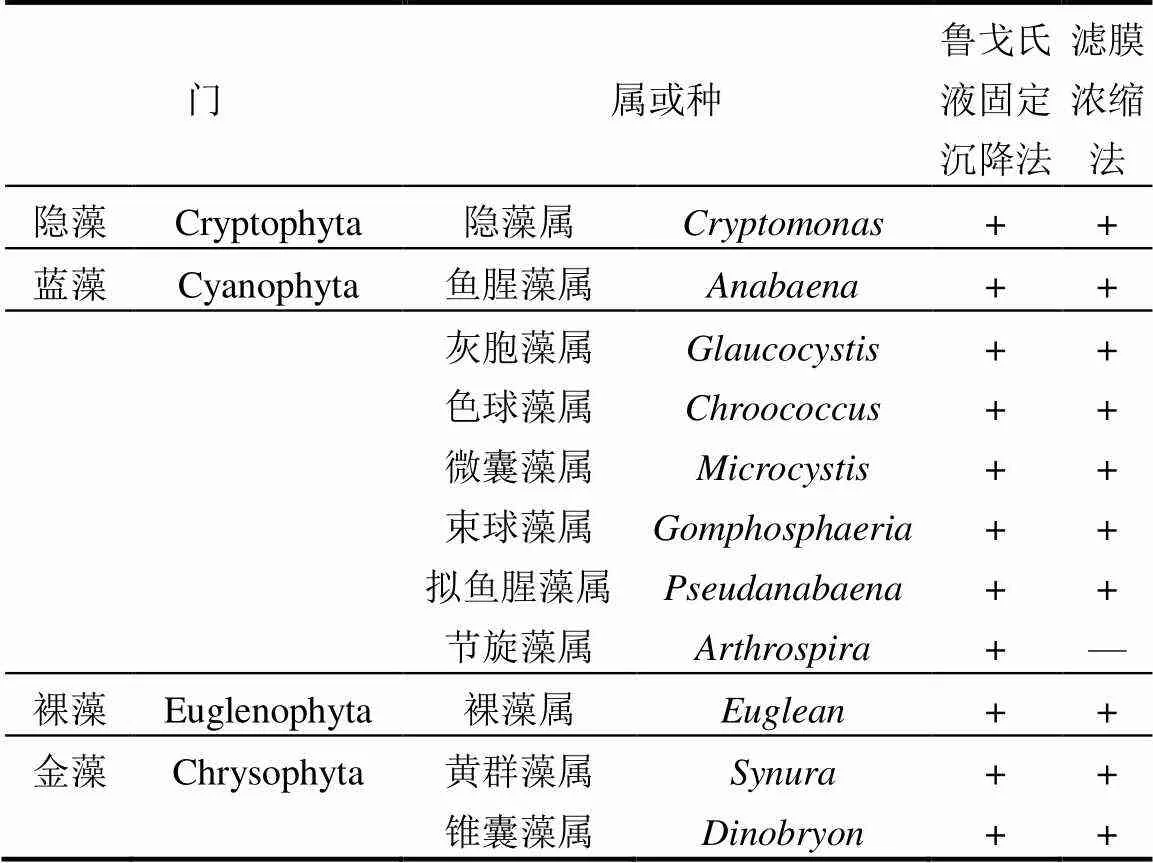
将利用鲁戈氏液固定沉降法及滤膜浓缩法鉴定出的所有梯度上浮游植物种类总结如表1,鲁戈氏液固定沉降法与滤膜浓缩法均鉴定出7门,32属,甲藻门均鉴定出4属,隐藻门和裸藻门各1属,金藻门2属,其中也各有两属不同,通过滤膜浓缩法鉴定出的硅藻门中的脆杆藻属及绿藻门的微芒藻属在鲁戈氏液固定沉降法中未鉴定出,鲁戈氏液固定沉降法所鉴定出来的绿藻门的衣藻属和蓝藻门的节旋藻属在滤膜浓缩法中未鉴定出.
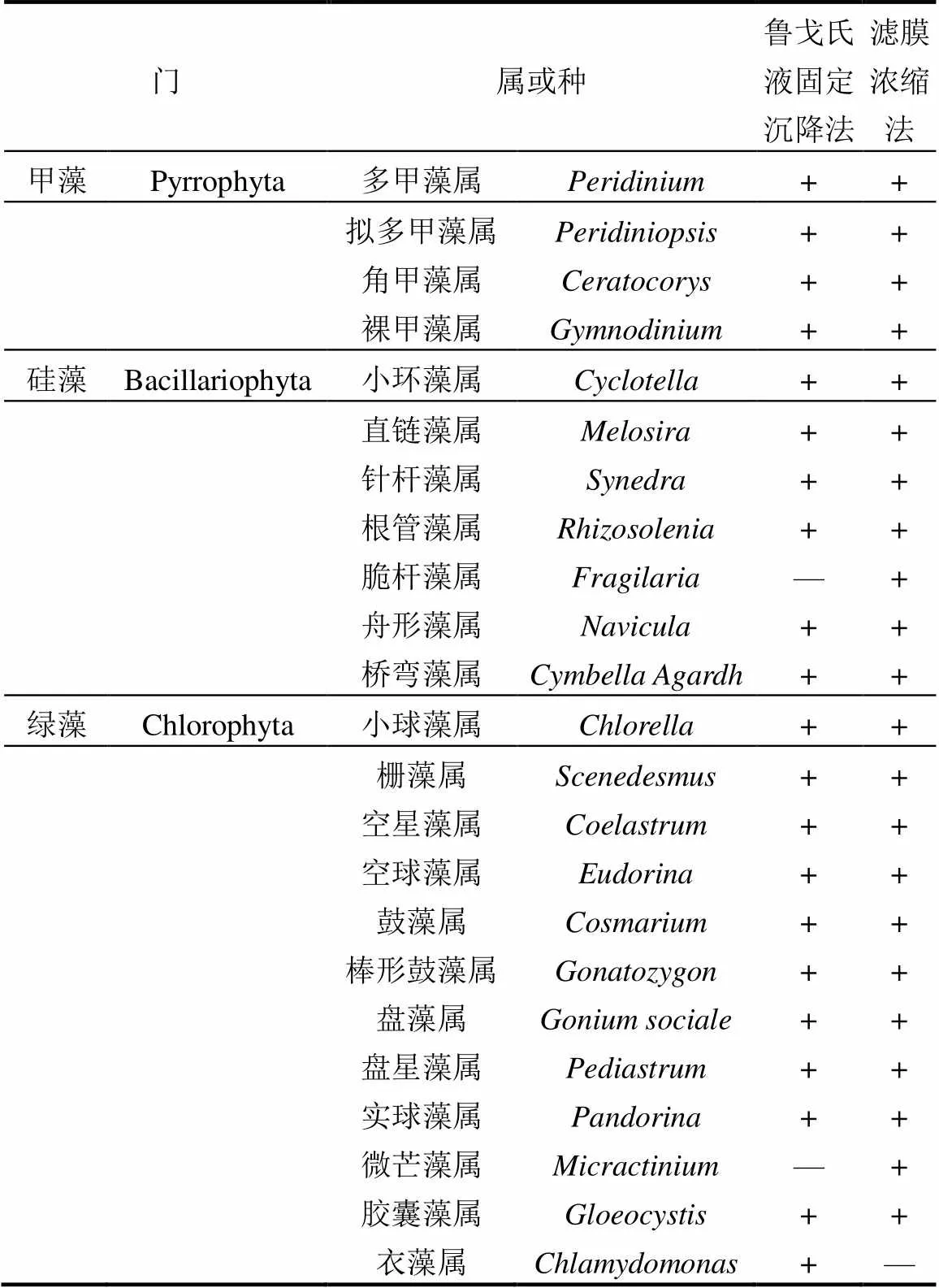
表1 浮游植物种类
续表1
注:+表示含有该属浮游植物;-表示不含有该属浮游植物.
根据不同梯度下利用两种方法鉴定出的藻种的种类,得到不同梯度下两种方法种类数的对比图,如图3所示,鲁戈沉降法鉴定出浮游植物种类平均值为19种,其种类变化范围为4~29种,即该方法至少鉴定出4种,而利用滤膜浓缩法鉴定出浮游植物平均值为21种,变化范围为8~29种,利用该方法至少鉴定出8种,利用滤膜浓缩法比鲁戈氏液固定沉降法鉴定出的种类数更多,但两种方法不同梯度上所鉴定出的浮游植物种类数无明显差异(=0.528> 0.05).结合整体上的门水平及属水平鉴定的浮游植物种类及不同梯度上的鉴定结果来看,滤膜浓缩法能够鉴定出的浮游植物种类更多.
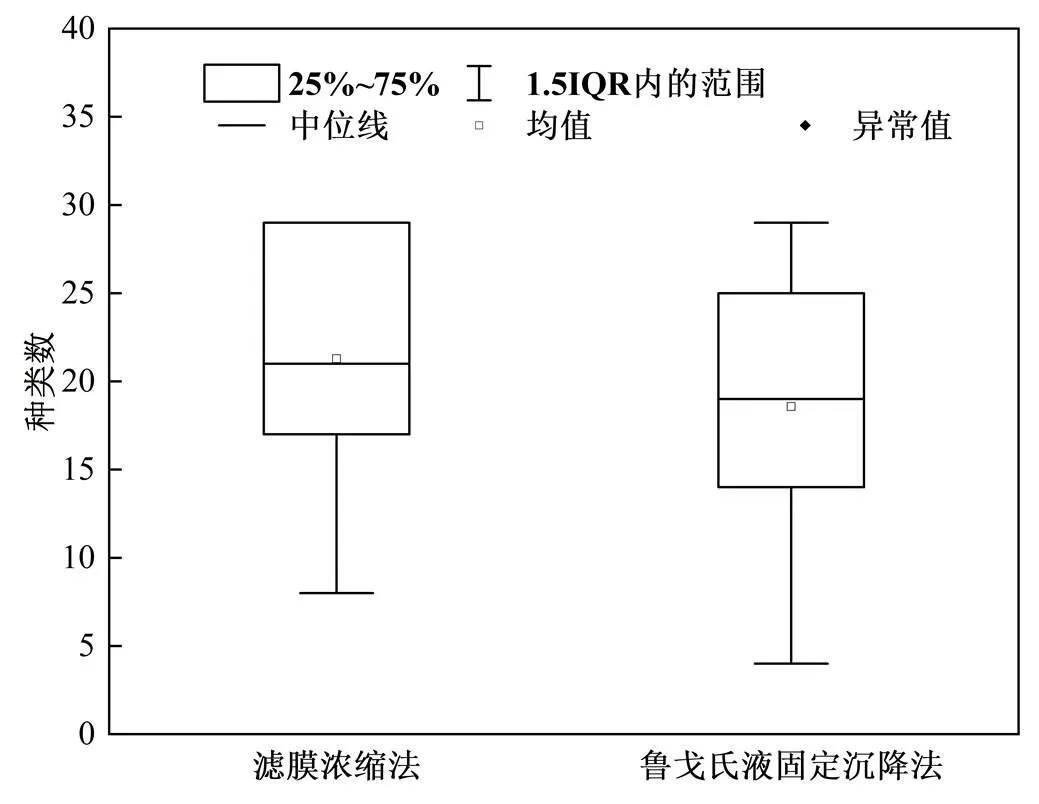
图3 不同梯度下种类数对比分析
2.2 浮游植物丰度结果比较分析
2.2.1 门水平物种丰度 在所培养的浮游植物水样中,利用鲁戈氏液固定沉降法和滤膜浓缩法均鉴定出7门(图4),主要包括金藻门(4.7×105、5.3×105(个/L))、裸藻门(2.9×104、7.4×105(个/L))、蓝藻门(7.0×107、7.2×107(个/L))、隐藻门(2.4×106、3×105(个/L))、绿藻门(7.6×108、2.0×109(个/L))、硅藻门(3.6×109、4.0×109(个/L))、甲藻门(2.2×106、9.3×105(个/L)),两种方法所得结果中均为硅藻门丰度最大,按照梯度来看,鲁戈氏液固定沉降法(图4a)所鉴定得到的硅藻门丰度分别为5.8×104、3.6×107、6.7×107、1.9×108、3.4×108、8.0×108、2.1×109(个/L),其次是绿藻门,丰度分别为5.2×105、1.2×107、2.5×107、5.6×107、8.3×107、2.6×108、3.3×108(个/L),此外隐藻门和裸藻门只检测出一属.按照梯度来看,滤膜浓缩法(图4b)所鉴定得到的硅藻门丰度分别为1.1×106、9.3×107、1.3×108、2.7×108、7.0×108、1.1×109、1.7×109(个/L),绿藻门次之,为4.6×106、6.5×107、7.7×107、1.5×108、3.7×108、5.6×108、8.0×108(个/L).
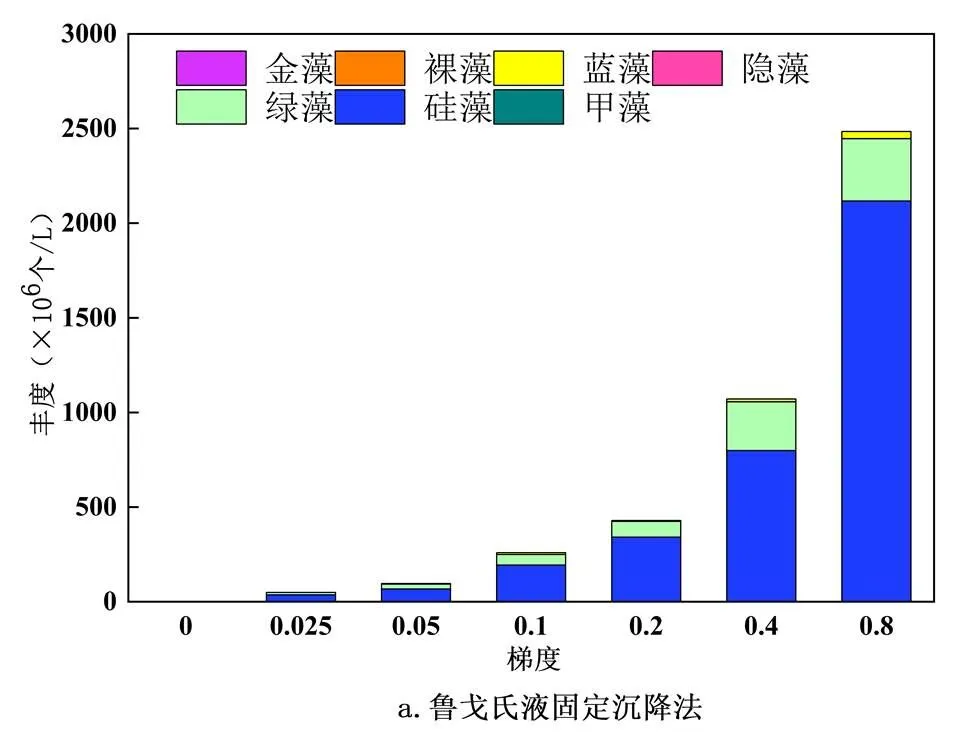
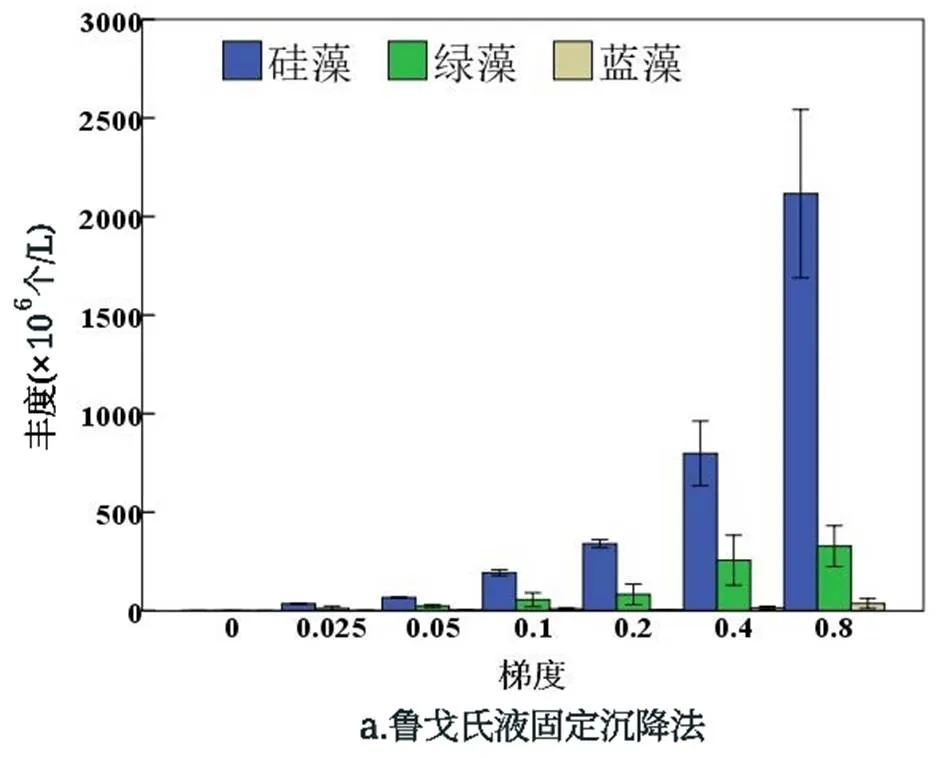
用鲁戈氏液固定沉降法与滤膜浓缩法鉴定浮游植物门水平种群丰度的标准误差具有一定的差异(图5),总体而言,采用滤膜浓缩法的标准误差及其波动程度比鲁戈氏液固定沉降法小,其中鲁戈氏液固定沉降法对于硅藻门的鉴定的标准误差随着藻浓度变大有增大趋势,对于绿藻门的鉴定标准误差波动较小.滤膜浓缩法在梯度为0.4时,标准误差最大,硅藻门和绿藻门的丰度除开梯度为0.4时,标准误差均较小,对于蓝藻门鉴定的标准误差较小,其余丰度较小不作具体分析.对两种方法鉴定出的浮游植物门水平上的丰度进行差异性分析,如表2所示,可知,除开裸藻门差异性显著(=0.018<0.05),其他门均无显著性差异.其中甲藻门显著性为=0.451>0.05,硅藻门显著性为=0.856> 0.05,绿藻门显著性为=0.167>0.05,蓝藻门显著性为=0.961>0.05,隐藻门显著性为=0.112>0.05,金藻门显著性为= 0.823>0.05.
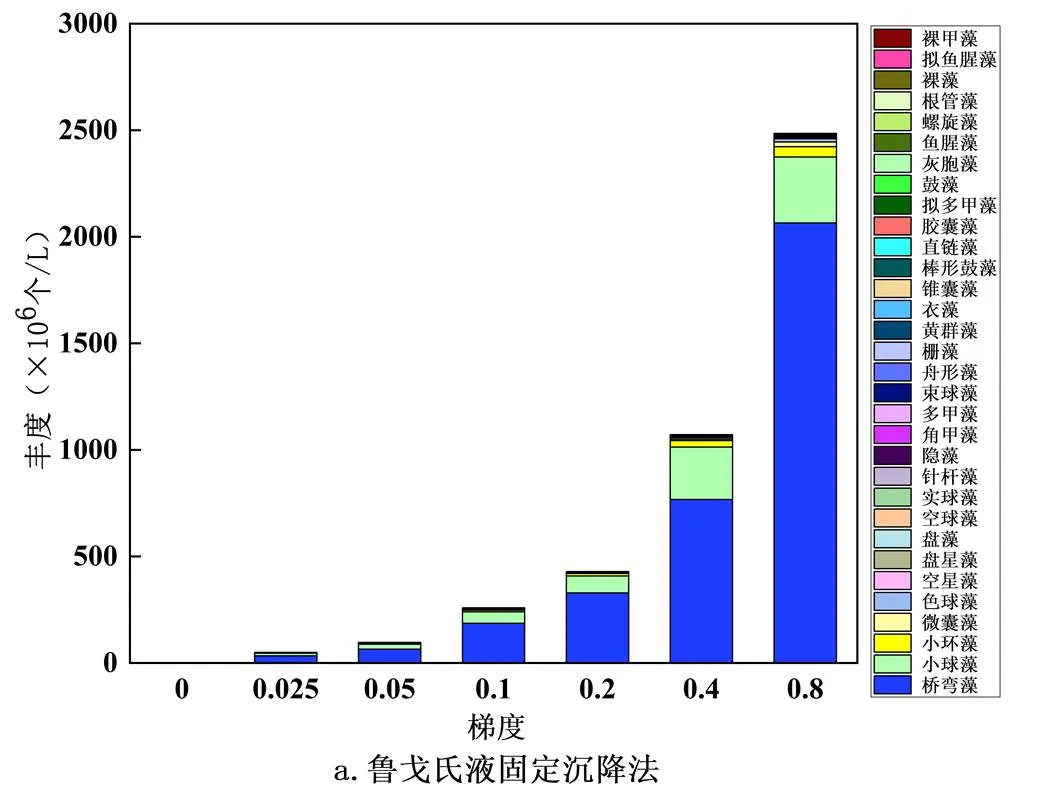
2.2.2 属水平物种丰度 属水平的物种丰度鉴定结果如图6所示,从图6可以看出,鲁戈氏液固定沉降法共鉴定出32属,包括甲藻门4属,硅藻门6属,绿藻门11属,蓝藻门7属,金藻门2属,隐藻们和裸藻门各1属.滤膜浓缩法鉴定结果除硅藻门7属,蓝藻门6属外,其余与鲁戈氏液固定沉降法一致.其中鲁戈氏液固定沉降法与滤膜浓缩法结果显示硅藻门的桥弯藻属丰度最大,分别为2.9×104、3.4×107、6.4×107、1.9×108、3.3×108、7.7×108、2.1×109(个/L).绿藻门的小球藻次之,为9.4×105、9.1×107、1.3×108、2.6×108、6.7×108、1.1×109、1.7×109(个/L).

表2 门水平上丰度差异性分析结果
对两种方法所得属水平99%相对丰度的藻属的丰度进行差异性分析,如表3所示,桥弯藻及小球藻丰度的显著性=0.856>0.05和=0.16>0.05,均无明显差异,小环藻丰度差异性分析结果显著性=0.875>0.05,微囊藻显著性=0.836>0.05,色球藻显著性=0.875>0.05,空星藻显著性=0.54>0.05,均无明显差异.
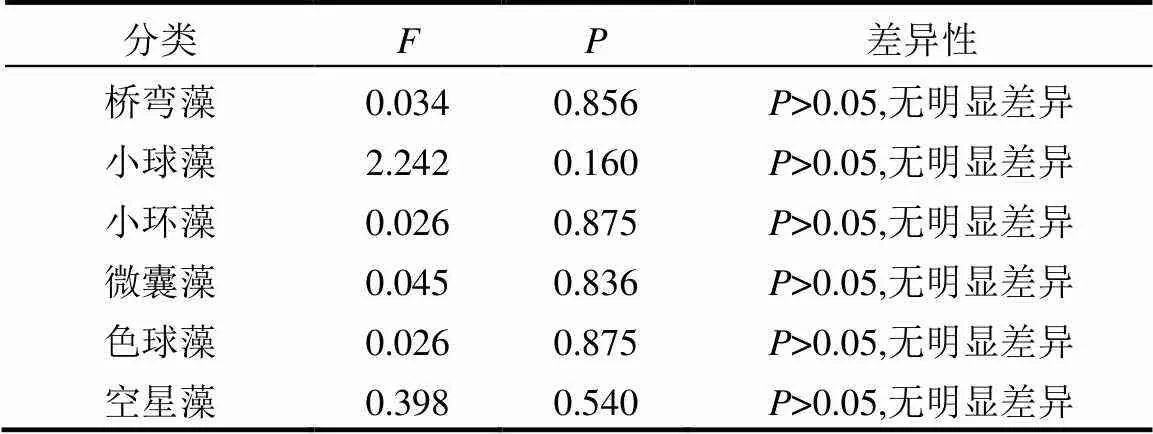
表3 属水平上丰度差异性分析
用鲁戈氏液固定沉降法与滤膜浓缩法鉴定浮游植物属水平种群丰度的标准误差具有一定的差异(图7),总体而言,采用滤膜浓缩法标准误差及其波动程度比鲁戈氏液固定沉降法小,其中鲁戈氏液固定沉降法对于桥弯藻和小球藻鉴定的标准误差随着藻浓度变大有增大趋势,对小环藻、微囊藻、色球藻和空星藻的鉴定标准误差波动较小.滤膜浓缩法在梯度为0.4时,硅藻门和绿藻门标准误差最大,除此之外,其标准误差均较小,对于其他属的鉴定标准误差及波动程度均较小,其余丰度较小不作具体分析.所以浮游植物种类鉴别属水平,滤膜浓缩法的鉴定结果与鲁戈氏液固定沉降法无明显差异,即在属水平上看,滤膜浓缩法对浮游植物物种丰富度的鉴定上是可行的.
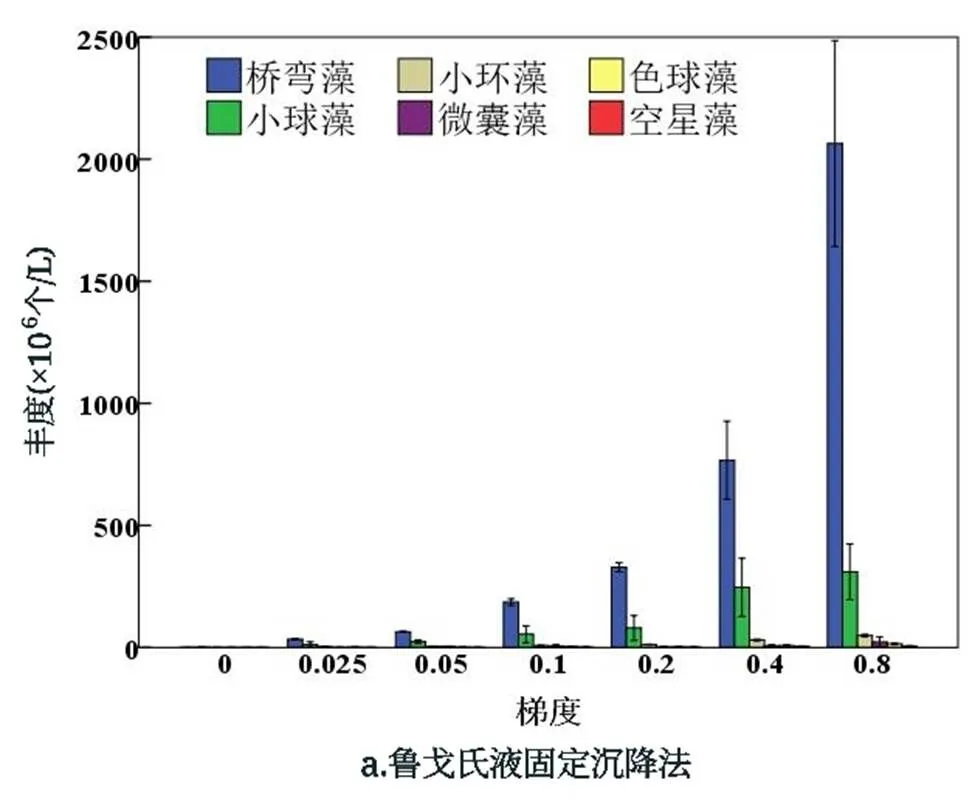
2.3 浮游植物稀释梯度相关性比较分析
从两种方法的属水平上的99%相对丰度的浮游植物拟合结果来看(图8),对于小粒径的小球藻属(图8b),滤膜浓缩法较鲁戈沉降法稳定性高²抽滤= 0.939>²沉淀=0.930,藻密度大.对于群体型和大型浮游植物微囊藻(图8d)及空星藻(图8f),滤膜浓缩法鉴定出的藻密度较鲁戈沉降法大.对于粒径较大的桥弯藻(图8a)、小环藻(图8c)及色球藻(图8e)来说,两种方法鉴定出藻密度拟合方程斜率相差较小,即变化趋势基本一致,稳定性相差不大,但浓度较低时,利用滤膜浓缩法鉴定得到的藻密度更大,浓度较高时,利用鲁戈沉降法较好.对两种方法鉴定所得的浮游植物藻密度进行差异性分析显示,均无明显差异(>0.05),且显著正相关(表4).实际的浮游植物采集过程中,各类浮游植物混合在一起,无法进行分开采集,所以需从整体来分析比较两种方法.
根据两种方法不同梯度水样中总的藻密度,绘制出鲁戈氏液固定沉降法和滤膜浓缩法的梯度拟合线,拟合结果如图9所示.由图9可知,两种方法得到的拟合方程式的斜率相差不大,鲁戈氏液固定沉降法梯度拟合结果2沉淀=0.992,滤膜浓缩法梯度拟合结果2抽滤=0.959<2沉淀,因此利用鲁戈氏液固定沉降法进行浮游植物固定及鉴定,在浮游植物的个体及细胞数量方面比滤膜浓缩法更稳定,作出鲁戈氏液固定沉降法和滤膜浓缩法的藻密度差异性分析,分析结果如表4所示,差异的显著性=0.622> 0.05,即鲁戈氏液固定沉降法与滤膜浓缩法藻密度鉴定结果无显著性差异,并作出鲁戈氏液固定沉降法与滤膜浓缩法的相关性分析,结果见表4,2= 0.958(<0.01),两种方法得到的藻密度呈显著正相关关系,说明滤膜浓缩法在浮游植物固定及鉴定的个体和细胞数量方面也是可行的.且滤膜浓缩法所作拟合线位于鲁戈氏液固定沉降法上方,说明滤膜浓缩法鉴定出来的藻细胞较多,即滤膜浓缩法的细胞损失量较少,再结合差异性及相关性分析结果,得到使用滤膜浓缩法检测水体中的浮游植物生物量更为准确.
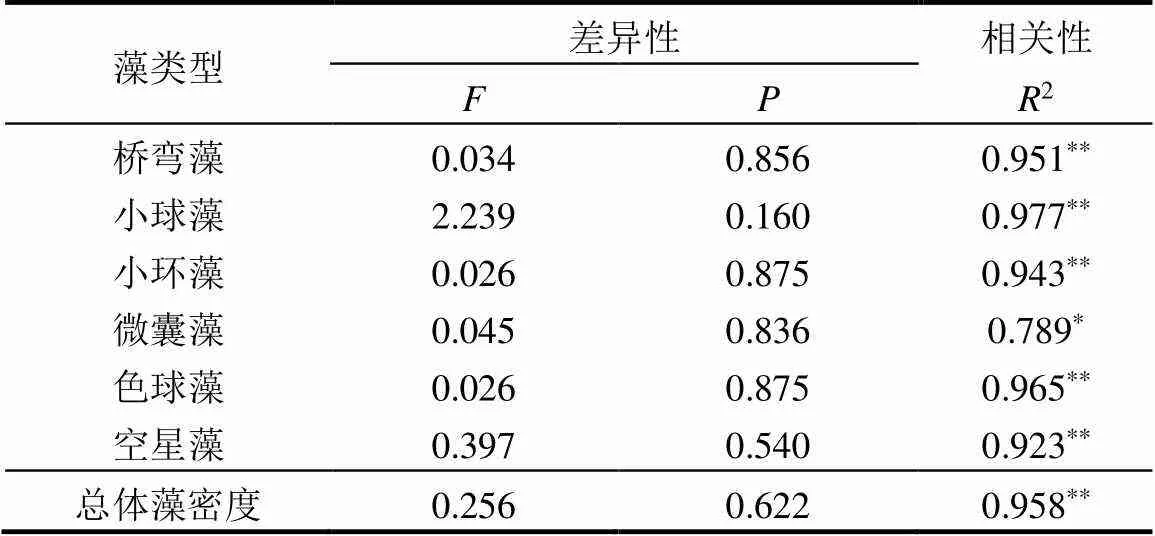
表4 两种方法藻密度差异性及相关性
注:**.在0.01级别(双尾),相关性显著;*.在0.05级别(双尾),相关性显著.
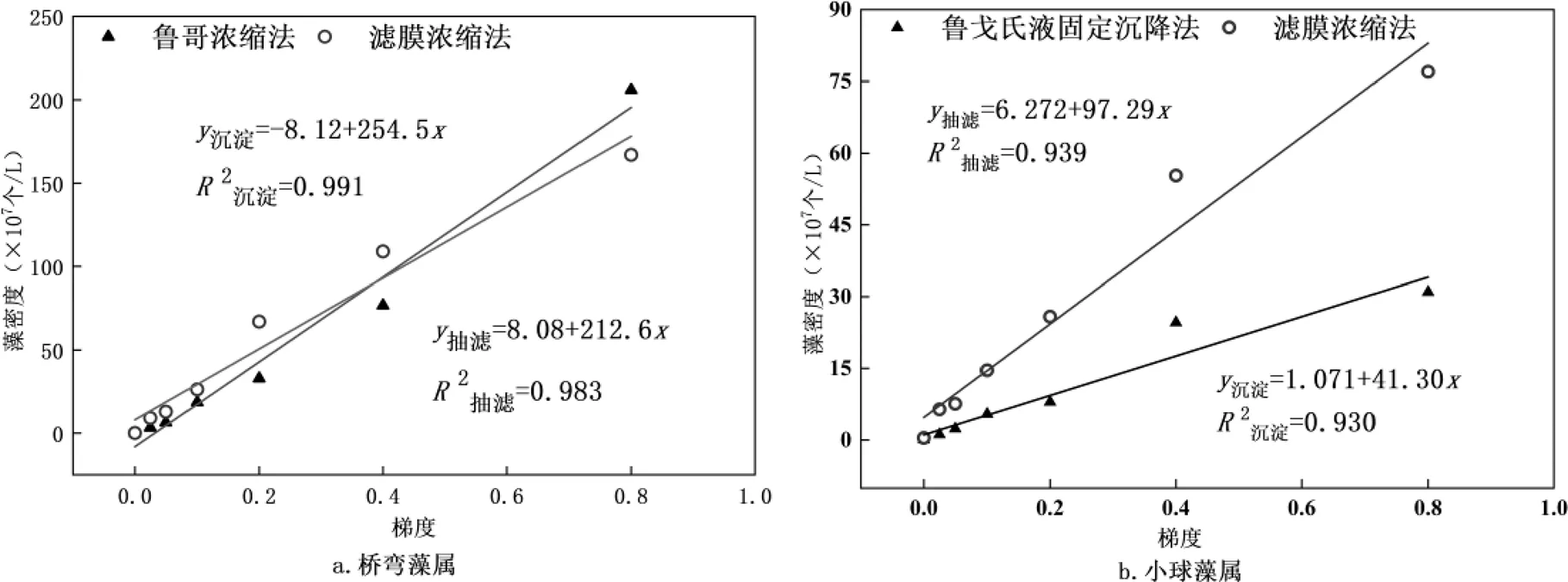
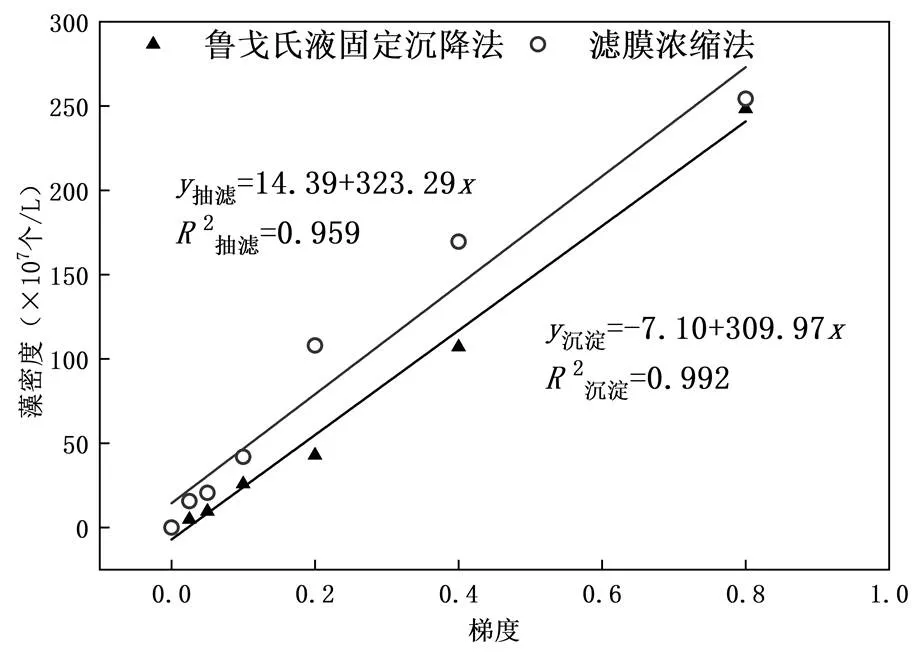
图9 总体藻密度线性拟合结果
3 讨论
3.1 滤膜浓缩法误差分析
本实验控制变量为浓度梯度,为了得到浓度有线性梯度变化的水样,需将水体中的藻培养至较大浓度,进行稀释,最后取水体积定为1L,但在实际的采样过程中,会面临不同富营养化程度的水域,其藻类含量也不一样,可根据其富营养化程度选择合适的采样体积[17].利用滤膜浓缩法采水浓缩时,采集水样后立即进行抽滤,并洗脱滤膜上的浮游植物,得到浓缩液,加入鲁戈氏液固定,带回镜检.Zarauz 等[18]比较分析了直接鉴定活体样品与加固定剂后再鉴定的样品在生物量上的差别,表明在温度很低的条件下,仅能保证浮游植物在几个小时之内不出现明显的细胞分解和衰亡.还可能会产生新浮游植物个体,这种动态变化将不可避免的使浮游植物的群落组成发生改变,导致样品无法反映环境的真实情况,因此采集水样后加入固定剂是比较重要的程序.固定剂不仅会杀死浮游植物并染色,而且在样品浓缩沉淀过程时,增大浮游植物重量,帮助排出可能保留在特定生物的液泡中的气体,更利于细胞沉淀[17].所以即使使用滤膜浓缩法,也要尽可能的缩短采水到加入固定剂的时间,否则会造成较大的实验误差.若不能及时进行镜检,还需加入甲醛保存[19].目前藻类鉴定仪器尚不完全成熟,显微镜计数法仍是浮游植物计数的主流方法,能直观、准确的得到浮游植物的藻密度及种类[20],对于滤膜浓缩法镜检,可根据实验室条件选择合适的仪器设备,本次实验选择新S300藻类智能鉴定计数仪进行鉴定[21],虽有误差,但考虑浮游植物的监测过程会经历多次重新抽样,且两种方法均采用此仪器,进行对比时可消除仪器带来的差异.
水体中的藻类直径基本大于2μm[22],所以使用0.45μm的滤膜过滤定能将大部分浮游植物截留在滤膜上,在定容后,将已经清洗的滤膜再用蒸馏水进行清洗搅拌,只检测出极个别细胞,说明之前的清洗比较彻底.但是滤膜更换过多,藻细胞会随滤膜流失更多.聚集在滤膜上的浮游植物清洗下来后,为防止凝在一起,加入鲁戈后必须摇匀使其分散并充分固定,鉴定之前需重新摇匀.Paxinos等[23]曾改进 Utermhl[6]的静置沉降浓缩为压滤浓缩,结果与Utermhl 沉降浓缩结果具有很好的相关性(2= 0.98),但水样中没有加入鲁戈试剂进行固定,浓缩过程需2h,所以浮游植物结构会受到影响,产生误差.而滤膜浓缩法从样品处理到加入鲁戈试剂固定的过程只经历10min左右,浮游植物群落结构变化不大,且与鲁戈氏液固定沉降法有很好的相关性(2= 0.958).
3.2 滤膜浓缩法与鲁戈氏液固定沉降法差异分析
鲁戈氏液固定沉降法沉淀时间与浮游植物形态、大小和生理状态有关,也与沉淀器的深度及介质的温度有关,沉淀时间越长,残留在上清液中的浮游植物数量越少,一般不少于24h[24].虹吸流速过大会造成水分子与藻体之间的黏连性变大,造成扰动或直接将底部浮游植物吸走,所以虹吸流速不能超过150mL/min,吸至澄清液1/3时降低流速到10~ 20mL/min[25].所以方法历时长,且对沉淀环境和实验人员的实验操作要求严格[26].在野外采样时,不仅要携带大量水体样品,而且难以进行沉淀,又进一步拉长了时间,最终对实验进度和结果造成影响.而滤膜浓缩法时间取决于抽滤的样品数,一个样品只需十几分钟,极大的缩短了浓缩时间,满足水质监测对数据时效性的要求.抽滤过程对环境要求小,避免了实验人员专业水平等因素影响.
鲁戈氏液固定沉降法作为国内通用方法,可作为判断滤膜浓缩法是否可行的标准.实验结果显示出两种方法裸藻门丰度存在显著差异,且有两属种类不一致,但其密度较小,考虑整个实验经历 3 次重新抽样:从母液中随机取浮游植物水样进行稀释;从样品中取0.1mL 计数;从计数框选择观察的视野面积,造成实验误差,说明滤膜浓缩法在浮游植物种类鉴定方面是可行的[14].鉴定结果中空白样中含有藻分析可能是计数框残留或采样瓶残留的浮游植物个体.
对比拟合效果,整体上两种方法斜率相差较小,且滤膜浓缩法得到的藻密度大于鲁戈氏液固定沉降法,分析可能是鲁戈氏液固定沉降法样品经过多次转移,上清液中及沉淀器壁流失的浮游植物较多造成[9].但从99%相对丰度上的属水平的物种拟合效果来看,不同藻属利用两种方法达到的效果不一致,分析可能是不同属藻类的大小、形态及生理状态不一致导致.小球藻等粒径较小的浮游植物在沉淀时容易附着于沉淀器底部或壁,也会因重力太小,而造成沉淀不充分,虹吸时被抽走造成损失.微囊藻等大型藻类在水样中的分布不均匀[27],用两种方法鉴定结果会因此产生误差,滤膜法在清洗滤膜过程中,微囊藻等群体浮游植物更容易清洗,损失量会较少.所以滤膜浓缩法对较小粒径和群体浮游植物的固定浓缩更优.对于较大的桥弯藻、色球藻及小环藻,两种方法鉴定结果的藻密度差异不显著,其中浓度较低时滤膜浓缩法鉴定出藻密度较大,但在浮游植物浓度高时,生物自身的截留作用强,甚至会阻塞滤孔,需更换多张滤膜,更换数量越多,滞留的浮游植物越多.冲洗时,藻和杂质越多,越难以清洗干净,导致更多的浮游植物损失,计数时,杂质与藻会产生重叠,出现计数误差,所以滤膜浓缩法鉴定粒径较大的浮游植物损失量可能会大于鲁戈试液固定沉降法的损失量.
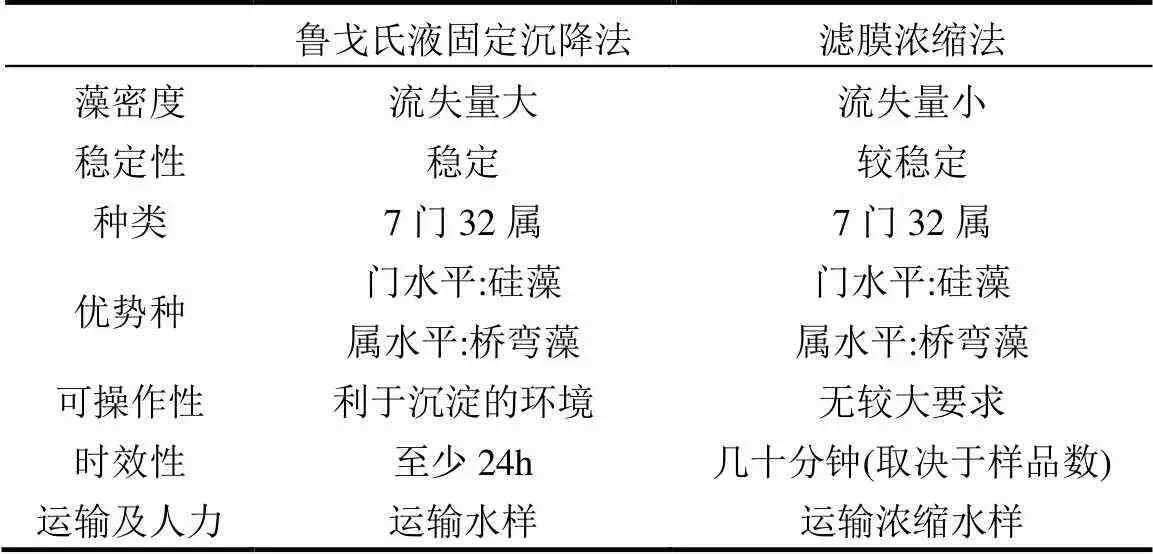
表5 两种方法可靠性对比
由以上对比分析总结如表5所示,滤膜浓缩法细胞损失较小,受环境干扰程度小,设备简单,成本低廉,效率高,实验时间短,且消耗的人力及运输成本较小,实验过程具有可操作性,其实验数据具有准确性.但当环境条件较好时,鲁戈氏液固定沉降法更加稳定,但两种方法在藻体数量多时,小型藻容易被不透明杂质遮挡,或附着于腐殖质上,造成镜检误差.所以没有一种采样浓缩方法能满足所有浮游植物的研究需要.我们可以根据不同的实验环境和要求选取不同的方法进行样品处理,对于野外不同程度富营养化水体的监测,也需要设计实验进行现场监测后得到方法的适用性.
4 结论
4.1 鲁戈氏液固定沉降法与滤膜浓缩法均鉴定出7门,32属,滤膜浓缩法鉴定出的浮游植物种类较多,两种方法不同梯度上所鉴定出的浮游植物种类数无明显差异(>0.05),浮游植物种类鉴定方面,利用滤膜浓缩法比鲁戈氏液固定沉降法更优.
4.2 总体上,滤膜浓缩法标准误差及波动程度比鲁戈氏液固定沉降法小,两种方法门水平上的丰度进行差异性分析结果除裸藻门(=0.018<0.05)外均无明显差异,在门水平上看,滤膜浓缩法对浮游植物物种丰富度的鉴定上是可行的.属水平上相对丰度99%以内的藻属进行差异性分析,显著性>0.05,均无明显差异,在属水平上看,滤膜浓缩法对浮游植物物种丰富度的鉴定上是可行的.
4.3 同一梯度下,总体上两种方法拟合方程斜率均相差不大,但总体上鲁戈氏液固定沉降法(沉淀²= 0.992)的拟合效果更好(2抽滤=0.959<2沉淀),却又无明显差异,并显著相关(2=0.958**,<0.01).且滤膜浓缩法鉴定出的浮游植物细胞密度更大,所以滤膜浓缩法更优.但对于属水平上的主要藻种,对相对丰度99%以内的属水平的浮游植物的拟合结果分析得到,两种方法所造成的损失量与浮游植物的粒径及浓度有关,不同种类的浮游植物在不同的浓度下适合采用不同的浓缩方法.
4.4 滤膜浓缩法受环境干扰程度小,设备简单,成本低廉,效率高,满足野外监测对时效性的要求,且消耗的人力及运输成本较小,实验过程具有可操作性.
[1] Manickam N, Bhavan P S, Santhanam P, et al. Phytoplankton biodiversity in the two perennial lakes of Coimbatore, Tamil Nadu, India [J]. Acta Ecologica Sinica, 2020,40(1):81-89.
[2] 严广寒,殷雪妍,汪 星,等.长江三口-西洞庭湖环境因子对浮游植物群落组的成影响[J]. 中国环境科学, 2019,39(6):2532-2540.
Yan G H, Yin X Y, Wang X, et al. Effects of environmental factors on the composition of phytoplankton community in Sankou of the Yangtze River and the Western Dongting Lake [J]. China Environmental Science, 2019,39(6):2532-2540.
[3] 董旭辉,羊向东,王 荣.长江中下游地区湖泊富营养化的硅藻指示性属种 [J]. 中国环境科学, 2006,26(5):570-574.
Dong X H, Yang X D, Wang R. Diatom indicative species of eutrophication of the lakes in the middle and lower reach regions of Yangtze River. [J]. China Environmental Science, 2006,26(5):570-574.
[4] 宋 伦,吴 景,李 楠,等.辽东湾潜在褐潮生物时空分布及环境关联[J]. 中国环境科学, 2018,38(8):3060-3071.
Song L, Wu J, Li L, et al. The temporal and spatial distribution of potential brown tide species and correlation analysis with environmental factors in Liaodong Bay [J]. China Environmental Science, 2018,38(8):3060-3071.
[5] 沈蓉蓉.长江下游干流浮游植物分布格局及其与环境因子相关性[D]. 上海:上海师范大学, 2019.
Shen R R. Distribution pattern of phytoplankton in the lower reaches of the Yangtze River and its correlation with environmental factors [D]. Shanghai: Shanghai Normal University, 2019.
[6] Utermhl H. Neue wege in der quantitativan erfassung des planktons (Mit besondere Berücksichtigung des Ultraplank-tons) [J]. Verh Int Verein Theor. Angew. Limnol., 1931,5:567-595.
[7] 钱奎梅,刘 霞,陈宇炜.淡水浮游植物计数与定量方法[J]. 湖泊科学, 2015,27(5):767-775.
Qian K M, Liu X, Chen Y W. A review on methods of cell enumeration and quantification of freshwater phytoplankton [J]. Journal of Lake Sciences, 2015,27(5):767-775.
[8] Lund J W G, Kipling C, Le Cren ED. The inverted microscope method of estimating algal numbers a-nd the statistical basis of estimations by counting [J]. Hydrobiologia, 1958,11(2):143-170.
[9] 路晓锋,林 青,韦雪柠,等.浮游植物样品的前处理优化及计数方法研究[J]. 中国环保产业, 2018,(9):53-57.
Lu X F, Lin Q, Wei X N, et al. Study on optimization of pretreatment of phytoplankton samples and counting [J]. China Environmental Protection Industry, 2018,(9):53-57.
[10] 李开枝,柯志新,李 刚,等.热带东北印度洋海域管水母类的群落结构特征[J]. 海洋学报(中文版), 2014,36(8):72-81.
Li K Z, Ke Z X, Li G, et al. Community structure of siphonophores in the tropical northeast Indian Ocean [J]. Acta Oceanologica Sinica, 2014,36(8):72-81.
[11] 陈学超,黄 瑛,穆希岩,等.夏季和冬季南黄海浮游动物分布特征[J]. 中国海洋大学学报(自然科学版), 2018,48(S1):50-56.
Chen X C, Huang Y, Mu X Y, et al. Distribution Characteristics of Zooplankton in the Southern Yellow Sea in Summer and Winter [J]. Periodical of Ocean University of China, 2018,48(S1):50-56.
[12] 陈 坤,张前前,史海燕,等.浮游植物计数方法比较研究[J]. 海洋环境科学, 2007,26(4):383-385.
Chen K, Zhang Q Q, Shi H Y, et al. Calibration of phytoplankton numeration according to Uterm(o)hl method [J]. Marine Environmental Science, 2007,26(4):383-385.
[13] 章宗涉,黄祥飞.淡水浮游生物调查规范[M]. 北京:科学出版社, 1991:339-344.
Zhang Z S, Huang X F. Specifications for freshwater plankton surveys [M]. Beijing: Science Press, 1991:339-344.
[14] 胡 权,王志红.实验室常用藻类检测方法的最优化研究[J]. 广东化工, 2015,42(100):152-153.
Hu Q, Wang Z H. Study on the Optimization of Common Laboratory Algae Detection Method [J]. Guangdong Chemical Industry, 2015, 42(100):152-153.
[15] 董正臻,董振芳,丁德文.快速测定藻类生物量的方法探讨[J]. 海洋科学, 2004,28(11):1-2.
Dong Z Z, Dong Z F, Ding D W. A method of quick determination of algal biomass [J]. marine science, 2004,28(11):1-2.
[16] Sandgren C, Robinson J. A stratified sampling approach to compensating for non-random sedimentation of phytoplankton cells in inverted microscope settling chambers [J]. British Phycological Bulletin, 2016,19(1):67-72.
[17] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:525-644.
State Environmental Protection Administration. Analysis of Water and Wastewater monitoring methods [M]. 4th Edition. Beijing: China Environmental Science Press, 2002:525-644.
[18] Zarauz L, Irigoien X. Effects of Lugol's fixation on the size structure of natural nano-microplankton samples,analyzed by means of an automatic counting method. Journal of Plankton Research, 2008,30(11):1297-1303.
[19] 郭 杰,王 珂,段辛斌,等.长江荆江段浮游生物群落结构特征及其与环境因子的关系[J]. 长江流域资源与环境, 2020,29(9):1954-1964.
Guo J, Wang K, Duan X B, et al. Characteristics of plankton community and its relationships with environmental factors in the Jingjiang Reach of the Yangtze River [J]. Resources and Environment in the Yangtze Basin, 2020,29(9):1954-1964.
[20] Montagnes D J S, Berges J A, Harrison PJ, et al. Estimating carbon, nitrogen, protein, and chlorophyll a from volume in marine phytoplankton. Limnology and Oceanography, 1994,39(5):1044-1060.
[21] 崔玉洁.三峡水库香溪河藻类生长敏感生态动力学过程及其模拟[D]. 武汉:武汉大学, 2017.
Cui Y J. The sensitive ecological dynamic processes and their simulations algal growth of Xiangxi Bay in Three Gorges Reservoir [D]. Wuhan: Wuhan University, 2017.
[22] 潘绘竹.黄渤海海域几种典型双壳贝类对浮游植物的摄食规律研究[D]. 广州:暨南大学, 2020.
Pan Y Z, Study on feeding selectivity of different phytoplankton assemblages by several typical bivalve species in the Yellow Sea and Bohai Sea [D]. Guangzhou: Jinan University, 2020.
[23] Paxinos R, Mitchell J G. A rapid utermhl method for estimating algal numbers. Journal of Plankton R-esearch, 2000,22(12):2255-2262.
[24] Mullin M M, Sloan P R, Eppley R W. Relationship between carbon content, cell volume, and area in phytoplankton. Limnology and Oceanography, 1966,11(2):307-311.
[25] 罗丛强,王素钦,张亚文,等.沉降时间、抽滤速率对浮游植物定量数据影响的探讨[J]. 环境生态学, 2020,2(7):48-51.
Luo C Q, Wang S Q, Zhang Y W, et al. The effects of sedimentation time and filtration rate on phytoplankton quantitative data [J]. Environmental Ecology, 2020,2(7):48-51.
[26] 金相灿,屠清瑛.湖泊富营养化调查规范[M]. 2版.北京:中国环境科学出版社, 1990:239-245.
Jin X C, Tu Q Y. The standard methods in lake eutrophication investigation [M]. 2nd edition. Beijing: China Environmental Science Press, 1990:239-245.
[27] 赵洋甬,马静军,肖国起.微囊藻细胞计数法研究[J]. 福建分析测试, 2010,19(3):76-78.
Zhao Y Y, Ma J J, Xiao G Q. Study on the test for microcystis cells counting [J]. Fujian Analysis & Testing, 2010,19(3):76-78.
Reliability analysis of a method to rapidly concentrate and fix phytoplankton.
LI Ya-li1, YANG Zheng-jian1,2*, TIAN Pan1, LIU Yi1, WANG Cong-feng1, JI Dao-bin1, LIU De-fu2
(1.Hubei Field Observation and Scientific Research Stations for Water Ecosystem in Three Gorges Reservoir, China Three Gorges University, Yichang 443002, China;2.Hubei Key Laboratory of Ecological Restoration of River-lakesand Algal Utilization, Hubei University of Technology, Wuhan 430068, China)., 2021,41(9):4300~4309
In order to verify the reliability of a membrane concentration method to rapidly concentrate and fixe phytoplankton in the field, the "Lugol's solution fixed sedimentation method (LSM)" and "membrane concentration method (MCM)" were comparatively used here to authenticate different phytoplankton samples. The results show that: (1) 7 phyla and 32 genera were both identified by the two method, but using the MCM could authenticate more phytoplankton species than the LSM method; (2) There was no significant difference not only in phytoplankton abundance between the two methods except(<0.05) at the phylum level (>0.05), but also in phytoplankton relative abundance within 99% at the genus level (>0.05). Which meant that, at the phylum and genus levels, the MCM was feasible to identify the phytoplankton abundance; (3) There was no significant difference in the slope of fitting equation of different algae biomass gradients (>0.05), and they showed a high correlation coefficient (2=0.958,<0.01), however, algal biomass of the MCM seemed to be a little larger. On a conclusion, the results of the MCM was consistent with the LSM, and the MCM had more advantages in less environmental condition requirement, easier for field monitoring, and save time.
Lugol's solution fixed sedimentation method;membrane concentration method;phytoplankton species;species abundance;linear fitting
X52,X171.5
A
1000-6923(2021)09-4300-10
李亚莉(1997-),女,湖北恩施人,硕士研究生,主要研究方向为生态水利.发表论文2篇.
2021-01-22
国家自然科学基金项目(51879099、51779128和51909135)
* 责任作者, 教授, yangzj1984@ctgu.edu.cn

