蛋白质乙酰化修饰在运动改善胰岛素抵抗中的作用研究进展
梁德欢 牛燕媚
天津医科大学医学技术学院康复医学系(天津300070)
胰岛素抵抗(insulin resistance,IR)是指机体组织对胰岛素敏感性降低,IR 是肥胖、2 型糖尿病、高脂血症等代谢性疾病的共同病理生理学基础。乙酰化修饰是一种常见的蛋白质翻译后修饰(post-translation⁃al modification,PTM),参与细胞内转录、代谢、信号传导、应激反应、蛋白质水解、细胞凋亡等过程[1]。近些年来,蛋白乙酰化在代谢中的重要作用逐渐明朗,有研究提出IR 可能与胰岛素靶器官(如骨骼肌、肝脏、脂肪组织)的乙酰化失调密切相关[2]。运动是治疗代谢性疾病的有效手段,可调节机体能量代谢并促使其产生适应性改变[3]。既往研究发现,运动通过调控细胞内去乙酰化酶表达和重要蛋白质乙酰化水平来影响机体糖、脂代谢[3,4],提示蛋白质乙酰化修饰在运动改善机体IR中发挥重要作用。
1 蛋白质乙酰化修饰
蛋白质乙酰化是指把乙酰CoA的乙酰基团转移至蛋白质赖氨酸残基上,组蛋白和其他蛋白均可发生乙酰化修饰。组蛋白乙酰化是一个动态可逆的过程,由组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)调节。HATs催化乙酰基团与赖氨酸共价连接,中和组蛋白的正电荷,减弱其与DNA 的静电相互作用,从而使染色质处于开放状态,有利于转录因子和RNA 聚合酶与DNA特定序列结合,激活基因转录;反之,HDACs催化去除乙酰基,使染色体结构紧密,从而抑制基因转录[5]。在哺乳动物中,HATs 主要包括GNAT 家族、CBP/p300 家族和MYST 家族[6];HDACs 分为Zn2+依赖性HDAC(histone deacetylase)家族[7]和NAD+依赖性Sir⁃tuin(SIRT)家族[8],前者包括Ⅰ型(HDAC1/2/3/8)、Ⅱa 型(HDAC4/5/7/9)、Ⅱb 型(HDAC6/10)、Ⅳ型(HDAC11),后者包括SIRT1-7 蛋白,又称Ⅲ型HDACs。组蛋白乙酰化是重要的表观调控机制之一,细胞通过维持组蛋白乙酰化状态来上调基因转录活性,进而激活糖、脂代谢基因表达。
除组蛋白外,其他蛋白也能进行乙酰化修饰。乙酰化既能调节代谢有关转录因子,如过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome prolifera⁃tor-activated receptor γ coactivator 1α,PGC-1α[9,10]),还能特异性调节糖酵解、糖异生、三羧酸循环和脂肪酸氧化等能量代谢途径中的多种酶类[11],进而对细胞代谢活动进行调控。此外,HATs 和HDACs 还可改变代谢相关信号通路,如胰岛素信号通路[2]、自噬相关通路[12],进而调节营养物质的感受和细胞自噬。总之,蛋白乙酰化可调节细胞内葡萄糖、脂质、氨基酸的代谢活动并维持代谢稳态,故调控蛋白乙酰化水平对治疗代谢型疾病具有重要意义。
2 运动对蛋白质乙酰化的影响
机体会对运动刺激产生适应,并表现为代谢表型的改变[3]。骨骼肌是人体最大的代谢器官,具有高度可塑性,研究表明运动可以调节细胞内多种信号通路,促进骨骼肌的能量代谢并改善IR[13,14]。乙酰化修饰作为重要的蛋白质翻译后修饰之一,可能参与骨骼肌细胞对运动的代谢适应[15]。运动对蛋白乙酰化修饰的影响主要表现为两方面:首先,运动会改变细胞内组蛋白乙酰化水平。过去研究发现运动引起骨骼肌细胞组蛋白H3 赖氨酸9、14 位点(H3K9/14)和赖氨酸36 位点(H3K36)乙酰化增加[16,17]。最新研究对骨骼肌进行GO(Gene Ontology)分析,包括参与肌肉生长、应激反应、新陈代谢等生命活动的基因,发现耐力训练后组蛋白H3乙酰化水平上调[18]。其次,运动还会改变其他蛋白的乙酰化水平。运动时细胞内AMPK活性增强进而激活SIRT1,SIRT1 使PGC-1α发生去乙酰化作用而上调PGC-1α的活性,最终促进依赖PGC-1α的线粒体生物合成和线粒体复合体IV 活性[19]。此外,运动还可调节细胞内许多代谢酶如丙酮酸脱氢酶、酮戊二酸脱氢酶等的乙酰化水平,乙酰化修饰将影响这些代谢酶的活性或稳定性[20],从而对代谢活动进行调节。以上研究说明运动可以广泛促进组织细胞蛋白质发生乙酰化修饰。
虽然目前关于运动导致机体代谢相关基因转录水平改变的机制并不完全清楚,但已知HDACs 在此过程中具有重要作用。其中,Ⅱa 型HDACs 表达具有组织特异性,在骨骼肌和心肌等代谢旺盛的组织中表达水平较高[21],提示Ⅱa 型HDACs 与组织代谢密切相关。以Ⅱa 型HDACs 中的HDAC4/5 为例,运动可能通过以下两个途径调节组蛋白乙酰化。其一,运动会导致HDAC4/5从胞核转运到胞浆[17],这与钙-钙调素依赖性蛋白激酶(Ca/calmodulin-dependent protein kinase,CaMK)和腺苷活化蛋白激酶(AMP-activated pro⁃tein kinase,AMPK)激活有关。AMPK 和CaMK 活化导致Ⅱa 型HDACs 磷酸化,磷酸化的Ⅱa 型HDACs 再与协同蛋白14-3-3结合后被转运至胞浆,使得细胞乙酰化增加。其二,有氧运动可能通过泛素-蛋白酶体系统来增加骨骼肌HDAC4/5 的降解,但具体机制未明[22]。运动影响细胞内蛋白乙酰化的另一个例子是Sirtu⁃ins,研究发现运动训练可通过激活AMPK 调控SIRT1和SIRT3 表达,进而调节骨骼肌线粒体生物合成和氧化代谢[23]。SIRT1本身还能感受细胞内NAD+/NADH的水平变化,有氧运动导致细胞内NAD+含量增加,进而诱导SIRT1表达增加[24]。除骨骼肌外,运动还会影响肝脏、肾脏、脑、心肌等组织器官的乙酰化修饰[20,25-27],如跑台训练后大鼠海马体HATs 活性增加,HDACs 活性降低,进而改变其蛋白乙酰化水平[27]。值得注意的是,不同运动形式对蛋白乙酰化的影响也存在差异,即单次运动可以通过控制HAT/HDAC比例从而调控蛋白乙酰化水平,这种变化是较为短暂的。而长期规律运动对于蛋白质乙酰化的调控是一种持续的过程,因此对于机体的影响也较为稳定[27,28]。综上,运动可促进机体细胞内HATs 和HDACs 的平衡,通过影响蛋白质的乙酰化水平进一步调节代谢基因的表达[29,30]。
3 蛋白乙酰化在运动改善胰岛素抵抗中的作用
运动是临床治疗代谢性疾病的一种有效策略,常被用来预防和治疗IR和2型糖尿病[10]。许多研究表明运动能够改变机体糖、脂代谢的表达,调节组织细胞线粒体功能[31-33],可能与乙酰化修饰密切相关。有研究显示乙酰化并不直接调节骨骼肌胰岛素活性,而是通过转录机制间接调节[34]。因此,我们推测蛋白质乙酰化介导运动改善IR 的机制可能是蛋白乙酰化诱导葡萄糖代谢基因和线粒体功能相关基因的转录表达,并调节胰岛素信号通路,增加胰岛素敏感性(见图1)。
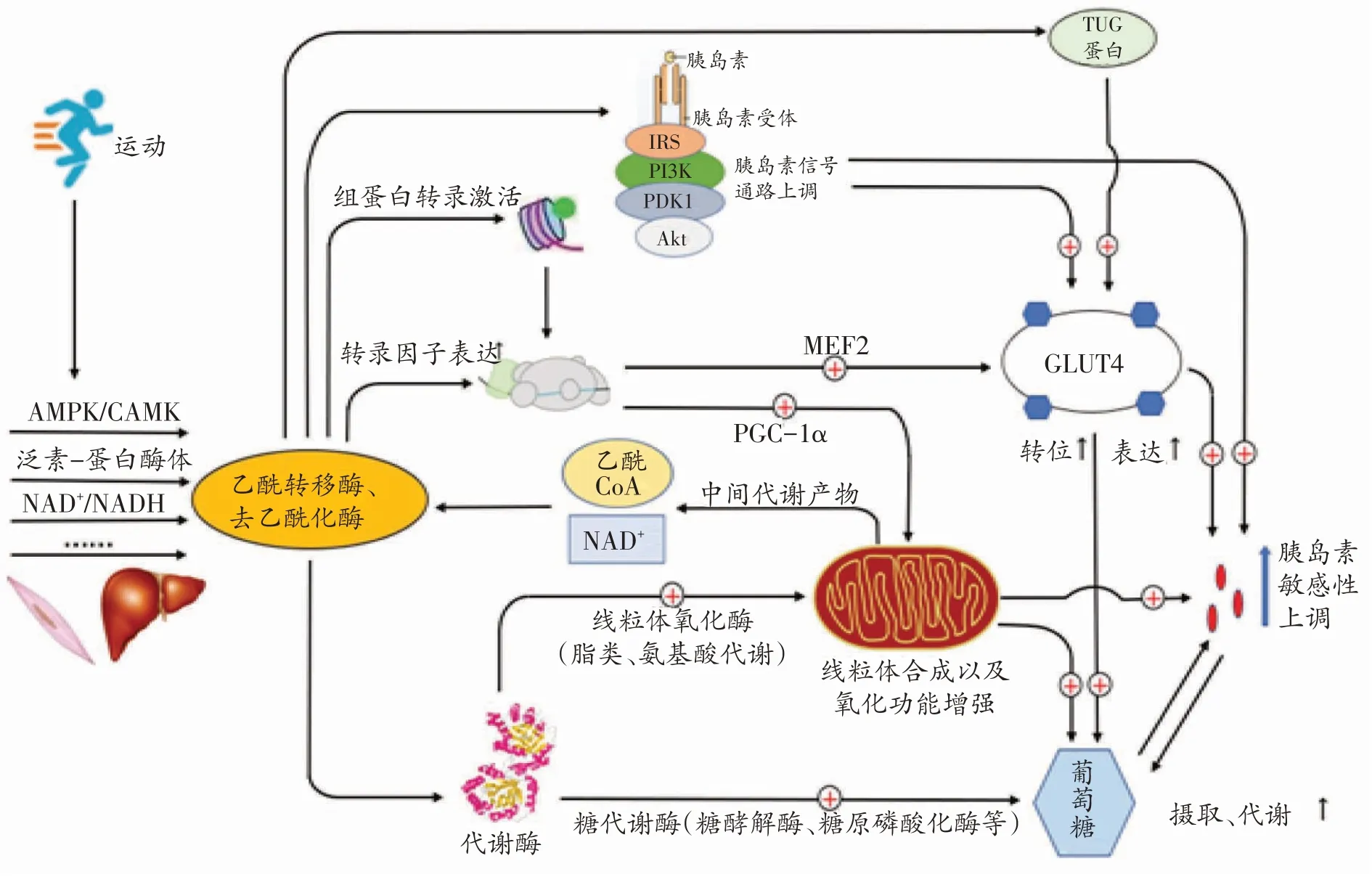
图1 蛋白乙酰化介导运动改善机体胰岛素抵抗的可能机制
3.1 蛋白乙酰化调控细胞葡萄糖摄取
葡萄糖跨膜转运和代谢是葡萄糖摄取的两个重要环节,蛋白质乙酰化通过改变这两个环节来调控葡萄糖摄取。葡萄糖转运蛋白4(glucose transporter 4,GLUT4)在葡萄糖转运中具有重要作用[14],静息状态下GLUT4位于细胞内,需要经过复杂的途径到达细胞膜,从而参与葡萄糖转运。TUG蛋白是GLUT4转位的调节因子之一,可动员GLUT4 从胞浆转位至胞膜。研究发现TUG蛋白乙酰化会促进GLUT4转位,加快葡萄糖摄取过程[35]。此外,许多研究均表明运动可抑制HDAC4/5,从而激活肌细胞增强因子2(myocyte enhancerbinding factor2,MEF2)并诱导GLUT4 转录[17,20,36]。具体过程为:运动激活AMPK/CaMK 而磷酸化HDAC4/5,使HDAC4/5 对MEF2 的抑制作用减弱,从而促进依赖MEF2的GLUT4基因表达。由于GLUT4是葡萄糖转运的重要载体,通过以上机制调控GLUT4 的转位和表达来改善机体糖代谢,可能是治疗IR的一个方向。
乙酰化修饰还可调控葡萄糖代谢酶活性,改变细胞葡萄糖代谢状态。乙酰化修饰可下调己糖激酶[37]、丙酮酸激酶[38]等代谢酶的活性,不利于葡萄糖分解。例如,组学分析发现丙酮酸激酶赖氨酸305 位点(K305)乙酰化,将通过增加其与底物的米氏常数(Km)而抑制酶活性[39]。糖原磷酸化酶乙酰化也会降低其活性[39],抑制糖原分解,促进糖原储存,降低血糖。此外,蛋白乙酰化还会抑制葡萄糖氧化,诱导糖酵解中间代谢物的积累,从而阻碍葡萄糖摄取[40]。上述研究提示,对葡萄糖代谢酶进行乙酰化调控将有利于改善葡萄糖摄入。
3.2 蛋白质乙酰化修饰调控线粒体功能
线粒体与细胞能量代谢密切相关,是葡萄糖、脂肪酸和氨基酸的重要代谢场所。研究发现心衰、糖尿病和肥胖患者线粒体功能紊乱,其线粒体蛋白乙酰化也明显增加[41,42],提示乙酰化修饰与线粒体功能密切相关。PGC-1α是线粒体功能的重要调节因子,IR患者骨骼肌中PGC-1α下调,可能与异常的乙酰化修饰有关[10]。有研究发现运动诱导机体SIRT1 表达增加,进而去除PGC-1α的乙酰基并使其激活[19,24,43]。PGC-1α可促进下游靶基因核呼吸因子(nuclear respiratory factor,NRF)表达,两者共同激活线粒体转录因子A(mito⁃chondrial transcription factor A,TFAM),进而调节线粒体的生物合成。反之,乙酰化酶GCN5(general con⁃trol of amino acid synthesis 5,GCN5)会抑制PGC-1α的活性[44]。因此,运动可通过促进PGC-1α乙酰化修饰来调节线粒体功能。
除直接影响线粒体合成,乙酰化修饰还可精细调控线粒体内代谢酶的表达[1,45]。2010年,Zhao等揭示了代谢酶乙酰化修饰对新陈代谢的调控具有重要意义[46]。SIRT3位于线粒体内,在线粒体代谢酶活性调节中发挥关键作用。Tsuda等发现心衰小鼠线粒体中SIRT3减少使代谢酶乙酰化增加并导致其活性降低,尤其是长链酰基CoA 脱氢酶、烯酰CoA 水合酶等脂肪酸氧化酶,说明线粒体蛋白乙酰化可能会减弱脂肪酸氧化[47]。Overmyer 等发现运动机体的氧化能力与骨骼肌能源选择和线粒体蛋白乙酰化两者有关,他们观察到高运动能力(HCR)小鼠在运动中消耗脂肪酸和支链氨基酸,低运动能力(LCR)小鼠主要消耗糖原和葡萄糖,而且在静息和运动状态下HCR 小鼠线粒体蛋白组乙酰化水平均降低[48]。蛋白乙酰化与细胞的营养和代谢状态之间密切相关,脂肪酸和氨基酸生成过多可诱导乙酰CoA 累积和蛋白乙酰化修饰改变[40],进而通过改变底物蛋白含量和胰岛素信号通路来降低胰岛素敏感性[49]。此外,研究还发现脂质代谢物积累会抑制胰岛素对机体葡萄糖摄入的促进作用,但不会影响运动或肌肉收缩对机体葡萄糖摄入的结果[10],提示运动可能是治疗IR的重要方式。以上研究表明,调节线粒体蛋白乙酰化水平有利于改善IR。
3.3 蛋白乙酰化调控胰岛素信号通路
胰岛素信号通路中的许多蛋白质均存在乙酰化位点[46],提示乙酰化修饰可能是调控胰岛素代谢的重要机制。胰岛素受体底物(insulin receptor substrate,IRS)在胰岛素调节葡萄糖代谢中具有重要作用,HDAC2和SIRT1分别调节IRS1和IRS2的乙酰化修饰,但是HDAC2 催化IRS1 去乙酰化而抑制其磷酸化[50],SIRT1 促进IRS2 磷酸化[51],因此IRS1 乙酰化抑制IR 而IRS2 乙酰化促进IR[2]。另外,有研究发现乙酰转移酶P300催化IRS1和IRS2乙酰化进而减少其磷酸化,破坏胰岛素信号传递[52],提示乙酰化调控具有复杂性。IRS和胰岛素受体酪氨酸激酶结合,将激活细胞内许多下游信号,包括磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)。PI3K 通路负责介导胰岛素对代谢的作用,维持糖、脂代谢稳态。该通路的蛋白激酶B(protein kinase B,PKB/Akt)和3-磷酸肌醇依赖性蛋白激酶1 (3-phosphoinositide-dependent protein ki⁃nase-1,PDK1)也有几个乙酰化位点[53],SIRT1 使Akt和PDK1 去乙酰化,再与磷脂酰肌醇三磷酸(phospha⁃tidylinositol(3,4,5)-trisphosphate,PIP3)相互作用,激活PI3K 通路[40]。综上,蛋白乙酰化修饰改变可影响胰岛素信号通路,改善胰岛素敏感性。
4 小结
蛋白质乙酰化水平与机体代谢紊乱相关联,近些年来因其在代谢性疾病发生中的作用而备受关注。许多研究发现运动影响蛋白质乙酰化修饰,提示蛋白质乙酰化在运动改善IR 中可能发挥作用。蛋白质乙酰化后可快速调控细胞葡萄糖摄入、线粒体功能及胰岛素信号通路中多种重要蛋白的活性或稳定性,对于维持葡萄糖稳态和胰岛素信号敏感性至关重要。虽然运动可能通过蛋白乙酰化修饰来改善IR,但其机制尚不明确。深入研究蛋白质乙酰化在运动改善IR 中的作用将加深人们对机体代谢调控的认识,为运动疗法在临床的广泛应用提供理论依据。

