中国苦草属(Vallisneria)植物萌发与生长的影响因素*
王 瑞,何 亮,张 萌,曹 特,张霄林,刘 颖,倪乐意,葛 刚,2
(1:南昌大学生命科学学院,南昌 330031) (2:南昌大学鄱阳湖环境与资源利用教育部重点实验室,南昌 330031) (3:南昌大学资源环境与化工学院,南昌 330031) (4:江西省环境保护科学研究院,南昌 330039) (5:中国科学院水生生物研究所,武汉 430072)
据《中国植物志》记载,我国苦草属(Vallisneria)植物有苦草(V.natans(Lour.) Hara)、刺苦草(V.spinulosaYan)、密刺苦草(V.denseserrulataMakino)3种,为沉水草本植物,雌雄异株,多生长于沟渠、池塘、河道、湖泊等淡水水体中[1]. 3个物种中苦草在我国分布最为广泛,产中东部和西南地区;密刺苦草主要分布于南部地区;刺苦草的分布范围最小,主要产自长江中下游地区[2].
我国苦草属3种植物都可以进行有性繁殖和无性克隆生长,花果期为7-11月,其中苦草对有性繁殖分配的资源最多;而密刺苦草和刺苦草对有性繁殖投入资源相对较少[2]. 密刺苦草为常绿多年生植物,地上部分可以越冬,刺苦草在冬季地上部分会死亡,依靠冬芽越冬;而苦草为一年生,产生种子后,植株会全部死亡[2-3]. 在生长期,3种植物都可以通过匍匐茎产生新的分株[4].
苦草属植物姿态优美,分布广,能够生长在从贫营养到富营养的各种水体中[5]. 因此被广泛应用于水质净化和水体生态修复[6-7]. 苦草属植物不仅能够净化水质、提高水体透明度[8],也为鱼、虾、蟹等水生动物提供食物来源[9],其中刺苦草的冬芽是许多候鸟的重要食物来源[10-11],因而在淡水生态系统中有非常重要的生态价值. 然而,由于人类生产、生活对众多淡水水体的扰动、污染,苦草属植物种群严重退化[12-13],引发水体生态功能退化. 在此背景下,梳理影响苦草属植物萌发和生长的主要影响因素,分析导致苦草属植物种群退化的原因,探究适宜苦草属植物萌发和生长的环境因子范围,对我国苦草属植物的保护和恢复有重要意义.
1 研究方法
1.1 文献收集及数据整理
已经有很多学者围绕苦草属植物的保护和恢复开展了大量的研究,为系统地总结影响苦草属植物萌发与生长的主要影响因素和影响机理提供了基础资料. 通过登陆中国知网、Web of Science两个数据库,以苦草、刺苦草、密刺苦草、Vallisnerianatans、Vallisneriaspinulosa、Vallisneriadenseserrulata为关键词进行文献检索,中国知网的检索时间为1980年1月1日-2020年2月10日,Web of Science的检索时间为1983年1月1日-2020年2月10日. 从检索到的文献中筛选出涉及苦草属3种植物种子萌发、冬芽萌发以及植株生长影响因素的相关文献,并对筛选出的文献引用的参考文献中可能相关的论文进行查阅,符合条件的也纳入后续分析. 同时由于部分作者也用V.spiralis、V.asiatica和V.gigantea来表述苦草(V.natans)[4],也收集了植物采集地点为国内的,用这3种拉丁名发表的文献. 由于在文献中3种苦草属植物的名字可能存在误用,这里主要以原作者给出的拉丁名为主要依据进行文献归类,但是当作者在文献中明确表述所用植物材料产冬芽时,则将其归为刺苦草[2, 4]. 文献筛选完成后,归纳总结影响苦草属植物繁殖体萌发、生长的影响因素. 然后根据数据的来源场所,分野外调查、室外实验和室内实验分别进行定性和定量分析. 定性分析主要是明确苦草属植物能够生存的环境因子范围,其能否生存的判断方法为:对于野外调查,已知环境条件下有或无目标植物的定性记录;对于控制实验,对比实验结束时的生物量是否大于或等于初始生物量. 定量分析是分别将不同文献中报道的环境因子与种子萌发率、冬芽萌发率和植株的相对生长率关系的数据整合在一起,分析苦草属植物种子萌发率、冬芽萌发率和植物相对生长率随环境因子变化的趋势. 对于只用图表示的数据,通过Engague Digitizer软件对文献中给出的环境因子和植物萌发、生长参数进行提取并转换为数字形式. 对于未报道植物相对生长率,但是给出初始和结束时植物生物量的文献,通过实验初始和结束时生物量计算植物的相对生长率,其公式为:
RGR=(ln(W2)-ln(W1))/t
(1)
式中,RGR为苦草相对生长率,g/(g·d);W1为苦草初始生物量,g;W2为苦草结束时生物量,g;t为实验周期,d[14].
1.2 统计分析
利用广义加性混合模型(generalized additive mixed models)分析环境因子与苦草属植物种子萌发率、冬芽萌发率和苦草相对生长率之间的关系. 在构建模型时,以种子萌发率、冬芽萌发率或苦草相对生长率为响应变量,以环境因子为自变量中的固定因子、来源文献为自变量中的随机因子(不同文献实验的条件不一致,类似于区组设计中的区组). 广义加性模型属于非参数模型的一种,不需要事先假定自变量和因变量之间符合某种特定关系,能应用非参数的方法检测数据结构,并找出其中的规律[15],因而适用于探索性寻找数据规律的分析. 广义加性混合模型采用R软件“mgcv”包的“gamm”函数进行构建[16],平滑函数选择默认的薄板样条平滑函数(thin plate regression spline),数据分布(family)选择高斯分布.
1.3 定性定量分析的说明
部分实验涉及多因子的交互作用,在进行定量数据分析时,没有考虑因子交互作用,分析某一特定环境因子对植物萌发和生长参数的影响时是假定其他环境因子是相对适宜的(即当有其他因子影响目标因子效应时,只选择其他因子水平中相对适宜植物萌发和生长的数据). 在定性分析时,为了采用尽可能多的数据来确定植物生长的环境因子范围,包括了多因子联合作用的数据,因此,当植物是由于多因子联合作用导致其不能存活时,在文中做出了相应的说明. 通过对数据分析发现,不同研究者调查或实验选择的环境因子范围差异较大,模型分析结果可能会受到部分研究结果的强烈影响,从而影响统计结果的准确性,因此在解读统计结果时需要结合图形进行更全面的理解. 同时,论文中涉及的植物生长环境因子范围是基于现有数据的结论,可能会随着更多研究的开展出现变化. 另外,该研究是基于不同来源的数据,分析苦草属植物种子萌发、冬芽萌发和植物生长的参数与环境因子的定性、定量关系,但是不同区域或不同生长环境下的植物种群耐受环境因子胁迫的能力会有差异,因而该研究基于案例综合分析的结果可能会高估,也可能会低估某一特定种群耐受环境胁迫的能力. 因此,在进行苦草属植物恢复时,如果没有种子、冬芽或种苗来源种群耐受环境因子胁迫能力的信息,可以在该研究的基础上选择相对保守的环境因子范围作为恢复的前置条件,从而保证引入的植物繁殖体能够正常萌发和生长.
2 结果与讨论
根据上文所述方法,筛选到符合条件的苦草文献55篇、刺苦草文献22篇、密刺苦草文献6篇,共涉及14个影响因素,其中24篇用于苦草、2篇用于刺苦草的定量分析.
2.1 苦草种子萌发的影响因素
从收集的文献来看,苦草种子萌发受到温度、光照强度、水深、基质条件、沉积物掩埋深度、储存方式等因素的影响.
许多植物种子存在休眠现象,解除种子休眠是种子萌发的前提. Xiao等[17]发现苦草种子可能存在休眠作用,经过10周的冷湿层积(4℃湿润保存)后,苦草种子萌发率显著增加. 因而利用种子恢复苦草时,需进行冷湿层积处理,打破休眠作用,提高种子萌发率. Li等[18]发现湖北省淤泥湖苦草属种子可能存在休眠-萌发的循环,种子萌发集中在每年的春季(3-5月),此期间未萌发的种子等到第2年的春季再次出现萌发高峰. 但是目前还不清楚这种现象是苦草适应特定的湖泊水文特征产生的还是具有广泛性,进一步研究解析此现象的机理对认识苦草种子萌发的调控机理具有重要的意义.
温度是影响苦草属植物种子萌发的关键因素[19]. 适宜的温度在提高种子吸水速率的同时,还能加强酶促反应和呼吸作用,促进能量储存物质的分解,保证其他生理活动的正常进行[20]. 定量分析结果表明,在10~20℃温度范围内,苦草种子萌发率随温度的升高而升高,超过20℃后,苦草萌发率随温度变化的趋势在不同研究之间出现差异(表1,图1A). 其中Ke等[21]的研究发现在20~35℃范围内苦草种子都保持较高的萌发率,达到80%以上;而由文辉等[22]则发现苦草种子在28℃时,相对于20℃,萌发率有所下降(图1A). 温度在影响苦草种子萌发率的同时,也影响种子的萌发历程. 在10~30℃温度范围内,随着温度升高,种子萌发时间提前、萌发历程缩短[22]. 尽管不同研究之间有差异,综合考虑上述研究结果,20~30℃日均温度是苦草种子萌发较为适宜的温度,在恢复苦草时,可以参照此温度范围撒播种子,保证苦草种子的快速萌发. 但是需注意的是上述研究所述的温度为培养室(箱)的恒定温度,自然情况下的温度会出现昼夜波动,与恒温培养箱有所不同.
光照作为植物生长发育的关键限制性因子,也是影响沉水植物种子萌发的重要因素[23]. Ke等[21]研究发现在有光条件下,各温度处理组苦草种子萌发率至少在60%以上;而在黑暗条件下苦草种子萌发率小于5%. Min等[24]也发现在1 m水深条件下苦草种子萌发率显著高于2 m水深,推测是深水区的弱光条件限制了苦草种子的萌发. 而季高华等[23]研究发现,苦草种子萌发的最佳光照强度约为0.09 μmol/(m2·s),种子萌发率达到100%;即便在黑暗条件下,苦草种子也能够发芽生长,萌发率达到85%,但叶片呈黄白色,叶绿素含量不断减少,生长状况极差. 由于苦草种子较小,存储的能量有限,在黑暗条件下萌发对苦草幼苗的生长是很不利的,笔者推测苦草种子萌发是需要一定光照的. 由于萌发实验前种子的处理(如浸泡后暴露在有光环境下)会影响实验结果,苦草种子是否能在黑暗条件下萌发还需要严格的实验验证.
基质条件也是影响苦草种子萌发的重要因素. 由文辉等[22]研究发现苦草种子在不同基质条件下萌发率为水+土(水淹没土壤)>土(湿润)>水. Cui等[25]发现在0~15.8 mg/L的氨氮浓度范围内,单位面积的苦草出苗数随水体氨氮浓度的增加呈先增加后下降的趋势,在2.0 mg/L的氨氮处理中出苗率最高. 基质中的生物也会对苦草种子萌发产生影响. Li等[18]发现苦草种子的萌发率与培养种子的水中藻类生物量呈显著正相关关系,推测这种促进作用可能来源于藻类细胞产生的胞外化学物质对种子的刺激. 韩翠敏等[26]发现苦草种子在太湖水中比贡湖水、自来水有较高的最终萌发率、较快的萌发速率和较短的萌发时间,也认为这种促进作用与太湖水中有相对较高藻类浓度有关.
苦草种子的萌发还与掩埋深度相关,掩埋会使种子处于黑暗环境,从而降低其萌发率[27]. 在室外实验条件下5 cm和10 cm的掩埋显著降低苦草种子的萌发率[17]. 室内实验同样发现随着掩埋深度的加大,苦草种子的萌发率会迅速下降(表1,图1B). 在掩埋层较厚时,即使种子能够萌发,萌发后的叶片短期内不能穿过掩埋层,种子内部营养物质消耗殆尽,也难以存活[28]. 因而,在利用种子恢复苦草时,应避免沉积物的掩埋.
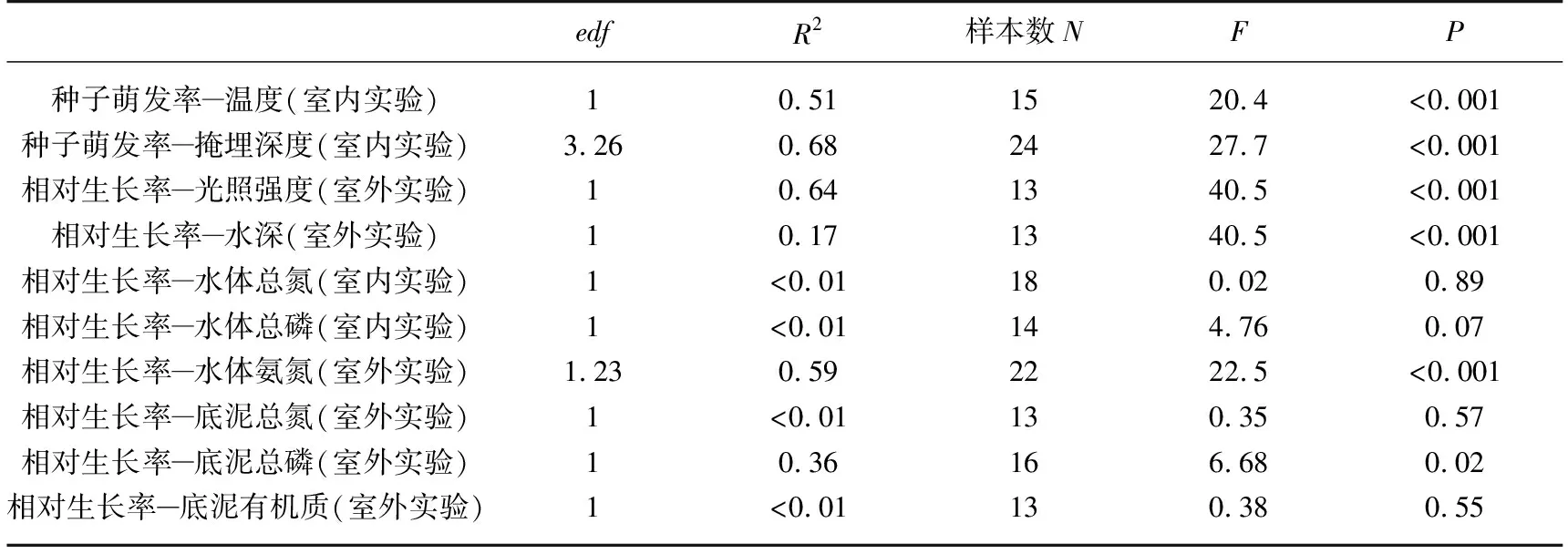
表1 环境因子与苦草种子萌发率和苦草相对生长率关系的广义加性混合模型统计结果

图1 苦草种子萌发率与温度和掩埋深度的关系(黑色实线为基于广义加性混合模型的预测值, 虚线范围为预测值的95%置信区间)Fig.1 The relationships between seed germination rate of Vallisneria natans and temperature and burial depth (The black solid lines were the predicted values based the generalized additive mixed models and the ranges between two black dashed lines were 95% confidence interval of the predicted values)
储存方式和时间也影响苦草种子的萌发. Zhao等[29]发现无论在4℃低温或自然温度,干燥或湿润状态,储存6个月的苦草种子的萌发率仍高达70%;但当储存时间超过12个月,除了4℃干燥保存或者放置在自然池塘中沙掩埋条件下保存的种子还能维持一定的萌发率外,其他储存条件下种子的萌发率都接近或等于0. 因此,如需长时间保存苦草种子应选择适当的储存方式,利用种子恢复苦草时也应尽量选择储存时间短的种子.
2.2 刺苦草种子萌发的影响因素
从收集的文献来看,刺苦草种子萌发主要受到温度、光照强度、基质条件、储存方式等因素的影响.
陈开宁等[30]发现刺苦草种子不存在休眠,采集果实时就已经有种子发芽,当年的种子在实验中也呈现较高的萌发率. 不同的是,Li等[18]发现在水中保存过冬的刺苦草种子,第二年春季萌发率比前一年显著提高,Xiao等[17]也发现10周的冷湿层积处理可以显著提高刺苦草种子的萌发率. 因而,刺苦草种子是否存在休眠还需进一步探讨.
温度是影响刺苦草种子萌发的重要因素. 通过定量分析发现,在10~30℃温度范围内,刺苦草种子萌发率随温度的增加呈先增加后降低的趋势(表2,图2A). 在上述温度范围内,高温或变温条件可促使刺苦草种子萌发时间提前、萌发历程缩短[30-31].
在无光条件下,刺苦草种子平均萌发率为13%,而自然光条件下种子萌发率提高至36%,比无光条件增加了177%,说明刺苦草种子萌发对光照有一定的需求[31].
刺苦草种子萌发的最佳基质条件为水+湖泥,在水中或水+沙基质中也能萌发,但萌发率都低于水+湖泥[30-31]. 与苦草种子类似,水中藻类存在也有利于刺苦草种子萌发[18].
未脱水、保存期短的刺苦草种子在20℃左右萌发率最高,达到57%. 干燥保存的刺苦草种子萌发率随储存时间的增加而下降,干燥保存1、2年的萌发率分别下降至36%、13%,干燥保存4年的种子几乎不萌发[30]. 因此,与苦草类似,利用种子恢复刺苦草时,也需尽量选择储存时间短的种子.
2.3 密刺苦草种子萌发的影响因素
涉及密刺苦草种子萌发的研究较少. 李洁琳等[32]发现密刺苦草种子萌发受到聚集效应的影响,种子聚集后,萌发率不变但萌发速率得到显著提高. Li等[18]发现密刺苦草种子与苦草和刺苦草种子类似,在春季萌发,其他季节进入休眠,水中藻类存在也对密刺苦草种子的萌发起促进作用.
2.4 刺苦草冬芽萌发的影响因素
从收集的文献来看,刺苦草冬芽的萌发主要受到温度、基质条件、光照、掩埋深度的影响.
温度和光照是影响刺苦草冬芽萌发的重要因素. 通过定量分析发现,在10~30℃温度范围内,刺苦草冬芽萌发率随温度的增加呈先增加后降低的趋势,在20℃附近冬芽萌发率最高(表2,图2B). 刺苦草冬芽萌发的适宜基质条件为水+湖泥[31],在湖泥+水为基质、20℃的恒温条件下刺苦草冬芽的发芽率最高可达90%±13%[30]. 刺苦草冬芽萌发无需光照刺激,冬芽存储的营养可以维持冬芽苗在短期无光条件下快速生长[33],因此可以帮助植株突破沉积物掩埋并逃避水体底层低光环境,相对于种子萌发的幼苗而言,更容易在不利条件下存活.

表2 环境因子与刺苦草种子和冬芽萌发率关系的广义加性混合模型统计结果

图2 刺苦草种子萌发率和冬芽萌发率与温度的关系(黑色实线为基于广义加性混合模型的预测值, 虚线范围为预测值的95%置信区间)Fig.2 The relationships between seed germination and tuber sprout rate of Vallisneria spinulosa and temperature (The black solid lines were the predicted values based the generalized additive mixed models and the ranges between two black dashed lines were 95% confidence interval of the predicted values)
刺苦草冬芽的萌发也受沉积物掩埋的影响. 冬芽萌发率随沉积物掩埋深度的增加而下降,当埋深为5、15、25 cm时,其萌发率分别为100%、73%、3%[5]. 因此,在利用冬芽进行刺苦草恢复时,可以直接撒播冬芽或将冬芽定植在沉积物表层,但当恢复区域有取食冬芽的水鸟活动时,需采取相应的防护措施,避免冬芽在恢复初期被水鸟取食,因为埋深越浅,冬芽被水鸟取食的概率越高[10-11].
2.5 苦草生长的影响因素
从收集的文献来看,目前的研究主要探讨了光照强度、水深、水体营养水平、底泥营养水平及底泥有机质含量对苦草生长的影响(表3). 其中人为引起的水位抬升和富营养化是引起苦草种群退化的主要原因.
2.5.1 光照强度、水深对苦草生长的影响 光照是沉水植物生长的主要限制因素之一[34-35]. 当湖泊水层底部的光照强度高于湖泊水面光强的1%~3%时,沉水植物才能正常生长[36]. 通过定性分析发现,苦草在大于2.5%自然光强范围内都可以存活(表3). 定量分析发现,在2.5%~40%范围内,苦草的相对生长率随光照强度的增加而升高,与2.5%光照强度相比,40%光照强度下苦草的相对生长率提高了3倍左右(表1,图3A). 李泽[37]测定了25℃条件下苦草的光合补偿点约为4.3 μmol/(m2·s),光饱和点为216 μmol/(m2·s). 这些结果表明苦草能够在较低的光照条件下生长,但是良好的光照条件是保证苦草生物量快速积累的必要条件. 然而,过高的光照强度也可能降低苦草的生长速率,李鹏善等[38]发现高光照条件下(晴天正午水下50 cm处光强为479 μmol/(m2·s))苦草的叶绿素含量、光合作用速率和生物量都小于低光照条件(晴天正午水下50 cm处光强为68.5 μmol/(m2·s))的处理. 在自然水体中,苦草可以分布在光照极强的浅水区域,因而过高的光照强度可能会降低苦草的生长速率,但不会导致苦草死亡. 笔者也发现有些浅水区的苦草叶片会变为紫红色,可能是苦草应对高光照胁迫的一种保护策略.
水深也是影响沉水植物生长、繁殖、分布的关键环境因子[39]. 水深增加能引起光照强度、光质、溶解氧、底泥化学性质等发生相应改变,对苦草的生长、克隆繁殖、光合色素和生态化学计量特征产生重要影响[40-41]. 洪水和水利工程引起的水位抬升(水深增加)是导致沉水植物退化的重要原因之一. 1998年的特大洪水导致了鄱阳湖水生植物地上部分大量毁灭,1999年鄱阳湖主要沉水植物苦草、黑藻(Hydrillaverticillata(Linn. f.) Royle)、竹叶眼子菜(PotamogetonwrightiiMorong)生物量远低于干扰前水平[42]. 而人为调节的高水位运行是洱海沉水植物退化的重要驱动因素[43],分布在深水区的苦草受到的威胁相对更大[44]. 从定性分析来看,目前室外实验条件下苦草生长最大水深为5.5 m,野外调查中苦草最大分布水深为5.6 m(表3). 定量分析发现,苦草的相对生长率随水深的增加呈显著下降趋势(表1,图3B). 但不同研究得出的苦草能够生长的最大水深存在差异,刁若贤等[45]发现2 m水深条件下苦草就不能正常生长,试验第35天植株全部死亡;而符辉等[46]发现在5.5 m水深条件下植株都能正常生长,7 m水深才出现负增长. 这种差异可能是实验开始时植物大小、水体透光性和植物表面附着藻类生物量不同造成的. 笔者认为,在光照条件充足的情况下,浅水湖泊的水深不是限制苦草生长的主要因子,苦草最大分布水深和适宜生长的水深主要取决于达到植物叶片表面的光照情况. 因而在研究水深对苦草生长的影响时,需要同时测量反映达到植物叶片表面光照情况的指标,如水体消光系数、水体透明度、植物表面附着藻类生物量,从而可以利用这些数据构建水深和光照的综合指标来确定植物的生长的水深阈值. 例如合田健等[47]结合水深和透明度提出了沉水植物群落的光补偿深度(即水下呼吸速率与光合速率平衡的深度)约为水下透明度的1.5倍,这与王海军[48]利用沉水植物生长关键期(3-6月)模型推导的结果比较接近(光补偿深度约为水下透明度的1.8倍). Liu等[49]发现在太湖,真光层深度/水深之比为0.57是沉水植物分布下限,两者之比达到0.8时,沉水植物能够良好生长,但是水体营养含量升高会使得这一比值增加,可能是高营养促进了植物表面附生生物的生长,进一步削弱了到达植物表面的光. 虽然目前没有针对苦草的光照和水深的综合指标作为恢复条件的参照,但是由于苦草能够耐受低光,可以认为苦草的分布下限与上述沉水植物群落层面的阈值是接近的.
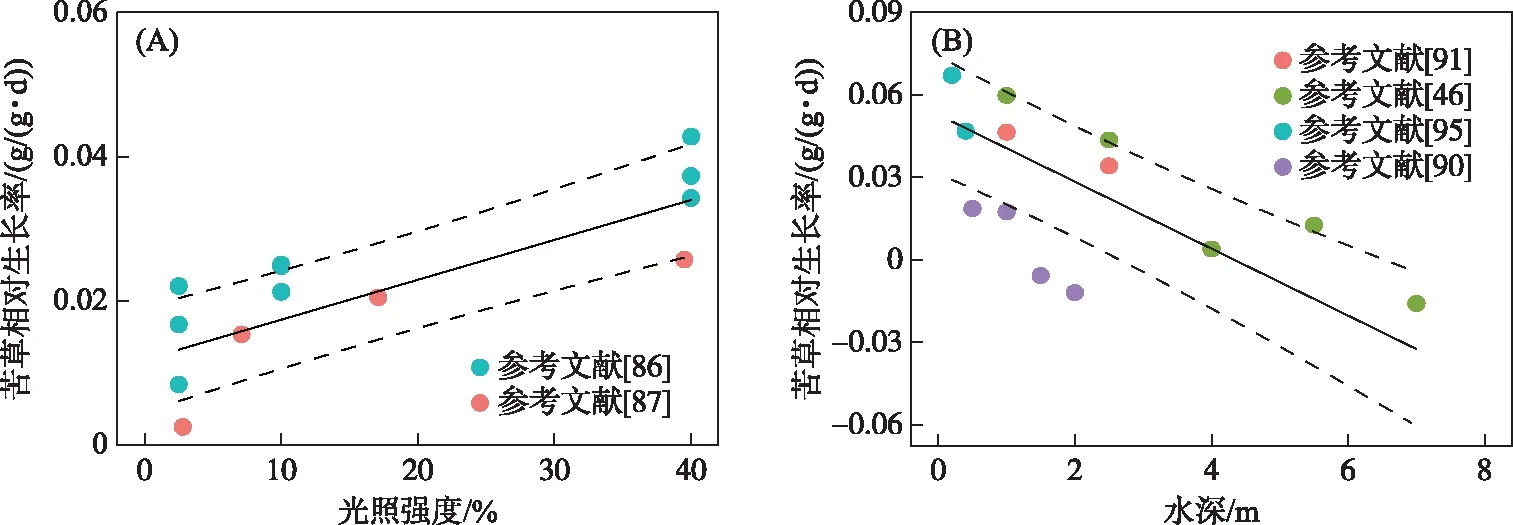
图3 苦草相对生长率与光照强度和水深的关系(黑色实线为基于广义加性混合模型的预测值, 虚线范围为预测值的95%置信区间)Fig.3 The relationships between relative growth rate of Vallisneria natans and light availability and water depth (The black solid lines were the predicted values based the generalized additive mixed models and the ranges between two black dashed lines were 95% confidence interval of the predicted values)
2.5.2 水体营养水平对苦草生长的影响 随着水体富营养化,我国大量湖泊水质恶化、蓝藻暴发,是水生植物,特别是沉水植物大面积消失的主要原因[50]. 随着水体富营养化,武汉东湖水生植被面积从1960s占全湖的83%下降到2014年的0.5%[51],滇池的水生植被面积从1950s-1960s的占全湖90%下降到1996年的1.8%[52],太湖五里湖在1970s-2002年,水生植物群落出现严重退化,浮游植物剧增,大型水生植物迅速消失,小河道和湖边池塘等浅水环境成为水生植物的最后避难所[53].

定性分析发现,在室内实验条件下,苦草植株在氮、磷浓度分别为16和0.8 mg/L时仍保持正生长(表3). 定量分析发现,苦草的相对生长率随水体总氮、总磷浓度的变化没有明显的规律(表1,图4A、4B). 但是,文明章等[60]研究发现苦草在富营养水平条件(TN=10 mg/L,TP=0.4 mg/L)下,植株出现负增长的情况,可能是水体氮、磷浓度升高引起附着藻类生物量增加导致的. 在室外实验条件下,苦草能够生存的水体氮、磷范围也较广,在水体氮、磷浓度分别为10.5和0.2 mg/L的营养条件下均可保持正常的生长(表3). 这些文献报道的苦草能够生长的水体总磷浓度远高于我国亚热带湖泊发生稳态转换的阈值(TP=0.08~0.12 mg/L)[61];总氮浓度也高于室外长期中宇宙实验中沉水植物出现退化的浓度(TN=3.5 mg/L)[62]. 这表明水体中高浓度的氮、磷导致苦草退化的主要原因可能是促进浮游植物和附着藻类生长引起的间接作用,而不是氮、磷的直接毒害. 在控制实验中,培养植物的水体水深一般较浅,水中悬浮物浓度通常较低,培养时间也短,在高浓度氮、磷条件下,即使浮游植物和附着藻类生物量增加,其遮光的强度和作用的时间也不足以严重抑制苦草的生长,难以准确地反映自然水体中氮、磷增加对苦草生长的影响. 在自然水体中,沉水植物能够生长的水体氮、磷浓度范围也与水深、透明度息息相关. 一般而言,水深越浅,透明度越高,沉水植物能够生长的氮、磷阈值越高,而水深越深、透明度越低,沉水植物能够生长的氮、磷阈值越低[61,63]. 因而,确定自然水体中苦草能够生长的水体氮、磷阈值,需要更多野外调查数据和长期近自然水深的室外实验的支持.
氨氮和硝态氮是水体中氮源存在的两种重要形态,二者的浓度多少、比例关系对水生植物的生理功能、生长发育有着显著的影响[64]. 由于吸收氨氮的能量消耗更小,苦草更加偏爱利用氨氮[65],而水体中过高浓度的氨氮会对苦草产生毒害作用. 通过定性分析发现,苦草植株在室外实验条件下耐受的最大氨氮浓度为4.5 mg/L(表3). 通过定量分析发现,苦草的相对生长率随水体氨氮浓度的增加呈下降的趋势(表1,图4C),表明高浓度氨氮对苦草有严重的抑制作用,但不同研究的结果得出的对苦草生长产生抑制作用的氨氮浓度值差别较大. Cao等[58]研究发现在富营养化水体中苦草保持良好生长的水体氨氮阀值上限为0.56 mg/L,如果水体氨氮浓度继续增加会引起苦草根状茎中溶解性碳水化合物浓度的减少,甚至对苦草的无性繁殖产生不利影响. Zhu等[66]研究发现在室外实验中当水体氨氮浓度超过8 mg/L时,对苦草的生长产生明显抑制作用,而0~2 mg/L的氨氮对苦草生长起促进作用. 上述研究结果差异较大的原因可能是实验植物所处的光照条件不一致,因为氨氮对沉水植物生长的促进-抑制依赖于植物生长环境光照的强弱[67]. 在自然水体中,高氨氮浓度的水体通常浮游植物和附着藻生物量也较高,水体悬浮物浓度一般也高于控制实验水体,这些水体中苦草面临低光照和高浓度氨氮的双重胁迫[68],因此,自然条件下氨氮对苦草产生抑制效应的浓度可能要低于大多数光照充足的控制实验.
2.5.3 底泥营养水平和底泥有机质对苦草生长的影响 底泥为水生植物提供锚定的基质及生长所需N、P、Fe、Mg等营养元素[69],底泥的理化性质(如含水量、密度、颗粒大小、pH、氧还原电位等)都与水生植物的生长密切相关[70],底泥中积累的有毒有害物质也会限制植物的生长[71]. 从收集的文献来看,现有的研究主要集中在底泥总氮、总磷、有机质含量对苦草生长的影响.
定性分析表明,苦草可以生长在从沙砾到黏土等各类基质上,在底泥总氮、总磷含量分别为0.26~6.08和0.01~1.60 g/kg的范围内长势良好(表3). 总得来说,肥沃的底泥更有利于苦草生长[72]. 从定量分析来看,室外实验中底泥总氮含量对苦草生长的影响没有明显的规律(表1,图4D),而苦草相对生长率随底泥总磷含量的增加而下降,但这主要是受到其中一个实验中几个高磷值的影响(表1,图4E). 高浓度的底泥磷会释放到水体中,导致浮游植物大量生长,影响植株光合作用正常进行[73]. 在自然水体中,Su等[74]调查了长江中下游浅水湖泊沉水植物的分布状况,发现在总磷含量处于0.14~0.85 g/kg的底泥中均有苦草生长. 这些研究结果表明,底泥中高含量的氮、磷一般也不会对苦草造成直接的毒害,底泥中高含量的氮、磷可能主要通过扩散到水体中,促进浮游植物和附着藻的生长,从而抑制苦草的生长.
在湖泊富营养化过程中,底泥中有机质含量升高,易产生厌氧环境,加上硫化物的毒害作用,沉水植物的根系生长会受到抑制,甚至引起植物死亡. 例如,Wu等[71]通过添加蔗糖用来增加基质有机质含量,发现基质的理化参数发生显著变化,包括pH降低、底泥氧化还原电位降低、间隙水硫化物含量增加等,这都不利于沉水植物的生长. 同时随有机质含量增加,底泥表面沉积物的密度和稳定性降低,底泥呈流体、半流体状态,易受到风浪、水压等外界因素的干扰,不利于沉水植物的定植[75-76]. 定性分析结果表明,在室外实验条件下,苦草在底泥有机质含量为8.1~130 g/kg的范围内均可正常生长(表3). 定量分析发现,在室外实验条件下底泥有机质含量对苦草生长的影响没有明显的规律(表1,图4F). 上述结果表明,苦草可以在有机质含量相对较高的底泥中正常生长,但更高含量的有机质是否会对苦草生长产生抑制作用仍需开展进一步的实验验证. 另外,底泥有机质含量增加,可能会降低苦草的锚定能力,导致其倒根漂浮[76],目前这方面的研究还较为缺乏,亟待深入. 另外,笔者收集的文献中,部分研究测定了反映实验底泥性质的参数,有利于进行定量的分析,但是除此之外的大部分研究仅对实验采用的底泥做了定性的描述,很难与其他研究进行对比分析. 因此建议在以后的研究中,尽量测定底泥基本的参数,如粒径分布、营养含量、密度、有机质含量等.

图4 苦草相对生长率与水体总氮、总磷和氨氮浓度及底泥总氮、总磷和有机质含量的关系 (黑色实线为基于广义加性混合模型的预测值,虚线范围为预测值的95%置信区间)Fig.4 The relationships between relative growth rate of Vallisneria natans and concentration of total nitrogen, total phosphorus and ammonia nitrogen in water column and the content of total nitrogen, total phosphorus and organic matter in sediment (The black solid lines were the predicted values based the generalized additive mixed models and the ranges between two black dashed lines were 95% confidence interval of the predicted)

表3 苦草正负生长的环境因子范围
2.6 刺苦草生长的影响因素
从收集的文献来看,刺苦草生长主要受到光照强度、水深、水体营养水平、底泥营养水平、动物牧食/扰动等因素的影响.
2.6.1 光照强度、水深对刺苦草生长的影响 定性分析发现,室外实验条件下10%的自然光强条件下刺苦草生长受到抑制(表4),在0.3~1.5 m水深范围刺苦草可以正常生长[77-78]. 在自然水体中,目前发现的刺苦草分布的最大水深为3.0 m[3]. 由于研究较少,在恢复实践中上述数据都只能作为参考,刺苦草能够生长、繁殖的光照和水深条件仍需更多的研究探讨.
2.6.2 水体营养水平对刺苦草生长的影响 定性分析发现,室外实验条件下在总氮、总磷浓度达到5.09和0.40 mg/L时刺苦草仍可以正常生长(表4);并且可以在水体氨氮、硝态氮浓度分别为1.06~8.69和0.18~9.1 mg/L的环境中保持正生长[79]. He等[80]研究发现0.65 mg/L氨氮对刺苦草的生长起促进作用,使植株的分株数、冬芽数增加,还可以延长植株地上部分在冬季的生长时间. 这些研究结果表明,与苦草相似,在实验条件下,刺苦草也可以在较高浓度的氮、磷水体中生长.
2.6.3 底泥营养水平对刺苦草生长的影响 定性分析发现,室外实验条件下,在底泥氮、磷、有机质(OM)含量分别为0.37~2.41、0.01~0.75、12.4~58.2 g/kg的范围内刺苦草可以正常生长(表4). 在室内实验条件下,刺苦草可以在氮、磷、有机质含量分别为0.88~28、0.74~19、1.5~26 g/kg的范围内正常生长(表4). 在自然水体中,袁龙义等[81]发现在底质肥沃的淤泥(TN=6.21 g/kg,TP=0.41 g/kg,OM=49 g/kg)中仍有刺苦草生长. 与苦草相似,Li等[70]发现刺苦草植株适应能力强,可以在从沙砾到黏土、淤泥等各类基质上生长,在肥沃的黏土中长势最好、生物量积累最高. 李宽意等[82]也发现在营养相对丰富的湖泥处理组中刺苦草的相对生长率要远高于岸泥处理组. 这些研究结果表明,刺苦草与苦草类似,也能够生长在多种类型和营养水平的底泥中.

表4 刺苦草正负生长的环境因子范围
2.6.4 生物因子对刺苦草生长的影响 螺类、鱼类作为淡水生态系统中重要的初级消费者,对刺苦草的生长、繁殖产生重要影响. 椭圆罗卜螺(RadixswinhoeiH. Adams)对刺苦草生物量的影响依赖于螺的密度和环境中附着藻的量,当螺类密度低、附着藻的量足够时,椭圆罗卜螺优先选食附着藻,促进刺苦草生长[83],而当螺类密度高、附着藻的量不足时则会转而取食刺苦草组织,对植物生长和繁殖产生不利影响[82, 84]. 不同密度黑鲫(CarassiuscarassiusLinn.)的存在均对刺苦草植株的生长产生不利影响,主要是因为鱼类的扰动与排泄引起水体营养水平和浊度升高,导致水体光照条件变差[85]. 因此,在苦草属植物恢复过程中应控制食草螺类、底栖鱼类的种群密度,减轻动物扰动与牧食.
2.7 密刺苦草生长的影响因素
从收集的文献来看,密刺苦草的生长主要受水深、水体营养水平、底泥营养水平等因素的影响(表5).
定性分析发现,在室外实验条件下,密刺苦草可以在水深、水体氨氮、水体总氮、水体总磷、底泥总氮、底泥总磷分别为1.0~2.2 m、0.5~26.3 mg/L、0.64~4.0 mg/L、0.04~0.40 mg/L、1.84~2.37 g/kg、1.21~1.46 g/kg的范围内正常生长(表5). 从收集的文献来看,目前的研究对密刺苦草的关注较少,而密刺苦草是常绿多年生植物,适宜用于湖泊生态修复,因而需要加强环境因子对密刺苦草生长影响的相关研究.

表5 密刺苦草正负生长的环境因子范围
3 结论
通过对文献的分析,发现现有的研究涉及了影响苦草属植物萌发和生长的多个因素,包括温度、光照强度、水深、水体营养水平、底泥营养水平、底泥有机质含量和生物因子等,为苦草属植物的保护和恢复提供了非常有价值的信息. 通过对这些信息的总结,获得的主要结论如下:(1)苦草种子在20~30℃都能保持较高的萌发率,适合在春季撒播;在萌发或撒播种子前需进行冷湿层积处理以打破种子休眠提高种子萌发率;在撒播种子时要防止沉积物的掩埋;干燥低温储藏和在自然水体中黑暗湿润保存是苦草种子的良好保存方法,储存时间越长种子萌发率越低,因而在恢复实践中尽量选择储存期短的种子. (2)苦草能够生长在较低光照环境中,但总体趋势表明苦草相对生长率随着光照强度的增加而升高,良好的光照可以保证苦草的快速生长;在浅水湖泊中,苦草能够生长的最大水深和适宜水深取决于水体透明度;低浓度氨氮可以促进苦草的生长,但随着氨氮浓度的继续增加,苦草相对生长率下降,而抑制苦草生长的氨氮阈值受植物所处的光环境的影响;水体和底泥氮、磷对苦草生长的抑制作用主要是通过间接影响,因此,在水体氮、磷浓度相对较高时,可以通过降低水位,生物操纵控制浮游植物和附着藻等方式改善苦草生长的光环境达到恢复苦草的目的. (3)刺苦草种子和冬芽在10~30℃均保持较高的萌发率,在20℃左右取得最大值;与苦草类似,水体和底泥中高含量氮、磷对刺苦草和密刺苦草生长的抑制作用主要是通过间接影响. (4)牧食和底栖鱼类扰动都不利于刺苦草的生长,在进行恢复时需要进行相应的措施防止动物牧食和扰动.
4 展望
尽管目前对我国苦草属植物种群退化的原因和苦草属植物萌发、生长与环境因子的关系有了一定的认识,但是仍然有一些不足,包括:(1)对实验物种鉴定不准确可能会使不同研究间结果的比较出现偏差,因而在以后的研究中要做到实验物种的准确鉴定. (2)3个物种中,对苦草的研究最多,对刺苦草和密刺苦草的研究偏少. 刺苦草的冬芽为一些越冬候鸟的重要食物,密刺苦草为多年生植物,可以在冬季保持较好的景观效果,两个物种都具有重要的应用价值. 因此,需要加强这两个物种的相关研究. (3)由于水体氮、磷对苦草生长的影响主要是通过间接作用,室内实验或短时间室外模拟实验难以准确反映自然水体中不同氮、磷浓度对苦草生长的影响. 因此,苦草能够生长的水体氮、磷阈值需要更多野外调查和长时间室外模拟实验来予以明确. (4)底泥性质对苦草属植物萌发和生长的研究以定性研究居多,各研究结果差异也较大,难以总结出底泥性质参数与苦草属植物萌发和生长的定量关系,因而需要加强底泥性质与苦草属植物萌发、生长的定量研究. (5)底泥性质与苦草属植物锚定能力之间关系的研究还较为缺乏,亟待加强. (6)苦草属植物适宜生长的水深研究应充分考虑水体透光性的影响,建立透明度、真光层深度或浊度/水深比值与苦草属植物生长的定量模型. (7)生物因子与非生物因子对苦草属植物萌发和生长的影响研究不平衡,生物因子也是决定苦草属植物萌发和生长的重要一环,在关注非生物因子对苦草属植物萌发和生长影响的同时,也需要加强生物因子对苦草属植物萌发和生长的影响研究.

