合成生物学研究中的微生物启动子工程策略
于慧敏,郑煜堃,杜岩,王苗苗,梁有向
(清华大学化学工程系,教育部工业生物催化重点实验室,北京 100084)
近年来,致力于对生物学元器件进行标准化设计构建,使其未来可以在新型人工生物系统中进行常规重复使用的合成生物学研究在全球范围内方兴未艾[1-2]。利用合成生物学理论与工具,对生物体尤其是微生物及其相关蛋白(酶)、基因元件与线路等,进行目标明确的设计、重组改造乃至重新合成,对于解决我国与国计民生相关的生物医药、材料、环境、能源等重大问题,实现绿色制造和可持续发展、实现大健康战略具有重要的理论意义和实践价值。
在合成生物学研究中,基因的精细表达调控是决定研究进程的关键因素;而对于原核微生物,影响基因表达水平的最重要因素则是决定RNA 聚合酶(RNA polymerase,RNAP)转录机器识别效率的基因启动子序列。不同种属微生物中的不同启动子序列决定了下游基因的表达强度及表达模式(组成型、诱导型),因此成为驱动基因表达、调控基因线路、赋能微生物功能、获得高产酶与高性能细胞工厂的合成生物学核心元件[3]。通过启动子工程策略对微生物启动子特征及功能、全新的基因诱导表达模式进行发掘与进化改造,使其响应不同的物理、化学信号,实现精细、动态、按需调控目标基因(群)表达,已经成为目前合成生物学的研究热点。
1 启动子识别与基因转录调控的一般规律
启动子是一段位于目标基因转录区上游、能够与RNA 聚合酶结合从而实现转录起始的DNA 序列。在原核微生物中,负责执行转录功能的转录机器——RNA 聚合酶全酶(包含α2、β、β'、ω、σ等亚基)依赖于其中的σ因子,特异性地识别具有特定序列特征的启动子区域并与之结合,从而引发转录的开始[4]。为了更好地阐明后文针对启动子工程研究的各种策略与前沿研究的设计思想,有必要从启动子识别与转录调控的基本规律说起。
以大肠杆菌为例,其σ 因子有7 种,分别为:σ70(σD)、σ54(σN)、σ38(σS)、σ32(σH)、σ28(σF)、σ24(σE)和σfecI[5]。其中,σ70被称为看家σ 因 子(housekeeping σ factor),它负责起始细胞生长相关的高达1 000多个基因的转录;σ54、σ38与σ32分别调控细胞的N 代谢基因、细胞稳定期相关基因以及热应激响应基因的转录。其他σ因子则分别调控极端热应激响应及外细胞质基因、鞭毛以及柠檬酸铁代谢相关等基因[6]。不同的σ因子,对应识别不同的目标基因启动子。
狭义的启动子通常是指在转录起始位点(+1)上游大约10 个及35 个核苷酸(nt)处的两段DNA短序列(也称为−10 区与−35 区;或启动子核心区),它们对于不同σ 因子的识别具有决定性的作用[7]。以大肠杆菌启动子为例,对所有σ70因子识别基因启动子区域的统计分析表明,−10 区与−35区的一致序列为TATAAT 与TTGACA。这两段序列之间通常被17 nt 的间隔序列所隔开。17 nt 的间隔序列长度对于大肠杆菌基因的转录水平十分重要。当间隔区长度长于18 nt或短于16 nt时,RNA聚合酶与启动子的亲和性都会显著降低,从而调低基因转录[7]。此外,有些−35 区的上游序列能够与RNA 聚合酶的α 亚基结合从而影响转录强度——这些序列被称作UP元件(UP element)[6,8]。
以大肠杆菌典型的启动子结构为例,其Plac和Ptrp启动子、σ70因子识别保守序列、σ54与σ32因子识别保守序列特征如图1所示[6-11]。

图1 大肠杆菌代表性启动子及几种σ因子的识别保守序列Fig.1 Representative promoters in E.coli and conserved sequences for RNA polymerase sigma factors
再以另一种模式微生物——枯草芽孢杆菌为例,其看家σ 因子识别的启动子的−10 区与−35 区保守序列以及优选的间隔区长度都与大肠杆菌相同[8-9]。但与大肠杆菌不同的是,枯草芽孢杆菌的启动子还存在一些统计学特殊规律,比如,其−48 位大多为保守的T 碱基,−43 位附近富含A 碱基,而−17~−14 位的特征序列则通常为TNTG 等。在其他一些革兰氏阳性菌中该规律也存在。此外,枯草芽孢杆菌中还存在特定的、负责控制与芽孢形成相关基因表达的转录因子σG,其靶基因的保守−10 区与−35 区一致序列变更为CATACTA 与TGAATA,优选的间隔区长度可为17~18 nt[10-11]。
需要进一步强调的是,对于不同的非模式微生物,由于其看家σ 因子(以及其他σ 因子)可识别的启动子序列经常并不相同,这就决定了在不同微生物种属之间,乃至同一菌属但不同种的微生物之间,很多启动子都无法通用,或者其转录启动效果在不同菌种中呈现显著差异。表1列出了几种典型模式微生物与非模式微生物的σ70因子偏爱的−35 与−10 核心区序列。由表可见,尽管大肠杆菌与枯草芽孢杆菌的核心区保守序列具有相同的序列特征,但其他几种微生物的核心区序列均存在一个或多个碱基的差异。

表1 几种模式/非模式微生物看家σ因子识别的启动子保守序列比较Tab.1 Some promoter consensus sequences for housekeep‑ing σ factors of model/non-model microorganisms
上述不同σ因子特异识别的保守序列差异与微生物细胞内成百上千不同基因的启动子序列差异,就导致不同微生物基因在表达时可以形成各自的表达时间模式与强度模式,这些表达模式对于合成生物学研究至关重要。因此,针对不同微生物尤其是重要的非模式工业微生物,其σ 因子种类、数量与特征、受不同σ因子识别调控从而起始转录过程的新型启动子的特征、功能与调控规律研究正在受到越来越多的关注。
此外,按作用强度区分,启动子可以分为强启动子(strong promoter)、中等强度启动子(moderate promoter)和弱启动子(weak promoter),其实质就是其上述核心区特征序列与RNA 聚合酶σ 因子的特异性结合能力存在差异。通常,强启动子和中强启动子常用于目标基因的高表达,而弱启动子则用于特定基因的弱化表达,以调控细胞内物质和能量的代谢平衡[17]。
按作用方式区分,启动子又可以分为组成型启动子(constitutive promoter)和诱导型启动子(inducible promoter)两大类。其中,组成型启动子调控的基因,不需要转录调控因子的参与,在细胞生长过程中即可实现基因的正常转录与翻译表达。而诱导型启动子,则必须要正调控或负调控蛋白与诱导物(外加化学试剂或代谢物分子等化学信号或温度、光、金属离子等物理信号)组合的共同作用,才能启动转录过程的顺利进行。鉴于合成生物学研究需要对细胞工厂中错综复杂的代谢途径与多目标基因进行差异化精准调控,诱导型启动子受到更多的关注,现有诱导型启动子的按需进化改造、新型诱导型启动子的发现、诱导机制解析以及新诱导方式的普适化拓展应用等已经成为合成生物学领域的研究前沿与热点。
诱导型启动子的负调控与正调控机理以及大肠杆菌最典型的β-半乳糖苷酶基因(lacZ)的负调控诱导型启动子的典型结构特征如图2所示[6]。
在启动子的负调控方式中,负调控蛋白(也称作阻遏蛋白或抑制子等)对目标基因的转录起负面的阻遏作用;它通常会结合到启动子下游、目标基因上游的一段被称为操纵序列的小DNA 片段上,从而阻止RNA 聚合酶对目标基因的正常转录。而当添加外源诱导剂后,诱导剂与负调控蛋白具有更强的结合作用,使其从操纵序列上脱离,继而基因的正常转录被开启[图2(a)、(b)]。在启动子的正调控模式中,情况则恰好相反。调控蛋白对于目标基因的转录起正向的激活或促进作用(因此有时也称作activator)。只有当诱导剂加入时,诱导剂与调控蛋白结合后的复合物才能够结合到操纵序列上,激活或促进下游目标基因的转录。

图2 诱导型启动子的负调控与正调控诱导机制以及大肠杆菌乳糖操纵子负调控的典型序列(a)无诱导剂条件下的基因调控;(b)诱导剂加入条件下的基因调控;(c) β-半乳糖苷酶(LacZ)启动子的乳糖操纵子负调控区域DNA序列。LacI—阻遏蛋白;lacO—操纵序列;SD序列—基因的核糖体结合位点(也称为RBS);Inducer—乳糖操纵子的lacI-lacO体系诱导剂,通常为异丙基-β-D-硫代吡喃半乳糖苷(IPTG)或乳糖(实际为1,6-别乳糖,乳糖的代谢物)Fig.2 Negative and positive regulation mechanism of inducible promoters and the partial sequence of lactose operon(lacO)of E.coli.(a,b)gene regulation mode under inducer-free or inducer-present condition,respectively.(c)partial DNA sequence of inducible promoter of β-galactosidase(LacZ)with negative regulation.LacI—inhibitor(repressor)protein;lacO—operator sequence for repressor binding;SD—Shine-Dalgarno sequence as ribosome biding site(RBS);Inducer—for lacI-lacO system,common inducer is isopropyl-β-Dthiogalactopyranoside(IPTG)or lactose(1,6-allolactose in fact,a metabolite of lactose),respectively
除了上述的正调控机制和负调控机制分别单独发挥作用的情况外,原核生物中也有许多诱导型启动子的调控作用需要正调控与负调控因子共同作用完成。其中,有的调控机制只需要2个调控因子合作,而有的则需要多个正负调控因子一起协作完成。
2 启动子改造的常用策略
为了实现关键目标基因的优化表达,经常需要对核心启动子进行遗传改造,以实现基因转录水平的可控调节乃至表达强度的精细调控。一般采用如下两种策略:一是对靶基因自身的内源启动子进行突变改造,或者将启动子与特定的转录因子相结合,从而改变启动子的强度[18];另一种方式则是将原有的启动子替换成其他启动子,从而彻底改变受控基因的表达谱,实现对关键基因转录水平的人工控制[19]。如图3所示。
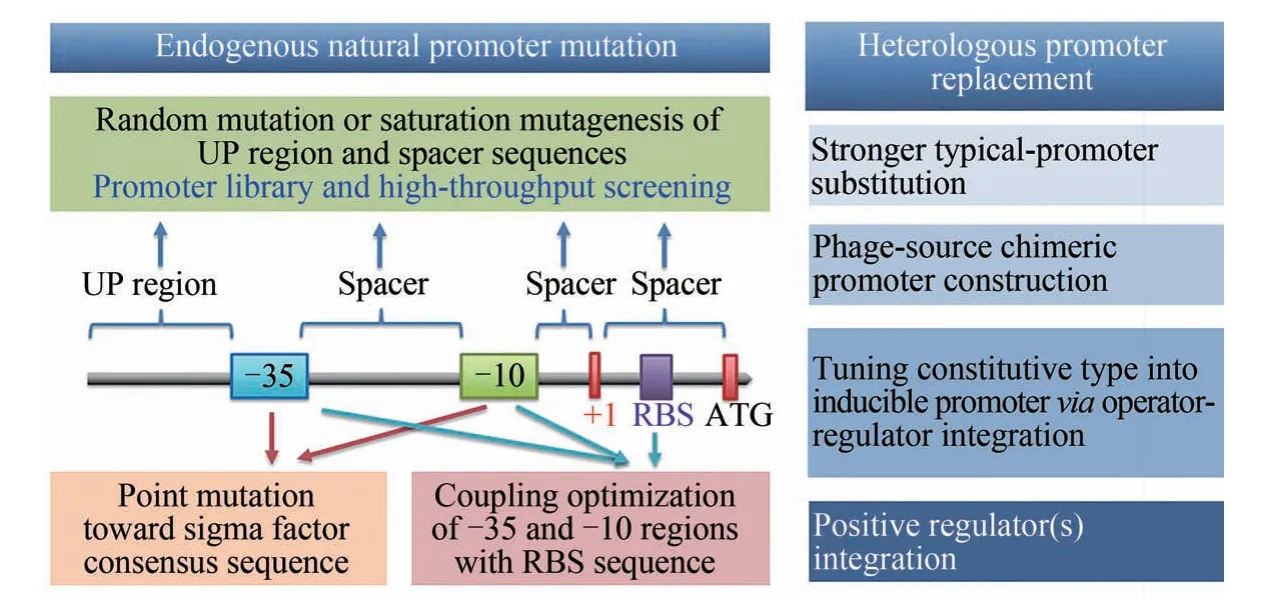
图3 启动子改造的常用有效策略−35和−10—启动子核心区;+1—转录起始位点;RBS—核糖体结合位点;ATG—翻译起始密码子Fig.3 Common efficient strategies for promoter engineering−35 and −10—core elements of promoter;+1—transcription initiation site;RBS—ribosome binding site;ATG—start codon of enzyme translation
在启动子突变方面,常用方法包括随机突变与定点突变。例如,可以通过易错PCR、定点饱和突变乃至创制合成等方式对启动子的UP 区或间隔区进行随机突变,创制不同强度的启动子库,或者创制合成启动子库(synthetic promoter libraries,SPL),用于代谢工程中多基因的差异表达调控;再结合高通量筛选方法获得优选的启动子[19-20]。随机突变方法的优点是能够得到不同性质及强度存在梯度分布的启动子;其缺点则是工作量大,需要结合合适的高通量筛选方法才能实现。也可以将目标启动子的核心−10 区、−35 区等关键区域序列向着σ因子识别一致序列的方向突变,从而显著改变启动子的活性[14,21-22]。例如,Jiao等通过对枯草芽孢杆菌Pg2 启动子的核心−10 区、−35 区分别进行面向σ因子识别保守序列的单点突变,突变启动子的强度提高了15 倍[21];在红色红球菌启动子的研究中,同样获得了类似的研究结果[14]。
在启动子的替换策略中,可供选用的启动子既可以是自身或者一些种属相近微生物中已被报道的或被广泛使用的启动子(如大肠杆菌中普遍使用的Ptac强启动子以及枯草芽孢杆菌中常用的P43 启动子等);也可以通过报告基因表达的方式对一组候选启动子的强度进行对比分析,从而得到可以使用的优选启动子[23-24];还可以选用一些噬菌体启动子、人工构建的杂合启动子等外源启动子。其中,优选的噬菌体启动子,例如来自T7 噬菌体的T7启动子、来源于噬菌体SPO-1的Pspac启动子[25],往往具有强转录特性。2013 年,Yang等[26]进一步从B.licheniformis基因组中筛选获得了PluxS 启动子,活性是P43 启动子的8 倍。将PluxS 与枯草芽孢杆菌Papr的−10 区结合,构建的杂合启动子PlapS,具有更高的转录活性。尤其是这些外源启动子不仅可以提高目标基因的转录强度,还可以利用大肠杆菌负调控蛋白-操纵子序列(LacI-lacO)等的引入,成功实现人工强启动子从组成型到诱导型的转变。例如,LacI-T7 系统诱导型杂合启动子插入枯草芽孢杆菌基因组,能够实现高达10 000 倍的启动强度动态调控范围[27]。将红球菌Rhodococcus rhodochrousJ1中的腈水解酶诱导型启动子与NitR正调控蛋白组合成PnitA-NitR杂合元件,成功构建了链霉菌高效表达启动子——以ε-己内酰胺为诱导剂,链霉菌蛋白表达量可以达到可溶蛋白的40%[28]。启动子替换改造的优势在于针对性强,有时可以大大减少筛选工作量。但另一方面,可供选用的启动子仍然非常有限,远不能满足快速发展的合成生物学研究的需求。
此外,启动子改造研究也经常与核糖体结合位点RBS的序列优化相结合。例如,通过3条枯草芽孢杆菌内源组成型强启动子序列与3条优选RBS序列的随机突变库,研究人员筛选获得了基因表达水平达到约14 000 倍动态调控区间的基因工具箱[29]。基于异源σ70依赖的启动子可以被链霉菌的“看家”σhrdB因子有效识别,Zhao等[30]将大肠杆菌启动子Ptac的核心区与变青链霉菌启动子PkasO*R15 的5′-非翻译区(5′-UTRs)融合,获得了改造启动子Ptac*,其在链霉菌S.lividansTK24中的启动强度达到Ptac的8.1 倍,以及PkasO*R15的1.7倍。进一步耦合RBS优化,优选启动子-RBS组合Ptac*RBS3对报告基因的表达强度达到Ptac启动子的17.6倍。
近年来,随着合成生物学的兴起以及组学分析、高通量筛选、人工智能等新兴技术的快速发展,启动子改造的新思路和新方法也不断涌现。Li 等[31]及Shen 等[32]发现,针对启动子核心区的间隔序列进行随机突变或饱和突变,可以获得具有310倍转录活性差异的启动子库,从而获得优选强启动子并显著提高目标产物PHB以及P(3HB-co-4HB)的产量。类似地,启动子上游序列突变对合成启动子的转录强度的影响也不容忽视[33]。而针对链霉菌启动子调控序列进行随机突变构建不同强度的启动子库,也成功筛选获得了一系列强、中、弱转录活性的链霉菌启动子[34]。进一步地,除了启动子核心区序列、上游序列及间隔序列以外,研究人员还发现,位于SD 序列上游的5′-UTR序列结构对于转录及翻译效率也具有显著影响;研究表明,相对于PBAD启动子,大肠杆菌细胞内104 个天然5′-UTR 序列的启动子强度在转录水平上从0.007%到4630%之间变化,而在翻译水平上则从0.1%到137%之间变化[35]。此外,基于单个启动子改造研究的突破,串联的双启动子组合策略也受到重视。研究发现,两个启动子之间的间隔序列长度对组合启动子活性的影响很大,其中80 bp 是优选长度[36]。最后,利用组学数据和生物信息学工具进行启动子序列识别与改造[37]、强度预测与RBS 序列优选[38]并指导新启动子发现、高强度新组成型或诱导型启动子改造以及目标基因的高效表达等研究策略,已经成为今后在合成生物学等生物技术领域开展启动子研究的必要工具。
3 不同类型诱导型启动子的研究进展
鉴于诱导型启动子在合成生物学、代谢工程和工业生物发酵中的重要地位,针对诱导型启动子的专门研究越来越多,启动子元件在生物技术研究与生产实践中的应用前景非常广阔。研究人员不仅关注经典强启动子的进一步改造和新用途,比如,T7 转录系统与T7 噬菌体启动子在逻辑门与基因线路中的应用[39],还关注各种新型诱导剂的发现(化学分子)以及新诱导方式的开发(物理信号),以满足日益增长的工程生物学研究的迫切需要。
迄今为止,从不同微生物来源的菌株中,已经发现大量的新类型诱导型启动子,受不同化学诱导剂分子或物理诱导信号的调控,对目标基因进行不同强度的表达。相关研究进展总结见表2。
由表2可见,化学诱导剂的种类目前已经增加到了几十种。但在工业生产中真正实现了应用的,还比较少。总体而言,IPTG 类诱导剂仍然最为高效、严谨且应用最为广泛。但IPTG 的高成本问题已经称为制约其进一步推广的核心因素。有鉴于此,研究者们致力于开发全新的,兼具高效、严谨且低成本优势的新型诱导型启动子,目前已经取得较好进展。例如,对异丙苯甲酸酯诱导启动子、ε-己内酰胺诱导启动子等。本文作者课题组正在致力于解析红色红球菌中独特的尿素诱导型强启动子的诱导机理,一旦获得成功,有望推广到其他宿主菌株中获得普适性应用。而营养源饥饿诱导型启动子(如氮饥饿、磷酸盐饥饿)、低溶氧诱导启动子等,也具有工业化的应用潜力与优势。

表2 近年来报道的一些不同微生物来源、不同类型的诱导型启动子Tab.2 Some inducible promoters reported recently from different microorganisms with diverse mechanisms
物理信号诱导的启动子也吸引了大量研究者的关注。比如,温度诱导启动子、光诱导启动子等。其中,微生物温度诱导启动子主要分为高温(热)诱导和低温(冷)诱导两类,其温敏开关涵盖了DNA 型、RNA 型以及蛋白质型[69-72]。而光诱导启动子则分为白光、蓝光、黑暗诱导等多种类型,其调控蛋白等调控因子也各有不同[73-75]。尽管这些启动子在实验室规模的研究中已经取得了很多令人振奋的突破,但放大到大规模工业生产水平,变温操作的能耗问题以及光诱导信号的液面下衰减问题仍然困扰着产业界和学术界。可以预期,新型分子生物技术与新型生物装备的结合,有望解决上述问题。
4 组成型启动子的研究进展
相比于诱导型启动子,组成型启动子不涉及操纵序列、阻遏蛋白、激活蛋白等转录调控元件,因此其工作机制相对简单,但其在合成生物学、代谢工程等领域高性能细胞工厂以及细胞催化剂的构建研究中同样具有举足轻重的作用。就方法学而言,组成型启动子的改造策略已经在前文中充分讨论,在此就不再赘述。
目前,针对组成型启动子的研究热点,大致可分为两类,均是基于目前快速突破的基因组、转录组及蛋白质组等组学测序技术以及基于计算机辅助的生物信息学与人工智能技术:一方面是面向基因编辑工具比较匮乏、基因改造相对困难的各种非模式重要工业微生物或特殊微生物,开展不同强度新启动子、不同表达时序新启动子的
识别发现及改造研究,乃至不同微生物中RNA 聚合酶σ 因子(或其他重要转录元件)的种类、功能、基因转录调控规律及其改造方法与应用等研究;另一方面则是面向基因背景清晰、基因编辑工具相对成熟的模式微生物(如大肠杆菌、酵母菌),基于生物信息学及人工智能工具,进行启动子序列结构基本规律解析、人工预测与设计、人工合成乃至人工智能从头设计等研究[14,31,76-82]。
例如,Jiao 等[14]针对在生物催化工业中具有重要应用的非模式微生物红色红球菌,通过不同生长阶段转录组的测序分析,获得了其生长期高表达基因的启动子序列特征,发现了其σA识别启动子的保守序列。Li 等[31]则针对嗜盐菌开展了组成型启动子库的研究——从高表达的孔蛋白启动子出发,针对其核心区间隔序列突变,获得了梯级强度的组成型启动子库,以满足细胞工厂中大量基因的不同表达强度需要。Trisrivirat 等[78]采用类似的策略构建组成型启动子库,实现了生物丙烷产量的提高。Sun 等[79]通过采用生物信息学工具进行RBS 设计与筛选,并耦合启动子序列改造,获得了分枝杆菌的高表达元件,同时实现了甾醇产量的显著提升。Liu等[80]通过对酵母菌中TATA-盒与转录起始位点间序列的随机突变与筛选,获得了两个新的强启动子并提高了β-胡萝卜素的产量。Zhang 等[81]基于统计模型预测,重构了谷氨酸棒杆菌的人工合成启动子库,获得了优选的串联启动子P70,其强度高达tac启动子的1.21 倍。针对大肠杆菌启动子,Wang等[82]基于机器学习算法,实现了大肠杆菌启动子的AI 从头设计。人工智能、生物信息学与启动子领域的交叉研究,已经成为启动子工程的新前沿之一。
5 启动子工程的新前沿
随着合成生物学与人工智能工具的快速发展,越来越多的开创性研究在启动子工程领域涌现。具有动态代谢调控功能的特殊启动子的发现与改造、新性能启动子元件的人工智能设计与进化等研究是启动子工程领域的代表性新前沿。
首先,微生物的胞内代谢网络十分复杂,各种代谢物以及功能酶的浓度会随着时间进行动态改变,采用常规的静态代谢工程策略,如基因的过表达(上调)、敲除或弱化表达(下调)进行代谢流调控,即使在优化调控条件下,也可能造成菌体在某个时间段发生代谢失衡,或者有毒中间代谢产物的积累,不利于菌体生长和目标产物合成,从而导致产物的产量和得率并不理想。动态代谢调控(dynamic regulation)的概念近年来应运而生,其核心思想是让菌体细胞能够感应到时时变化的环境状况或自身的胞内信号,并对其做出响应,调控相关代谢反应以实现代谢途径的动态平衡,进而达到目标产物合成的高产量、高底物转化率的统一。动态代谢调控元件的开发是实现动态代谢调控模式的关键,它们一方面具有生物传感器的功能,另一方面也具有执行代谢调控的功能。在目前已经报道的多种元件中,特殊的新模式诱导型启动子与群体感应信号系统、核糖开关等元件一样,都是研究人员关注的重点。例如,Öztürk 等[83]阐述了双启动表达策略的基本原则,以满足未来动态代谢工程领域的需求。Landberg 等[84]开发了一种基因组整合型trp‑T7 表达系统,可以实现依赖于色氨酸或酵母提取物浓度的自诱导,严谨调控目标基因的表达;用该系统生产L-丝氨酸,补料分批发酵培养的丝氨酸产量达到26 g/L。Moreb 等[85]开发了基于E.coliPhoB 调控的磷酸盐饥饿诱导启动子,能够在营养丰富培养基和合成培养基中均实现外源蛋白的自诱导严谨调控,使得外源蛋白在磷酸盐耗尽时自行启动高表达,从而实现了细胞生长与产物合成解耦的两阶段自诱导发酵培养模式。类似地,Ikegaya 等[86]也报道了来源于红串红球菌R.erythropolisN9T-4 的营养匮乏诱导型调控因子。Liang 等[87]则开发了基于产物香草醛以及底物阿魏酸浓度的动态代谢调控回路,实现了香草醛的高产。
其次,人工智能工具已经在越来越多的领域显示出了强大的功能。在启动子工程方面,利用机器学习新方法进行人工启动子设计、创制与优化的研究现已蓬勃兴起,并取得了突破性的成果。例如,如前所述,Wang 等[82]发表了基于机器学习的大肠杆菌启动子的AI 从头设计框架与活性预测模型,结果表明,经过两轮优化,70.8%的AI 设计人工启动子都可以被证明有效,且其序列与大肠杆菌原基因组序列的相似性很低,说明人类已经可以基于机器学习,创造出有效且可能更高效的启动子新序列。类似的,van Brempt 等[88]则通过卷积神经网络的机器学习方法,获得了启动子序列与功能之间的构效关系信息,成功预测了大肠杆菌σ70启动子的转录起始速率、17 nt 的启动子间隔区序列,以及枯草芽孢杆菌3 种不同σ 因子特异性的启动子序列。Zhao 等[89]通过机器学习方法,构建了包含3665 个不同序列的人工启动子库,其强度变化范围达到两个数量级,且最强启动子的转录活性达到1 mmol/L IPTG 诱导的T7 启动子的1.52 倍以上。这些研究工作,将成为人工智能工具在启动子工程领域深度并全面应用的开端。
6 展 望
随着我国可持续发展战略的加速推进及二氧化碳减排的迫切需求,绿色生物制造产业正在全面拓展与提升,合成生物学以及面向产业化的工程生物学,已经被认为是本世纪最重要的生物技术平台[1-2,90]。
在微生物中,转录调控是实现目标基因按需表达的最基础、最重要因素之一[76],启动子则是转录水平调控的核心元件[91-92]。基于启动子的基因高效及精准表达调控在合成生物学中具有举足轻重的地位[93-94]。伴随着合成生物学新技术、高通量生物检测新装备、单细胞测序技术、生物信息学乃至人工智能等交叉研究领域的协同发展,启动子工程已经取得了令人瞩目的进展和突破,但同时大量具有挑战性的科学问题目前还仍然存在。例如,单一启动子经常发生的基因泄露表达及干扰问题,尚缺少根本性的解决方案;大量组成型与诱导型启动子的强度响应范围仍然不能满足合成生物学研究与产业化生产的需要;众多有价值的非模式微生物菌株的基本转录调控元件、工作原理与调控规律还不十分清楚(比如其看家σ因子的启动子识别保守序列、调控生长稳定期基因表达及各种环境响应性基因表达的新σ因子及其保守序列、新型正负调控蛋白等);响应更多化学分子与物理信号的新诱导型启动子的发现、诱导机制解析与改造应用还具有非常广阔的研究空间;从产业角度,具有安全、高效、低成本特征的新型诱导剂的开发及其产业化应用仍然非常有限。此外,在不同微生物种属之间具有广谱通用性的启动子还不多见;多启动子串联协同强化转录的研究还刚刚起步;启动子与反义RNA、核糖开关、群体感应信号等元件协同实现代谢途径重构优化、基因线路设计构建、新型生物传感器设计开发、人工多细胞体系以及无细胞体系高效合成目标化学品等研究方兴未艾;人工智能从头设计启动子的开创性研究还受限于菌种基因背景清晰度、基因编辑工具可用性、高效性以及新算法的性能与精度以及软件开发等问题。总之,启动子元件的科学基础与基因转录调控规律的深入研究、其改造方法与手段的全新突破、各种新型诱导剂分子与诱导模式的创制及产业化复杂环境下的高效且低成本应用乃至其调控动态化、设计智能化以及创造性从头设计的新发展,都将是今后一段时间内微生物启动子工程领域的重要研究内容[82,88-89,94-100]。
随着合成生物学的研究对象逐渐从基因元件与模块走向全细胞复杂代谢线路从头设计乃至生物新功能从头创制,可以预见,在如下合成生物学领域,微生物启动子工程都将发挥越来越重要的作用,包括:新酶的高表达与高效制备;全细胞生物催化;基因线路设计、动态代谢调控以及高性能细胞工厂创建与优化;高灵敏度生物检测及多功能无细胞合成体系开发;高效、稳定的人工多细胞体系创制及复杂环境应用以及各种新兴交叉领域,如生物-金属复合催化、生物新材料、生物系统自动控制、生物信息学与AI新工具等等。
综上所述,启动子工程,尤其是微生物启动子工程,将驱动合成生物学研究与绿色生物制造技术的持续快速发展,从而为我国绿色化工、环境保护、医药与大健康、食品及能源等领域的发展做出不可替代的重要贡献。
致谢:谨以此文致敬Daniel I.C.Wang 教授在基因工程及生化工程等领域的开创性贡献。

