生物药产业蓬勃发展早期的奠基性系统开发
——缅怀王义翘教授的开创性研究和成就
谢良志
(1 北京市蛋白和抗体研发及制备工程技术研究中心,北京神州细胞生物技术集团股份公司,北京 100176;2 单克隆抗体上游研发技术北京市重点实验室,北京义翘神州科技股份有限公司,北京 100176)
引言:生物药产业蓬勃发展的50年
生物技术自20 世纪70 年代开始萌芽,经历了从采用微生物(如大肠杆菌)表达生产分子量较小、且无需翻译后修饰的蛋白质药物(如生长因子、白介素2 等),到采用真核细胞表达生产分子量大、具有糖基化等翻译后修饰、结构复杂的蛋白质药物(如重组八因子蛋白、单克隆抗体药物等)的发展和进步历程。工程技术化一直是推动和制约生物药产业化发展的关键。大规模中国仓鼠卵巢细胞(CHO 细胞)培养已经成为生物制药行业最广泛使用的生产工艺技术。然而,在生物药发展的早期阶段,采用对剪切力敏感、需要添加动物血清而且需要贴壁才能生长的哺乳动物细胞来实现年产量成吨级抗体药物规模化工业生产是不敢想象的。
王义翘教授以其敏锐的前瞻性和战略性眼光,敢于挑战科学和工程领域最尖端的技术,自20 世纪60 年代率先进入微生物发酵和动物细胞培养等工程技术领域,他的研究除本文重点介绍的研究方向外,还涉及生物反应器的自动化在线监测和控制、蛋白质复性技术、分离纯化技术等,系统全面地涵盖了生物药产业化各个方面的关键技术,为当代生物药大规模工业化生产奠定了坚实的基础,做出了开创性的杰出贡献,被誉为“生物化工领域奠基人”(the founding fathers of the field of biochemical engineering)[1],“生物化工的驱动力”(the driving force in biochemical engineering)[2];“过去40 年生物技术工业有影响力的领导者”(influential leader of the biotechnology industry over the past four decades)[3],“生物化工领域的缔造者和权威”(an architect of the field of biochemical engineering,a luminary in the field of biochemical engineering)[4],“生物化工之父”(father of biochemical engineer)[5],“生物技术之父”(father of biotechnology)[6]和“现代生物技术之父”(the father of modern biotechnology)[7]。
20 世纪80 年代,哺乳动物细胞培养开始用于需要糖基化等翻译后修饰的蛋白质药物的生产。早期的生物药品种主要为临床剂量较低的因子类蛋白药物,如重组八因子(factor Ⅷ),红细胞生成素(erythropoietin,EPO),组织型纤溶酶原激活剂(tissue plasminogen activator,tPA)等。受限于当时对哺乳动物细胞代谢和培养的了解以及极为有限的工艺开发能力和工艺放大经验,EPO的生产工艺为添加牛血清的转瓶(roller bottle)贴壁培养[8],GMP 无菌操作是在一个封闭的、由自动化机器手操作的无人车间完成的,无菌保障和规模放大都极具挑战性。由于表达量低,产品稳定性差等因素,八因子蛋白则是采用连续灌注(perfusion)或重复批次培养(repeated-batch)实现商业化生产[9]。
20 世纪80 年代末,单克隆抗体药物研发开始起步。由于抗体的临床剂量通常达到几百毫克,比因子类产品微克级的剂量高几个数量级,因此,需要开发操作简单、容易放大、产量高的细胞培养生产工艺技术。优化细胞培养生产工艺需要突破一系列的认知和技术瓶颈,如将CHO 细胞从贴壁生长驯化成悬浮生长,从含血清培养驯化成无血清培养,控制葡萄糖和氨基酸代谢的抑制细胞生长的副产物(如乳酸和氨),控制细胞生长所需数十种营养物质在反应器中的浓度等。
此后30 年,哺乳动物细胞表达的生物技术产品商业化进入快速增长阶段,截至2020 年底,美国FDA 已批准101 个单克隆抗体药物上市,其中2010 年后批准上市的品种占72 个,抗体药物研发和商业化呈快速增长态势。2015~2020 年,全球销售排名前十的药品中生物药品种稳住6~8 席。排名第一的阿达木单抗(TNF-α抗体,治疗自身免疫性疾病)自2002 年底获批上市以来,年销售额快速增长,2018 年达到200 亿美元(图1)。截至2020 年,阿达木单抗累计销售额已达到1720 亿美元,成为历史上最成功的药品。阿达木单抗的快速增长是生物药产业发展的一个缩影,从一个侧面体现了生物药过去三十年的蓬勃发展历程。单克隆抗体等生物药商业化取得的巨大成功,催生的大规模GMP 生产需求的实现,得益于哺乳动物细胞培养工艺技术的不断优化以及生产规模的不断扩大。王义翘教授领导建立的MIT 生物技术和工程中心(MIT-BPEC)在90年代开展的针对动物细胞培养、代谢、控制、工艺放大以及蛋白质质量控制等开拓性研究奠定了国际生物药工业化生产的基础。王义翘教授带领学生从动物细胞培养、生产工艺的各个方面进行了系统性的研究,本文仅对其部分研究工作和成就进行简单概述和总结。王义翘教授在其他生物工程领域的贡献和成绩已在其他文章中进行了总结[10]。

图1 阿达木单抗年销售额Fig.1 Annual sales of Adamuzumab
1 王义翘教授团队早期开展的基础性研究和开发工作
早期的动物细胞培养研究大多以通过培养皿(culture dish)和转瓶(roller bottle)贴壁培养的原代细胞为主,很难实现工业化生产。1967 年,van Wezel A L[11]首次提出采用阴离子微载体培养原代细胞的概念并成功实现多种原代细胞的贴壁悬浮培养,但由于细胞接种贴壁效率低,微载体对细胞生长存在抑制性“毒性”等一系列问题,此后10 年的反复研究并没有取得实质性的进展[12-15]。1977—1979 年,Levine D.W.和Giard D.J.在王义翘教授和Thilly W.G.的指导下,采用带正电荷的葡聚糖微球(dextran microsphere)作为微载体进行细胞培养,解决了细胞贴壁效率低、微载体对培养基中活性成分吸附造成的细胞生长抑制等关键问题,才真正推动微载体细胞培养技术进入工业化应用阶段[16-21]。此后,王义翘教授和他的学生Hu W.S.、Croughan M.、Hamel J-F[22-31]又对微载体培养的细胞接种密度、微球粒径、细胞传代、微载体密度、剪切力等关键工艺参数进行了系统研究和优化。王义翘教授团队的早期研究奠定了此后数十年微载体细胞培养技术和工业化应用不断发展进步的重要基础,也为90 年代经驯化后CHO 细胞的悬浮培养工艺开发和优化奠定了基础。
20世纪80年代末,王义翘教授团队还设计了一种开创性的气升式纤维固定床生物反应器(air-lift fiber bed bioreactor)进行贴壁细胞培养。Perry S.D.[32]在王教授指导下首先对气升式玻璃纤维固定床生物反应器进行了概念设计和初步可行性验证。此后,王教授团队的Chiou T.W.(邱紫文)和Murakami S.[33-34]又连续发表了两篇论文分析了规模化放大的可行性:采用上述概念实现了气升式玻璃纤维固定床生物反应器66天的CHO细胞贴壁培养,细胞密度达到了6.8×107细胞/mL,实现了230倍的细胞扩增;Murakami S.和Chiou T.W.[35]还对剪切力、营养成分和氧气传输和消耗进行了模拟计算和理论放大研究,初步验证此类生物反应器具备从10L放大到67 000L的潜力。
王义翘教授团队在微生物和酵母发酵生产工艺研究[36-42]、在线自动检测和控制[43-46]等方面的早期研发也为动物细胞大规模培养工艺开发、生物反应器设计和工艺放大起到了重要的借鉴作用[47]。
2 动物细胞培养过程中有毒副产物的代谢调控研究
氨和乳酸是动物细胞培养过程中的两个主要代谢副产物。20 世纪80 年代末至90 年代初,氨和乳酸对动物细胞的生长、代谢和蛋白质糖基化修饰的影响已进行了全面、系统的研究[48-54]。在2~4 mmol/L 的氨浓度下,大多数细胞系的生长速度和产品表达水平没有显著影响,但是更高浓度的氨可导致严重的细胞生长抑制和细胞死亡。乳酸在细胞培养过程的积累同样对细胞生长和代谢不利,一方面会导致pH 的下降和渗透压的升高,同时还可能抑制葡萄糖的能量代谢。因此,控制氨和乳酸的产生和积累是实现高密度细胞培养、提高蛋白质生产的关键手段[55-56]。
王义翘教授实验室研究了多重创新策略进行细胞代谢副产物的调控,他的博士生Chang D.Y.S.(张幼翔)利用氨和乳酸在培养环境中分别带正电和负电荷的特性,创造性地采用电场移除氨和乳酸的策略,有效控制了氨和乳酸在细胞培养反应器中的浓度,并通过在培养基中加入过量氨基酸和葡萄糖进行细胞培养,将细胞密度从3.7×106细胞/mL 提高到9.1×106细胞/mL,抗体产量从170 mg/L提高到505 mg/L[57-58]。
细胞培养用商业化基础培养基(如IMEM、DMEM)中氨基酸和葡萄糖浓度过高,细胞的新陈代谢效率较低并导致大量有毒副产物的产生和积累。研究表明,氨的产生主要来源于谷氨酰胺,其他氨基酸也能进入TCA 循环代谢并产生氨[59-66]。氨的产生速率与谷氨酰胺浓度相关性较高,当谷氨酰胺浓度从商业化基础培养基中4~6 mmol/L 的浓度下调到0.5 mmol/L 时,大多数细胞的生长速率并不会受到影响,但非必需的谷氨酰胺代谢和降解会大幅下降,氨的产生速率也因此会大幅下降[67-70]。同理,葡萄糖代谢是乳酸的主要来源,控制葡萄糖到一个不影响细胞生长速率的较低浓度(如2~5 mmol/L)可有效降低乳酸的产生[71-77]。一些早期研究采用经典的补料技术或连续培养技术控制谷氨酰胺或葡萄糖浓度和代谢,获得了一些积极结果,为20 世纪90 年代的流加工艺研发奠定了概念验证的基础,但单变量控制的效果往往有限[52,55-56,67,73,75-77],主要是因为氨基酸(不仅仅是谷氨酰胺)和葡萄糖的代谢网络是交织在一起的,具有一定的互补性和替代性。因此,控制细胞生长所需的整个营养环境(包含数十种必需的关键成分),同时解决氨和乳酸积累导致的细胞生长抑制问题和营养成分消耗补充问题,才可能大幅度提高细胞密度和产品产量。
本文作者在王教授的指导下,通过系统研究细胞新陈代谢网络,解析出合成一个细胞所需各类营养成分的最低值,采用化学计量平衡的基础培养基和加料液控制生物反应器中各营养成分(主要是氨基酸和葡萄糖)的浓度和细胞代谢,以达到调控和优化细胞新陈代谢、降低氨和乳酸产生速率和积累、提高细胞密度、延长细胞生长时间、优化目标蛋白和抗体产量的目的。实验结果显示,与标准批次培养对比,通过化学计量平衡的加料,使细胞生长所需的氨基酸和葡萄糖浓度在流加培养全过程中均控制在较低但相对稳定的水平,在保证细胞生长速率的前提下,乳酸的产生速率从批次培养0.3 pmole/(cell·h)降低到0.0036 pmole/(cell·h),氨的产生速率从0.016 pmole/(cell·h)降低到0.0028 pmole/(cell·h)[78-80]。
由于乳酸的产生是一个涉及LDH 酶的催化反应,王教授实验室团队人员(陈克勤博士,刘谦研究员和笔者)在20 世纪90 年代初期开创性地尝试通过基因工程改造的技术建立一个LDH-A 基因敲除的细胞系,以达到降低或消除乳酸副产物的目的,但受限于当时的技术,仅获得了一个单拷贝LDH-A 基因敲除的细胞克隆。批次细胞培养试验结果显示,单拷贝LDH-A 基因敲除细胞的乳酸产生速率比未改造的母细胞降低了50%,最高细胞密度提高了30%,抗体产量提高了3 倍[81]。该技术验证了通过基因工程改造的方式控制细胞新陈代谢、提高营养成分的代谢效率,降低有毒副产物的新方法。由于刘谦研究员回国后忙于政务,研究结果直到2001年才最终发表[81]。
3 动物细胞培养过程中新陈代谢网络分析研究和化学计量模型解析
由于细胞生长需要消耗大量营养物质,尽管较低的氨基酸和葡萄糖浓度可以降低氨和乳酸的产生,但不足以支撑细胞的持续生长。因此,需要在培养过程中持续添加细胞生长所消耗的多种氨基酸、葡萄糖和维生素等营养成分。数十种营养成分的配比以及加料速率控制是开发高密度培养和高产量生产工艺的关键,因为只要有一种关键营养成分添加量不足,就可能导致该营养成分成为细胞生长的限制因素,并引起其他营养成分和有毒副产物在反应器中积累。
在20 世纪90 年代初期,大规模动物细胞培养刚刚被尝试应用于生物药的商业化生产。由于细胞新陈代谢涉及成千上万的生物化学反应,涉及数十种营养成分和成千上万的生物学物质,如构成细胞的各种蛋白质(膜蛋白、酶、结构蛋白等)、脂肪、碳水化合物、DNA、RNA等,以及各种各样的中间产物和副产物。因此,细胞新陈代谢网络的复杂性和多样性导致理论上存在无数种可能的代谢方式和结果,即细胞的生长方式不是唯一的,而是多变的。举例来说,细胞既可以将葡萄糖代谢成乳酸,产生2个ATP,也可以在TCA循环中氧化成CO2和水,产生30~38 个ATP。在每次细胞培养过程中,转化成乳酸和进入TCA 循环的葡萄糖比例并不是固定的。很显然,细胞的新陈代谢效率也是动态变化的。因此,在90 年代初期以前,细胞培养过程被认为是一个不可解的“黑箱”。细胞培养实验优化主要凭经验,根据检测主要营养成分消耗情况、细胞生长情况和蛋白质产品表达量,得出一些经验结果进行试错式的迭代优化。加料液的配比也通常是在基础培养基(如DMEM、IMEM 等)的基础上进行浓缩。采用浓缩加料液的流加工艺可以有效解决关键营养成分在批次培养后期被耗尽所导致的细胞生长停滞和死亡的问题,取得了比批次培养更好的结果,但单克隆抗体产量仍一直处于几十毫克/升至几百毫克/升的水平[58,82-88]。
本文作者试图通过系统分析复杂的细胞新陈代谢反应网络,梳理出营养物质成分与细胞构成成分以及能量代谢的对应关系,进而建立主导细胞合成的化学计量反应方程式[89]。这是一项前所未有的高挑战性任务。并结合自身的生物化学、细胞生物学、化学工程,系统工程和计算机编程等方面的知识和经验,对新陈代谢反应网络涉及的生化反应按细胞内的物质类别进行归类和简化。例如,无论涉及的生化反应如何复杂和多样,细胞内的蛋白质总量及其氨基酸成分是基本稳定的,而且可以准确测定,因此,根据物质守恒的原理,合成细胞内所有蛋白质所需的各类氨基酸是可以确定的。相对而言,细胞的能量代谢则更为复杂,一方面是细胞生长所需的能量既包括合成细胞所需的能量,还包括细胞生长停滞状况下的基本消耗,即维持需求;另一方面,涉及细胞能量代谢的化学成分既包括葡萄糖,还包括多种氨基酸,而且这些营养成分在一定程度上具有相互替代功能[61,66,90-92]。举例来说,当葡萄糖浓度太低时,谷氨酰胺和其他氨基酸的消耗速率会大幅提升,成为葡萄糖能量代谢的主要代偿。
尽管细胞生长的化学计量模型没有唯一解,但理论上只有一个最优解,即当所有的细胞新陈代谢反应均以最高效率和最佳方案进行时,细胞生长所消耗的各种营养成分达到最低、产生的氨和乳酸副产物达到最低。根据物质守恒和能量守恒的原理,即可以解析出一个最佳的理想化的细胞生长化学计量模型。在实际应用中,理想化的化学计量关系是无法实现的,因为细胞的能量代谢无法达到最优,因此,需要对限制条件进行适度放宽,即允许细胞在代谢过程中采用一些非最佳的替代方式,如产生一定量的乳酸和氨,从而使化学计量模型变得可行和具有实际应用价值[78-80]。
4 化学计量平衡控制的动物细胞高密度流加培养工艺开发
根据已建立的动物细胞生长化学计量模型中解析出的各营养物质的化学计量系数比,就可以参照一个普通化学反应的控制原理设计并配制出化学计量平衡的细胞培养基和加料液。理论上,如果化学计量模型准确预测了细胞在培养过程中的新陈代谢,则各营养物质的消耗速率是均衡的,即不会出现某些营养成分被消耗尽而另一些成分大量积累的问题,也就是说可以通过一个包含几十种营养物质的加料液来控制细胞培养反应器中所有关键营养成分的浓度使其维持在一个最优水平。这是以前不敢想象的目标。
1992 年,本文作者对前文描述的化学计量模型进行了解析,采用可收集的文献数据对细胞的主要成分进行了估算:细胞干重为0.36 ng/细胞,其中各主要成分占比分别为:蛋白质37.5%,DNA 2.5%,RNA 6.9%,脂类20%,碳水化合物25%。此外,利用文献报道的207 个蛋白质氨基酸组成,计算出一个平均的氨基酸摩尔分数用于化学计量模型的解析。具体为:Ala 9.0%;Arg 4.7%;Asn 4.4%;Asp 5.5%;Cys 2.8%;Glu 6.2%;Gln 3.9%;Gly 7.5%;His 2.1%;Ile 4.6%;Leu 7.5%;Lys 7.0%;Met 1.7%;Phe 3.5%;Pro 4.6%;Ser 7.1%;Thr 6.0%;Trp 1.1%;Tyr 3.5%;Val 6.9%。根据解析出的各营养成分的化学计量系数,设计了第一代的基础培养基和加料液配方,并在T 形培养瓶内进行了两轮流加培养试验验证。批次培养中,各种营养物质随着细胞生长而快速被消耗,其浓度不断下降;而在化学计量控制的流加培养中,葡萄糖和氨基酸的起始浓度就处于一个较低但足以维持细胞生长的浓度,培养过程加入的加料液对细胞生长过程中所消耗的营养物质进行了有效的补充,因此大多数营养物质的浓度维持在一个相对稳定的水平,部分成分的浓度还有一定的升高[93]。与批次培养对比,氨和乳酸的产生速率得到了大幅度(26倍和50倍)的降低。由于氨和乳酸的积累得到非常有效的控制,阶段性的加料确保了关键必需营养成分的补充和维持在细胞生长所必需的最低浓度以上,细胞密度得到了大幅度的提升,而且培养时间从批次培养的150 h 延长到了流加培养的300 h 以上。因此,抗体的产量从50 mg/L 首次提高到了550 mg/L。该研究结果于1994 年初在生物工程权威刊物Biotechnology &Bioengineering上发表[93]。细胞生长的化学计量模型在流加培养中实现跨越式突破的应用价值首次得到了初步认可。
此后,根据首次试验获得的数据和经验对化学计量模型进行了校正和优化,并对细胞的主要成分进行了实测。结果显示,细胞干重为0.25 ng/细胞,其中各主要成分占比分别为,蛋白质72.9%,DNA 1.4%,RNA 3.8%,脂类13.5%,碳水化合物3.5%,与首次计算采用的文献数据偏差较大。细胞内蛋白质的氨基酸摩尔分数实测数据为:Ala 8.25%;Arg 5.93%;Asn 4.4%;Asp 4.69%;Cys 2.8%;Gln 6.2%;Glu 4.96%;Gly 8.54%;His 2.16%;Ile 4.22%;Leu 8.11%;Lys 6.79%;Met 2.17%;Phe 3.19%;Pro 5.26%;Ser 6.89%;Thr 5.73%;Trp 1.1%;Tyr 2.59%;Val 6.02%。实测的氨基酸比例与首次采用的平均值也有一些偏差,但整体符合性较好,对模型计算结果的影响不大。
根据优化的模型和细胞株的实测组成数据解析出的化学计量系数进行了第二轮的培养基设计,并在自动控制的2L 生物反应器中进行了第二轮验证和优化实验。在本轮实验中,加料液的添加是由计算机控制自动连续进行的,因此避免了间歇式手动加料造成的瞬时浓度刺突式的增加。溶氧和pH 值也得到了控制并维持稳定,从而避免了首轮试验中T 形培养瓶中溶氧限制和pH 下降产生的局限性。
结果显示,乳酸的产生速率比批次培养降低了62 倍,比首轮采用化学计量模型控制的T 形培养瓶流加培养实验进一步降低了8倍;抗体产量比批次培养提高了17 倍,达到900 mg/L,此为当时文献报道最高水平。在350 h 以上的培养中,总细胞密度达到了2.2×107细胞/mL,最高活细胞密度达到了6.3×106细胞/mL,而乳酸的峰值浓度仅为11 mmol/L,氨的峰值浓度仅为6 mmol/L 左右。葡萄糖和谷氨酰胺的浓度在培养全过程中均得到了良好控制[94],再次验证了化学计量模型对动物细胞流加培养工艺优化和控制的巨大价值。
通过化学计量模型解决了关键营养成分在培养过程中被耗尽或大量积累的问题,同时还大幅度降低了有毒副产物乳酸和氨的产生速率,避免了氨和乳酸积累到抑制细胞生长或导致细胞死亡的浓度。然而,在严格控制的细胞培养反应器中,当活细胞密度达到(5~10)×106细胞/mL 水平时,尽管总细胞密度继续增加,但活细胞密度不再增加,导致培养后期的细胞活率下降,很可能是还有一些细胞生长所必需的营养物质未能通过化学计量模型得到有效控制。
因此,又对流加培养工艺过程和控制进行了进一步的优化:①通过离线细胞计数,每12 h 对细胞生长速率和加料速率进行校正;②通过分析认为,基础培养基中的磷将可能在培养后期被耗尽,进而影响细胞的能量代谢和磷脂合成,因此,对磷的化学计量系数进行了测算并应用到加料液配方设计中;③在培养中期添加了血清和金属离子(Li+,Zn2+,Cu2+等)。由于上述优化改进,流加培养时间进一步延长到550 h,最高活细胞密度达到1.7×107细胞/mL(图2),总细胞密度达到5×107细胞/mL。细胞培养反应器从外观上观察已成肉色。在未采取细胞截留措施的流加培养中能达到如此高的细胞密度是前所未有的,因此,抗体产量也达到了前所未有的2400 mg/L(图3),比批次培养提高了45 倍[79]。上述结果是基于化学计量平衡的培养基设计和加料速率控制,关键营养成分维持在一个较优且基本恒定的水平而实现的。如图4 和图5 所示,与批次培养中葡萄糖和谷氨酰胺浓度由于细胞代谢的消耗而随培养时间延长而快速下降不同,在化学计量平衡和控制的流加培养中,葡萄糖和谷氨酰胺浓度在全培养过程中均被控制在一个较低且相对稳定的浓度范围,既避免了浓度过高而导致的低效率代谢和有毒副产物的过度积累,又避免了因必要营养物质的耗尽而导致的细胞生长停滞和死亡。因此,由于细胞生长营养环境得到了有效的控制,细胞的新陈代谢效率得到大幅度提升,副产物的产生速率大幅度下降(图6)。仅有3.4%的葡萄糖被转化为乳酸,其余均被用于细胞成分的合成和更高效的TCA 循环能量代谢,而在批次培养对照中,有67%的葡萄糖被转化成乳酸,既导致葡萄糖的低效利用,又导致乳酸副产物的积累。

图2 化学计量平衡和加料控制的流加培养工艺中活细胞密度与批次培养对比Fig.2 Comparison of the viable cell density in the perfusion culture developed on stoichiometric balance and feed control to that observed in the batch process

图3 化学计量平衡和加料控制的流加培养工艺中抗体产量与批次培养对比Fig.3 Comparison of the antibody yield in the perfusion culture developed on stoichiometric balance and feed control with that of the batch process
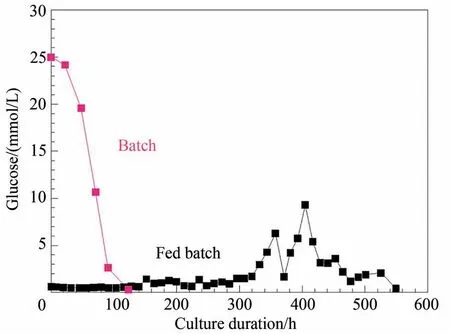
图4 化学计量平衡和加料控制的流加培养工艺中葡萄糖控制情况与批次培养对比Fig.4 Comparison of the glucose control index of the perfusion culture developed on stoichiometric balance and feed control with that of the batch process

图5 化学计量平衡和加料控制的流加培养工艺中谷氨酰胺控制情况与批次培养对比Fig.5 Comparison of the glutamine control for the perfusion culture developed on stoichiometric balance and feed control with that of the batch process

图6 化学计量平衡和加料控制的流加培养工艺中副产物乳酸和氨产生速率与批次培养对比Fig.6 Comparison of the byproduct lactic acid and ammonia production for the perfusion developed on stoichiometric balance and feed control with those of the batch process
为验证化学计量模型的通用性,还针对表达γ-干扰素蛋白的CHO 细胞无血清培养流加工艺进行了初步优化。采用间歇式的手动加料方式,在T 形培养瓶培养实验中,化学计量平衡的培养基设计和加料同样可以将葡萄糖和氨基酸浓度控制在一个相对稳定的水平。与批次对照培养比较,活细胞密度提高2 倍以上,γ-干扰素蛋白产量从7.6 mg/L 提高到30 mg/L 的水平[95]。
2000 年,王义翘教授的学生邱紫文博士毕业后回台湾任教,将动物细胞的化学计量模型完整地应用到昆虫细胞流加培养中并得到了良好的结果[96]。与经典的流加培养工艺对比,采用化学计量模型平衡和控制的昆虫细胞流加培养工艺,SF21 细胞密度提高了3 倍,达到1.7×107细胞/mL,白介素5 蛋白表达量也得到了大幅度提高。尽管昆虫细胞培养与哺乳动物细胞培养有较大的不同,然而物质守恒和能量守恒的定律不变,细胞的新陈代谢化学反应原理不变,因此动物细胞的化学计量模型和昆虫细胞基本一致,只是细胞的成分有差别,细胞的副产物产生速率有差别,维持细胞生长速率所需的各种关键营养物质最佳浓度有差别。该研究进一步验证了化学计量模型在优化流加细胞培养工艺中的广泛应用价值。
根据多轮化学计量平衡和控制的流加细胞培养实验所测定的细胞生长,各营养成分的加入量、消耗量、副产物的产生以及目标抗体的合成等实验结果,采用化学剂量模型中涉及的化学反应网络,本文作者对各种营养成分的实际代谢路径和效率进行了系统分析[97],还对细胞的整个能量代谢网络进行了解析[98]。上述分析对动物细胞探索在不同的营养环境下的新陈代谢规律提供了重要的数据,为后续进一步修正和优化化学计量模型以及流加工艺提供了很多重要的线索和实验依据。
在详细发表上述模型、培养基配方、流加策略以及多轮实验结果后,该研究在学术界和工业界产生了强烈反响。应工业界的要求,笔者在王教授实验室从事博士论文研究的最后一年,指导硕士研究生共同完成了动物细胞化学计量模型通用软件的开发。此后,该软件系统被广泛免费提供给加入MIT 生物技术工程中心生物制药工业联盟的制药企业会员并被应用于支持其商业化产品的生产工艺开发和优化。
王义翘教授实验室自20 世纪70 年代开始开展的细菌发酵和动物细胞培养相关研究工作,奠定了90 年代动物细胞培养应用于单克隆抗体和重组蛋白药物商业化生产工艺的基础。在抗体药物产业化初始阶段,王教授实验室开展的动物细胞高密度培养系列研究对后续30 年抗体药物大规模高效率流加生产工艺的广泛商业化应用和不断发展起到了重要的支撑和推动作用。
5 动物细胞培养过程中大分子蛋白的糖基化修饰多样性分析和调控
王义翘教授实验室不仅在动物细胞培养生产工艺开发和优化上做出奠基性贡献,还在20 世纪90 年代初期就开始对重组蛋白药物的糖基化修饰多样性进行了比较系统的研究。单克隆抗体和γ-干扰素等蛋白质药物的糖基化存在2 个维度的多样化:一是糖基化位点的糖基化修饰多样化,即宏观多样性(macroheterogeneity),如有些位点的糖基化修饰比例很高,而有些位点的糖基化修饰比例可能较低,且随培养条件、培养时间动态变化;二是蛋白上的糖链结构存在多样性,即微观多样性(microheterogeneity)。糖链结构对蛋白质的性质、稳定性、代谢、生物学功能都可能有重要意义。举例来说,抗体药物的糖基化位点位于抗体的重链恒定区,糖链参与和影响抗体与免疫细胞上的Fc 受体(CD16a,CD16b,CD32a,CD32b,CD64)和FcRn分子的结合,对抗体的药代动力学、Fc功能(如ADCC、CDC、ADCP生物活性)均可能有重要影响[99-104]。
王教授的学生Harmon B.博士在20世纪90年代初期开始探索基质辅助激光解吸电离飞行时间质谱(MALDI/TOF mass spectrometry)技术应用于蛋白质糖基化多样性的快速分析和监测[105],建立了高灵敏度2 h 快速分析蛋白质各糖基化位点糖链结构多样性的技术,为实时动态研究和检测细胞培养环境、过程参数对蛋白质和抗体药物糖基化多样性变化,控制大分子生物药糖基化关键质量参数提供了重要的手段。在此基础上,王教授的博士生顾学军对CHO 细胞表达γ-干扰素蛋白糖基化及唾液酸修饰情况进行了分析,研究了无血清培养过程中添加蛋白水解物对CHO 细胞代谢及γ-干扰素蛋白唾液酸修饰程度的影响,并成功通过添加N-乙酰基甘露糖胺(N-acetylmannosamine)对唾液酸修饰进行优化,以达到提高唾液酸修饰比例的目的[106-110]。利用CHO 细胞连续培养可以实现细胞培养环境稳态控制的特点,王教授的博士生Nyberg G.和Balcarcel R.与Harmon B.合作,系统研究了细胞培养环境和代谢中间产物对γ-干扰素蛋白糖基化修饰程度的影响[110-111],为控制蛋白质药物糖基化特性提供了重要的线索。
6 动物细胞培养过程中剪切力对细胞生长和活率的影响研究
动物细胞在搅拌式生物反应器中高密度悬浮大规模培养已经成为重组蛋白药物、单克隆抗体药物和基因工程疫苗类产品的主流生产技术。由于需要连续不断地将空气中的氧气传递到液体培养基中的细胞,并将细胞新陈代谢产生的二氧化碳移除出生物反应器,机械搅拌和空气鼓泡是大规模动物细胞培养的必要手段,也是工艺放大的关键和难点。这是因为动物细胞没有细胞壁的保护,细胞膜对剪切力很敏感,在细胞培养生物反应器中无法耐受高速搅拌和鼓泡所产生的剪切力。
王义翘教授早在20 世纪60 年代末就开始研究流体力学对动物细胞死亡的影响。为了模拟细胞在搅拌式生物反应器中所经受的剪切力并能准确计算剪切力,Augenstein D.C.设计了一个毛细管装置让动物细胞在含10%牛血清的培养基悬浮液中多次通过毛细管并测定细胞死亡率,建立了细胞死亡速率与剪切力的关联关系,为细胞培养生物反应器的设计、培养工艺放大以及生物反应器的控制提供了基础性的依据[112]。原代细胞的微载体贴壁培养所用的微载体直径远大于单个动物细胞的直径,因此,贴附在微载体上的动物细胞对搅拌所产生的剪切力更敏感,容易导致细胞脱落后死亡。王教授的博士生Croughan 在80 年代对FS-4 细胞微载体培养搅拌式生物反应器中的流体力学和湍流所产生的剪切力进行了系统模拟分析和计算,系统研究了搅拌速度对细胞的生长和死亡速率的影响[27,113],以及培养液黏度对减轻湍流所产生的剪切力和细胞损伤的影响[31]。90 年代,王教授的博士生Orton 和Meier 先后对细胞培养生物反应器中空气鼓泡导致的损伤和死亡进行了全面系统的研究[114-116]。Orton采用荧光示踪法全程记录了气泡从液体中上升并浮出水面破裂过程中细胞死亡的情况,发现细胞死亡主要发生在气泡破裂的瞬间。模拟计算显示,气泡破裂时可产生巨大的剪切力并足以撕裂细胞。她还比较了不同浓度的多种表面活性剂,如PF68,对降低空气鼓泡导致的细胞死亡作用的影响。Meier 在此基础上,进一步研究了PF68 等高分子表面活性剂分别对气泡在上升阶段和破裂时细胞死亡的影响[115-116]。
本文作者在默克公司工作期间带领学生对不同表面活性剂PF68 浓度对细胞吸附、死亡的影响首次进行了准确测定[117]。结果显示,在PF68低浓度情况下,细胞被大量富集到气泡表面,气泡层的细胞密度可以达到反应器中细胞密度的10 倍。当PF68浓度提高到1 g/L 时,气泡层的细胞密度仅为反应器中细胞密度的一半左右。因此,在无血清培养基中添加PF68 等高分子表面活性剂对细胞的保护作用主要是降低气泡对细胞吸附并在气泡层的富集作用。
7 细胞培养技术的未来方向和应用前景
王义翘教授团队在20 世纪90 年代及以前针对动物细胞培养技术开展的奠基性研发,推动了90 年代至今全球生物技术产业的快速发展,高密度动物细胞流加培养技术已经成为单克隆抗体规模化生产的主流技术。在此基础上,过去30 年,生物药产业化技术在三个方面取得了重要进展:①分子生物学技术的进步持续推动目标蛋白表达载体的不断优化,稳定高产细胞株获取成为可能;②高通量细胞克隆筛选技术(如流式细胞分选仪和ClonePix 细胞克隆系统)的推广应用,使细胞株的表达水平不断提高;③通过对特定单克隆细胞株的培养基及培养条件优化,以流加培养方式,活细胞密度达到107细胞/mL 已成为常态,因此,单克隆抗体产量已普遍超过3 g/L。
由于单克隆抗体药物的临床应用价值得到广泛验证,临床需求大的品种往往需要采用10 000 L 以上规模的生物反应器进行商业化生产。国际主流生物制药企业大多建成了12 000 L、15 000 L 细胞培养规模的商业化生产线。尽管理论上反应器规模可以进一步提高,但随着培养规模的扩大,下游纯化成本成为主要瓶颈,因此进一步放大细胞培养生物反应器的风险收益比不再具有吸引力。近年来,采用设备投资小、建设周期短、车间GMP 认证快、不要对固定式生物反应器进行清洗和消毒的一次性生物反应器(如2000 L)开展产业化,得到了中小型生物技术企业的青睐,尤其是在我国得到了快速推广和应用,对我国生物制药领域的高速发展起到了重要的推动作用。
可以预见,随着重组蛋白药物、单克隆抗体药物、双特异性抗体药物、抗体药物偶联物(ADC)、CAR-T 细胞治疗、重组蛋白疫苗、病毒样颗粒疫苗等生物药的开发和商业化,细胞培养技术(动物细胞、T 细胞、昆虫细胞培养)将得到越来越多的应用,推动生物产品的不断发展和进步。王义翘教授团队数十年前奠定的基础仍将不断发挥重要作用。
8 总结
王义翘教授自20 世纪60 年代开始,以其前瞻性的洞察力和深厚的工程学背景,对哺乳动物细胞培养技术进行了数十年全面系统的研究和优化,尤其是在80 年代中期,领导组建了美国唯一的生物工程技术中心(BPEC),汇集了MIT 化工系、生物系以及世界各地不同领域的教授专家进行交叉学科的研究和探索,为90 年代开始的全球重组蛋白、单克隆抗体和基因工程疫苗等生物技术产品的蓬勃发展奠定了坚实的理论和工程基础,做出了不可磨灭的伟大贡献。本文限于作者自身的专业知识和在王义翘教授实验室的短暂经历,仅对王教授在动物细胞培养及相关领域的奠基性工作进行了粗浅的概述。王教授培养的学生遍布世界各国主流的生物制药企业并成为推动生物工程技术不断发展的核心力量,将王义翘教授的思想和品德不断传承下去,推动人类健康事业的不断发展。王义翘教授永垂不朽!

