Rho GTP酶激活蛋白9基因在急性髓细胞白血病中的作用机制
吕国庆,魏秀丽,吴隼
(1.a.新乡医学院第一附属医院 血液科;b.生命科学中心,河南 新乡 453100;2.新乡市白血病分子诊疗重点实验室,河南 新乡 453100;3.新乡医学院第五附属医院/新乡市第一人民医院 血液科,河南 新乡 453000)
急性髓细胞白血病(acute myeloid leukemia,AML)是造血系统的一种常见恶性肿瘤,其特征是未成熟的异常原始细胞不受控制地恶性增殖和正常血细胞的生长抑制。目前造血干细胞移植和化疗是AML的常规治疗方法,虽然造血干细胞移植是根治AML的方法,但是由于平均年龄(多数患者年龄在60岁以上)、移植配型、经济状况和个人意愿等原因,多数患者失去造血干细胞移植机会,因此AML患者整体预后仍较差[1-3]。目前AML的分子机制仍不清楚,所以研究AML的分子机制,开发新型、高效、低毒的靶向治疗药物对提高AML的治疗效果具有重要的临床意义。Rho GTP酶激活蛋白9(Rho GTPase activating protein 9,ARHGAP9)是Rho GTP酶激活蛋白(Rho GTPase activating protein,Rho GAP)家族的成员,Rho GAP促进与GTP结合的Rho GTPases的水解,从而使Rho GTPases转化为非活性的GDP结合状态,并抑制多种细胞过程,例如基因转录、细胞骨架重构、细胞增殖、迁移和侵袭[4-8]。本研究旨在探讨ARHGAP9基因在AML患者中的表达及其对预后的影响,用基因集富集分析方法探讨其在AML中的分子机制,探讨其生物学功能和分子生物学机制。
1 材料与方法
1.1 临床样本选择2016年1月至2018年12月在新乡医学院第一附属医院初诊的52例AML患者作为研究对象。AML的诊断根据AML的相关指南和诊疗规范进行[9-12]。留取患者的骨髓液或者外周血样本。选择48例健康者骨髓液或者外周血样本作为对照组。用人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司)分离AML患者及健康者骨髓液或外周血细胞,按照标准操作规程进行。本研究经新乡医学院第一附属医院医学伦理委员会审核批准通过。患者签署知情同意书。
1.2 细胞系和细胞培养AML细胞系SKNO-1、Kassumi-1细胞培养方法:两种细胞均是悬浮细胞,使用内含青链霉素混合液、10%(体积分数)胎牛血清的RPMI-1640培养基,置于37 ℃、湿度饱和、含5%(体积分数)CO2的恒温细胞培养箱中培养,隔天传代。
1.3 癌症基因组图谱数据分析对癌症基因组图谱(the cancer genome atlas,TCGA)数据库中的AML和其他肿瘤的基因表达数据和临床数据进行分析,对ARHGAP9基因的表达进行分析, 同时下载临床资料数据, 进行临床参数及预后分析。
1.4 RNA提取和转录逆转录、定量反转录聚合酶链式反应(quantitative reverse transcriptase-mediated polymerase chain reaction,qRT-PCR)试剂盒、qPCR试剂盒购自Promega公司。使用Trizol(Invitrogen公司)提取总RNA。加入TRIzo、氯仿,4 ℃下,11 000×g离心15 min。把水相转移到新管中,加入异丙醇,沉淀水相中的总RNA,4 ℃下,11 000×g离心10 min,弃上清。用体积分数为75%的乙醇溶液洗涤RNA沉淀。加入25 μL无RNase水,充分溶解RNA沉淀。用RT-PCR试剂盒合成cDNA。用实时定量PCR试剂盒、ABI 7300系统(ABI公司)对ARHGAP9基因进行PCR定量检测。qPCR引物:上游引物为5’-TGAGAATTCTGGCTACATGCAGCCG-3’;下游引物为5’-CCACTCGAGATGACCGGAAATATGTTTCTC-3’;看家基因GAPDH上游引物为5’-CTCCCATCTGGCAGGTAAC-3’;下游引物5’-CCACCTGTTGCTGTAG-3’。PCR 反应条件如下。第一步,预变性:95 ℃,15 min。第二步,PCR反应:95 ℃,10 s;60 ℃,30 s,40个循环。第三步,溶解曲线分析。ARHGAP9mRNA定量用2-ΔΔCt方法进行计算(△Ct为目的基因Ct值与看家基因Ct值之差;△△Ct值为实验样品△Ct与对照样品△Ct之差)。所有数据设置5个平行重复。
1.5 小干扰RNA转染将AML细胞系SKNO-1、Kassumi-1细胞接种到6孔板上,密度为每孔3×105个细胞。ARHGAP9小干扰RNA(siRNA)5’-GGAACAATGATGTCCTGCAACCTCA-3’或对照siRNA(NC)(上海吉玛制药技术有限公司),在细胞进入对数生长期时,使用Lipofectamine 3000(Invitrogen公司)进行siRNA转染,转染48 h后,收集细胞,为后续实验收集和处理。
1.6 细胞增殖实验ARHGAP9siRNA或对照siRNA(NC)转染AML细胞系SKNO-1、Kassumi-1细胞48 h后,按照每孔1×103个细胞接种至96孔细胞培养板。在第0、24、48、72 h用CCK-8细胞增殖检测试剂盒检测细胞增殖情况。
1.7 基因集富集分析采用基因集富集分析4.0.3软件对TCGA中AML的RNA-seq表达数据进行基因集富集分析。参照基因集来源于分子标签数据库(molecular signatures database, MsigDB)[13]。
1.8 统计学方法采用R 3.5.0、SPSS 22.0和GraphPad Prism 7.0软件处理数据。 骨髓液或外周血细胞中ARHGAP9的mRNA水平比较采用t检验,采用log-rank检验进行Kaplan-Meier生存分析。采用描述性统计方法对患者的临床资料进行分析,组间比较采用Mann-WhitneyU检验、t检验和卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1ARHGAP9基因在AML中的表达水平通过对TCGA数据库中AML的基因表达数据进行分析,发现AML患者体内ARHGAP9基因的表达水平高于健康者(P<0.05)。采用人外周血淋巴细胞分离液分离AML患者和健康者的骨髓液或外周血细胞,提取总RNA,qRT-PCR检测AML细胞中ARHGAP9基因的表达水平,发现AML样本中ARHGAP9基因的表达水平高于健康者(P<0.05)。见图1。
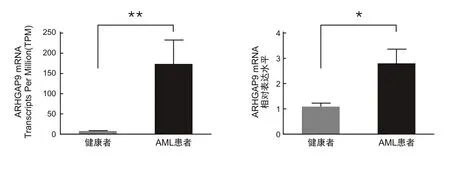
ARHGAP9为Rho GTP酶激活蛋白9;AML为急性髓细胞白血病。
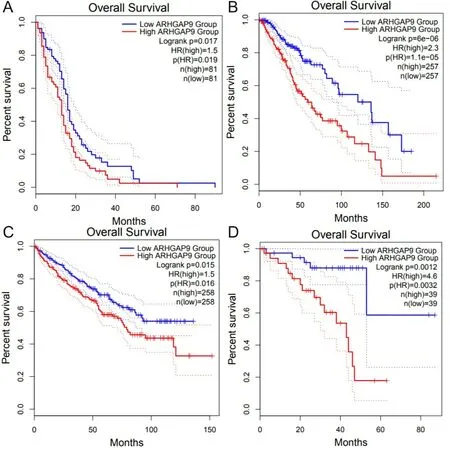
2.2ARHGAP9基因与AML患者临床预后的关系对TCGA数据库中AML的RNA-seq表达数据及临床数据进行分析,发现在AML中ARHGAP9基因的高表达与患者的低生存率相关。见图2。
2.3ARHGAP9基因表达与AML患者临床各参数及分子特征的关系按照ARHGAP9基因表达中位数将TCGA数据库中AML的基因表达数据分为高、低表达两组,分析ARHGAP9基因表达高低与AML患者临床各参数及分子特征的关系。结果发现ARHGAP9基因表达高低与年龄、性别、白细胞数量、骨髓中原始细胞比率、外周血原始细胞比率无关;ARHGAP9基因的低表达与FAB-M3、FAB-M5亚型相关(P<0.001,P=0.029);ARHGAP9基因的高表达与FAB-M1亚型相关(P=0.047)。在细胞遗传学方面,ARHGAP9基因的高表达与正常核型及复杂核型相关(P=0.045,P=0.038),ARHGAP9基因的低表达与FAB-M3中常见的染色体异常t(15;17)相关(P<0.001)。ARHGAP9基因表达与其他FAB亚型无相关性,与inv(16)/CBFβ-MYH11、t(8;21)/RUNX1-RUNX1T1无相关性。此外,ARHGAP9基因的低表达与AML的良好预后相关,而ARHGAP9基因的高表达与AML的中等预后相关。在AML的突变基因中,ARHGAP9基因的表达与常见的突变类型如FLT3、NPM1、DNMT3A、IDH1、IDH2、TP53I无相关性。见表1。
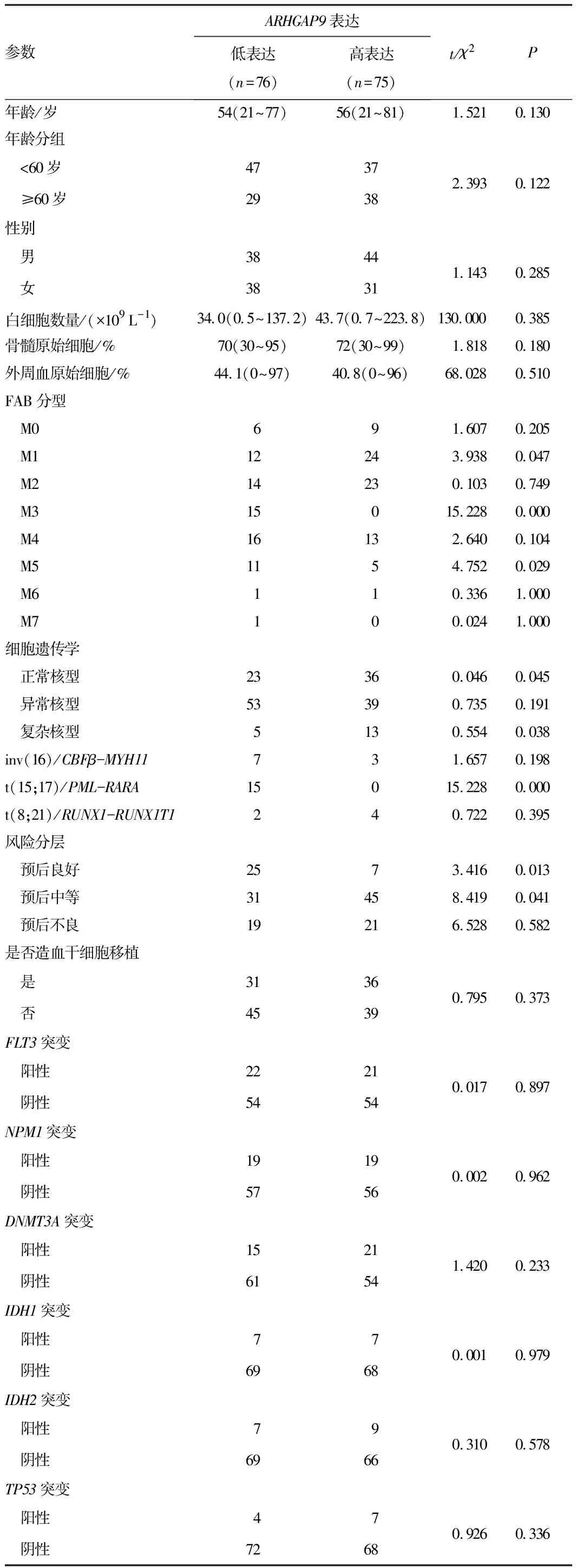
表1 ARHGAP9基因表达与AML临床参数的关系
2.4ARHGAP9基因表达与其他肿瘤生存预后的关系对TCGA数据库中多种肿瘤的基因表达数据及临床数据进行分析,发现除AML之外,在其他多种肿瘤如多形性胶质母细胞瘤、脑胶质瘤、肾嫌色细胞癌和葡萄膜黑色素瘤中ARHGAP9基因的高表达与患者的低生存率相关。见图3。
2.5ARHGAP9基因对AML细胞增殖的影响将处于对数生长期的AML细胞系SKNO-1、Kassumi-1细胞用ARHGAP9siRNA或对照siRNA(NC)转染48 h后,收集细胞,提取总RNA,逆转录,检测ARHGAP9siRNA的干扰效果,结果发现在AML细胞系SKNO-1、Kassumi-1细胞中,干扰效果分别约75%和60%,可用于下一步实验。在ARHGAP9siRNA作用0、24、48、72 h后,AMLSKNO-1、Kassumi-1细胞系细胞的增殖减弱,与对照组比较,差异具有统计学意义(P<0.05),说明ARHGAP9siRNA处理后,AMLSKNO-1、Kassumi-1细胞系细胞的增殖受到抑制。见图4。
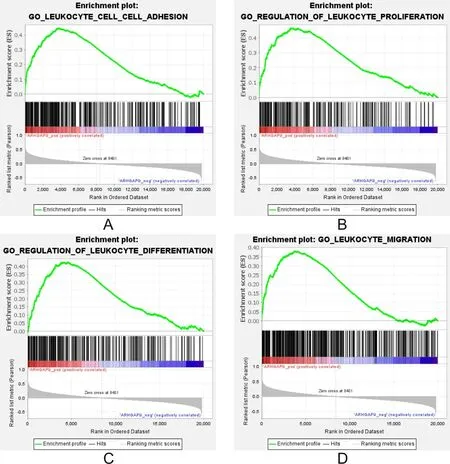
2.6ARHGAP9基因在AML中的生物学功能对TCGA数据库中AML的基因表达数据进行基因集富集分析,发现ARHGAP9基因与细胞黏附、白细胞增殖、移动、分化等生物学功能呈正相关。见表2和图5。

ARHGAP9为RhoGTP酶激活蛋白9;AML为急性髓细胞白血病。
A为多形性胶质母细胞瘤;B为脑胶质瘤;C为肾嫌色细胞癌;D为葡萄膜黑色素瘤;ARHGAP9为Rho GTP酶活性蛋白9。

A为ARHGAP9 siRNA在Kassumi-1细胞中的敲降效果;B为ARHGAP9 siRNA对Kassumi-1细胞增殖的影响;C为ARHGAP9 siRNA在SKNO-1细胞中的敲降效果;D为ARHGAP9 siRNA对SKNO-1细胞增殖的影响。

表2 ARHGAP9基因与AML的生物学功能
2.7ARHGAP9基因与AML相关信号通路的关系用基因集富集分析对TCGA中的AML数据进行分析,研究ARHGAP9相关的KEGG信号通路,发现ARHGAP9与MAPK、VEGF、NOTCH、JAK-STAT信号通路呈正相关。见表3和图6。

表3 ARHGAP9基因与AML相关信号通路的关系
A中ES=0.45,NES=2.46,P<0.001;B中ES=0.47,NES=2.39,P<0.001;C中ES=0.47,NES=2.28,P<0.001;D中ES=0.38,NES=2.14,P<0.001;ES为富集分数;NES为归一化富集分数;ARHGAP9为Rho GTP酶激活蛋白9;AML为急性髓细胞白血病。
2.8ARHGAP9基因的相互作用蛋白用蛋白质相互作用在线分析软件STRING(https://string-db.org/)对ARHGAP9基因进行相互作用蛋白分析,发现ARHGAP9基因与众多Rho GTPase酶家族成员可发生相互作用,如:RAC1、RAC2、RAC3、CDC42、RHOA、RHOB、RHOC、RHOG、RHOH、RHOU等。提示ARHGAP9基因可以作用于众多小G蛋白,从而发挥广泛的生物学作用。见图7。
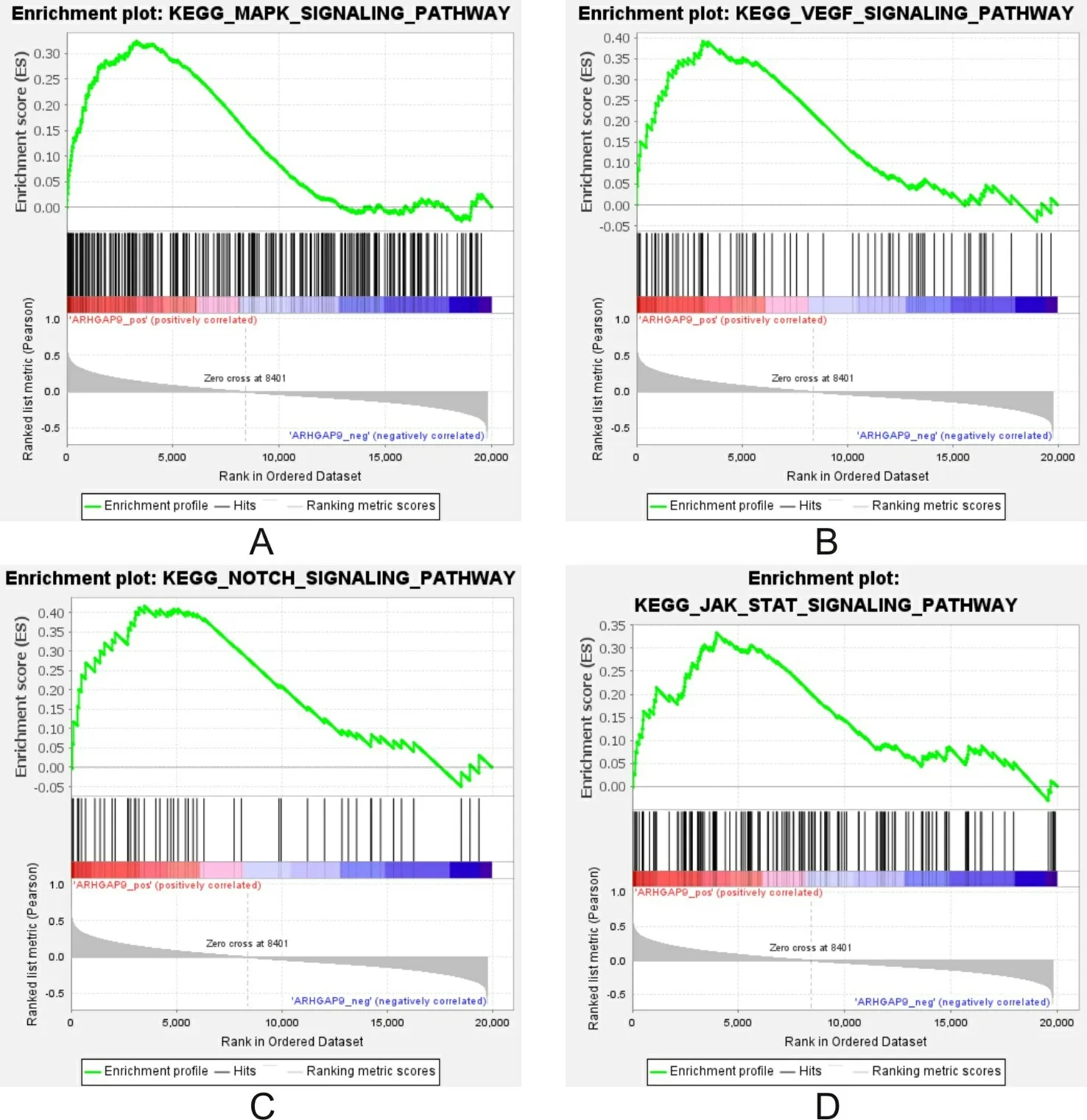
A中ES=0.32,NES=1.72,P<0.001;B中ES=0.39,NES=1.68,P=0.003;C中ES=0.42,NES=1.68,P<0.001;D中ES=0.33,NES=1.65,P<0.001;ES为富集分数;NES为归一化富集分数;ARHGAP9为Rho GTP酶激活蛋白9;AML急性髓细胞白血病。

RAC2为RAC家族小G蛋白酶2;RAC1为RAC家族小G蛋白酶1;RHOA为Ras同源基因家族成员A;CDC42为细胞分裂控制蛋白42;RAC3为RAC家族小G蛋白酶3;RHOB为Rho相关GTP结合蛋白RHOB;RHOC为Rho相关GTP结合蛋白RHOC;RHOU为Rho相关GTP结合蛋白RHOU;RHOG为Rho相关GTP结合蛋白RHOG;RHOH为Rho相关GTP结合蛋白RHOH;ARHGAP9为Rho GTP酶激活蛋白9。
3 讨论
AML是血液系统最常见的恶性肿瘤之一,异质性强,总体预后不良,其分子机制不完全清楚,筛查与AML发生和发展有关的相关基因和标志物具有重要价值。本研究发现AML患者ARHGAP9基因表达水平较健康者升高,而且其高表达与不良预后相关。在其他多种肿瘤如多形性胶质母细胞瘤、脑胶质瘤、肾嫌色细胞癌和葡萄膜黑色素瘤中ARHGAP9基因的高表达与患者的低生存率相关。在新乡医学院第一附属医院AML临床样本中也发现ARHGAP9基因表达水平高于健康者。有研究表明在乳腺癌、胃癌患者中ARHGAP9基因表达水平升高,而且与不良预后相关[6-7]。这些研究结果提示,ARHGAP9基因是癌症的不良预后基因,与癌症的发生发展密切相关。
体外实验将ARHGAP9siRNA转染AML细胞系SKNO-1、Kassumi-1细胞后,细胞中ARHGAP9基因表达水平下降,细胞增殖受抑制。有研究发现ARHGAP9基因 mRNA在乳腺癌中高表达,而且ARHGAP9基因 mRNA的高表达与患者低存活率、临床分期、肿瘤大小和肿瘤分化有关。敲低人乳腺癌细胞中的ARHGAP9基因可抑制MCF-7和MDA-MB-231细胞的增殖、迁移和侵袭能力,促进细胞周期阻滞和细胞凋亡[6]。敲降胃癌细胞系SGC7901中的ARHGAP9可抑制胃癌细胞增殖、行动、侵袭能力和上皮间质转化,ARHGAP9敲降可通过Akt、p38信号通路抑制基质金属蛋白酶2和基质金属蛋白酶9发挥作用[7]。ARHGAP9基因表达与年龄、性别、白细胞数量、骨髓中原始细胞比率、外周血原始细胞比率无关,但是外周血细胞数量与AML生存的关系呈现双相性,低白细胞及高白细胞时预后均不良,中等数量白细胞时患者预后较好,ARHGAP9基因表达与不同数量白细胞分层的研究正在进行中,研究有待发表。ARHGAP9基因的低表达与FAB-M3、FAB-M5相关;FAB-M3是AML中预后最好的类型,长期生存可达正常健康人的水平,在该类型中,ARHGAP9基因均低表达,可能与该类型的发病机制相关;ARHGAP9基因的高表达与FAB-M1相关。在细胞遗传学方面,ARHGAP9的高表达与正常核型及复杂核型相关。预后分层研究发现ARHGAP9基因的低表达与AML良好预后相关,而ARHGAP9基因的高表达与AML中等预后相关。预后分层的结果与FAB-M1亚型及复杂核型患者的不良预后结果一致。在AML的突变基因中,ARHGAP9的表达与常见的突变类型如FLT3、NPM1、DNMT3A、IDH1、IDH2、TP53I不相关。但是因为基因突变的数据较少,可能对结果产生影响,需要更多的数据进行验证。
本课题通过基因集富集分析发现ARHGAP9基因与AML患者的细胞与细胞黏附、白细胞增殖、移动、分化等生物学功能呈正相关,与MAPK、VEGF、NOTCH、JAK-STAT信号通路呈正相关。有研究表明ARHGAP9对Cdc42和Rac1具有GAP活性,而对RHOA无此作用,蛋白质相互作用分析表明ARHGAP9与Cdc42、Rac1及RHOA有相互作用,说明ARHGAP9可以通过RHOA发挥作用。除了充当RhoGAP发挥小G蛋白活化酶的作用外,ARHGAP9还可以通过WW域与丝裂原激活的蛋白激酶相互作用[5]。这与本研究结果一致。
综上所述,本研究发现ARHGAP9基因在AML患者体内表达水平较高,而且其高表达可导致不良预后。所以推测ARHGAP9基因可通过MAPK、VEGF、NOTCH、JAK-STAT等信号通路发挥促进细胞黏附和白细胞增殖、移动、分化等生物学功能,最终导致AML不良预后。提示ARHGAP9基因可能是AML的诊断和预后标志物,可以作为AML靶向治疗的潜在靶点。

