细菌c-di-AMP检测方法的研究进展
张雪琴, 周学东, 彭 显, 程 磊*
(1.四川大学 口腔疾病研究国家重点实验室,四川 成都 610041;2.四川大学华西口腔医院牙体牙髓病科 国家口腔疾病临床医学研究中心,四川 成都 610041)
环二腺苷酸(cyclic diadenylate monophosphate,c-di-AMP)广泛存在于细菌和古生菌中,对细菌的生长至关重要[1]。多种细菌表型的调控依赖于不同的环二核苷酸(cyclic dinucleotides, CDNs),它们构成细胞内信号第二信使系统,环二鸟苷酸(cyclic diguanosine monophosphate,c-di-GMP)、c-di-AMP和环鸟苷腺苷磷酸(cyclic guanosine-adenosine monophosphate,cGAMP)在调控不同细菌功能时兼具复杂性和重要性[2]。自2008年研究者在观察海栖热袍菌(Thermotogamaritima)的DNA完整性扫描蛋白A(DNA integrity scanning protein A,DisA)的晶体结构时,在生物体内发现c-di-AMP至今[2],c-di-AMP已被报道参与调节细菌多种生理功能。其中,DisA的N端结构域被鉴定具有二腺苷酸环化酶(diadenylate cyclase,DAC)活性,它可将两个三磷酸腺苷(adenosine triphosphate,ATP)分子合成c-di-AMP[3-4]。有研究表明,c-di-AMP通过各种方式与不同受体分子结合[5],参与调节细菌多种生理功能[6],包括监测细菌DNA损伤[3-4]、调节枯草芽胞杆菌(Bacillussubtilis)孢子形成[4,7]、调节细胞大小及胞壁稳态[8-10];通过调节细菌钾离子(K+)、渗透物质及镁离子(Mg2+)转运调节渗透平衡及细胞壁应力[10-23]、调节生物膜的形成[24-25]、调节细菌代谢及生长速率[26-28]、调节脂肪酸合成[29-30]、调节细菌对外界刺激的应答(如冷刺激[30-31]、酸刺激[32]等)、调节细菌竞争力[33],进一步影响各种致病菌的侵袭能力。报道显示,c-di-AMP被验证与多种人体致病菌关系密切,包括变异链球菌(Streptococcusmutans)、枯草芽胞杆菌、金黄色葡萄球菌(Staphylococcusaureus)、肺炎链球菌(Streptococcuspneumoniae)、结核分枝杆菌(Mycobacteriumtuberculosis)等。近年的研究证实,c-di-AMP在调节宿主细胞的免疫反应中也起着重要作用[34-35],参与调控宿主I型干扰素免疫应答、调节核因子κB(nuclear factor kappa-B,NF-κB)信号通路、炎症小体及自噬应答等固有免疫应答[36]。随着对c-di-AMP生理作用研究的逐渐深入,c-di-AMP的检测方法也有多项进展。如图1所示,目前检测细菌胞内外的c-di-AMP水平并对其进行定量的方法包括:①应用较为广泛的高效液相色谱质谱(high-performance liquid chromatography/mass spectrometry,HPLC/MS)联用法。②2014年研究者利用肺炎链球菌c-di-AMP特异性结合蛋白(cyclic di-AMP binding protein,CabP)开发出的用于c-di-AMP定量的竞争性酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 法[37],该方法利用生物素标记的c-di-AMP (Biotin-c-di-AMP,B-c-di-AMP)与c-di-AMP在样品或标准品中竞争与CabP结合,实验用CabP蛋白孵育包被孔板,然后用牛血清白蛋白(bovine serum albumin,BSA)进行孵育封闭,在标准品或样品中加入生物素标记和未标记的c-di-AMP混合物,结合的B-c-di-AMP通过辣根过氧化物酶(horseradish peroxidase,HRP)-偶联链霉亲和素孵育检测,与邻苯二胺盐酸盐(o-phenylenediamine dihydrochloride,OPD)底物反应后测定孔板的吸光度来定量c-di-AMP。ELISA法首先在对肺炎链球菌、结核分枝杆菌胞内的c-di-AMP浓度定量中使用,而后在其他细菌中也得到了验证。③2014年有研究者报道利用甲氧檗因(coralyne)与c-di-AMP的特异性结合开发出一种c-di-AMP荧光检测方法[38],发现c-di-AMP与甲氧檗因结合增强了其荧光,而卤化物可以选择性猝灭游离甲氧檗因的荧光。有研究者首先在对变异链球菌的胞内c-di-AMP定量时使用了此种方法,将c-di-AMP与卤素盐溶液混合、加热,冷却至室温,加入甲氧檗因孵育后进行系列光谱测量,根据已知浓度的c-di-AMP标准曲线得出样品中c-di-AMP的浓度。④基于RNA的荧光生物传感器的c-di-AMP成像[39]。该方法主要应用于活细胞,利用在体外和体内表现出配体诱导的荧光激活的生物传感器,通过荧光显微镜和流式细胞术检测c-di-AMP水平。研究者在单核增生李斯特菌活细胞中首次应用,并用该方法发现了某些古生菌及革兰阳性细菌中也存在c-di-AMP。本文就目前以上c-di-AMP的检测方法进展做出总结,以利于研究者更深入地研究c-di-AMP的功能。
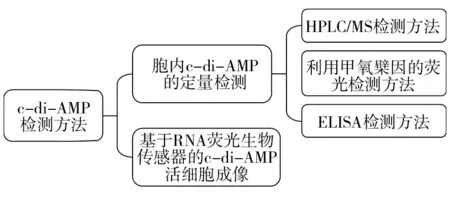
图1 c-di-AMP检测方法Fig.1 The detection methods of c-di-AMP
1 HPLC/MS检测方法
HPLC/MS是在最初确定c-di-GMP为第二信使分子的开创性工作中使用的方法之一,也是如今常用的c-di-GMP、c-di-AMP、cGAMP[40]分离、检测及定量的方法之一。这种检测方法快速且样本制备相对简单,依据不同的检测方法可以对低浓度的c-di-GMP、c-di-AMP进行定量。与此同时,HPLC也能将c-di-GMP、c-di-AMP在细胞提取物中分离出来并与其代谢相关物质如三磷酸鸟苷(guanosine triphosphate,GTP)、5′-磷酸腺苷-3′,5′-鸟苷(5′-phosphoguanylyl-3′-5′-guanosine,pGpG)、ATP、5′-磷酸腺苷-3′,5′-腺苷(5′-phosphoguanylyl-3′-5′-adenosine,pApA)等进行区别。因此,HPLC可以对c-di-AMP、c-di-GMP的合成及分解进行实时监控并用来研究其分解酶和合成酶的酶动力学[41]。
2009年有研究者提出了一种在细菌提取物中定量c-di-GMP的高灵敏度质谱分析方法[42],然而所采用的质谱分析法存在一些校准问题,且还需要繁琐的分离色谱工作来分离c-di-GMP。因此,研究者进一步开发出了一种用于c-di-GMP的灵敏、可靠的定量分析的HPLC/MS方法[43]。而后在这个方法的基础上进行了改进,可以在测定c-di-AMP及c-di-GMP的同时,也能对其二核苷酸代谢产物pApA和pGpG和单核苷酸如一磷酸腺苷(adenosine monophosphate,AMP)和一磷酸鸟苷(guanosine monophosphate,GMP)以及环单核苷酸如环腺苷酸(cyclic adenosine monophosphate,cAMP)和环鸟苷酸(cyclic guanosine monophosphate,cGMP)等进行定量。
HPLC/MS在细菌细胞水平的c-di-AMP检测及定量中使用非常广泛。许多常见致病菌,如枯草芽胞杆菌[3,44-45]、金黄色葡萄球菌[9,46]、耐甲氧西林金黄色葡萄球菌(methicillin resistantStaphylococcusaureus,MRSA)[47]、单核增生李斯特菌(Listeriamonocytogenes)[48]、结核分枝杆菌[49-50]、肺炎链球菌[51]的研究中,从细菌细胞中提取c-di-AMP进行HPLC/MS分析的实验方法已得到大量使用和验证。利用HPLC/MS对c-di-AMP的检测和定量可以对c-di-AMP的酶促反应、分解反应进行监测及验证。研究者将一种控制枯草芽胞杆菌孢子形成检查点响应DNA双链断裂的蛋白质、DisA及100 mmol/L α32P-ATP或α32P-GTP孵育后的产物进行色谱分析,发现在有镁离子(Mg2+)存在时,DisA可将ATP转化为c-di-AMP,但不将GTP转化为c-di-GMP。接着研究者将DisA的产物从ATP中分离出来,负模式质谱分析验证产物确实为c-di-AMP而非其他物质[3],这是研究者初次在生物体内发现c-di-AMP。如图2所示,采用HPLC/MS法测定细菌胞内c-di-AMP的浓度需要培养细菌,按照实验步骤制备提取物样本。通常在此之前需要对样本中的细菌进行定量。为了准确定量,需要使用内部标准,常见的包括c-di-GMP[47]、同位素标记的[13C,15N]c-di-AMP[52-53]或者其他环苷酸分子cXMP[49-50]等。用已知浓度的c-di-AMP生成标准曲线,根据质谱结果中的峰面积量化样本c-di-AMP的浓度。不同的研究者会根据实验条件的不同,如不同的仪器设备、不同的细菌和不同培养条件等对c-di-AMP的色谱质谱分析进行改进、优化。分析测量c-di-AMP相关水解酶的稳态动力学参数时除了对c-di-AMP的水平进行监测,也可采用HPLC法对其代谢产物pApA/pGpG进行监测。
HPLC/MS也可用于分泌型c-di-AMP的衍生化及检测。Huynha等为了测定分泌型c-di-AMP,将单核增生李斯特菌[54]在脑心浸出液肉汤(Brain heart extract broth,BHI)培养液中37 ℃培养过夜,然后接种限定成分培养基,37 ℃培养24 h,离心收集上清。上清液与重标记的c-di-AMP按1∶1(体积比)混合进行质谱分析。也有研究应用离心法从培养基上清液中除去细菌后孵育使所有腺嘌呤分子衍生物化后再进行HPLC分析。通过与纯化的c-di-AMP的曲线和荧光峰面积比较来定量c-di-AMP[55]。
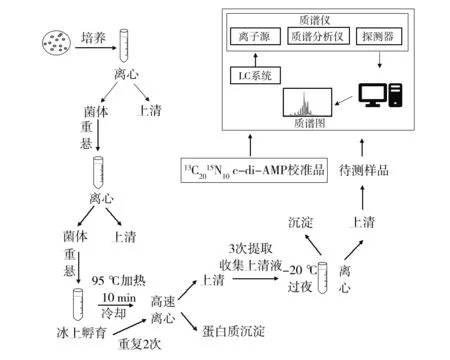
图2 HPLC/MS法检测c-di-AMP的技术流程图Fig.2 Technical flowcharts for determination of c-di-AMP by HPLC/MS
采用HPLC/MS还可从感染结核分枝杆菌的巨噬细胞[56]、感染沙眼衣原体(Chlamydiatrachomatis)的人宫颈癌细胞HeLa细胞[57]中分离出核酸,进行c-di-AMP的分离和检测。采用合成的c-di-AMP作为提取物中c-di-AMP的鉴定和定量标准。将不同致病菌菌株的培养物适当稀释至预定浓度,以预先校准的感染复数(multiplicities of infection,MOI)加入到细胞中培养,然后用杜氏磷酸缓冲液(Dulbecco′s Phosphate Buffered Saline,DPBS)彻底清洗感染细胞,去除细胞外细菌。用DPBS仔细冲洗黏附的巨噬细胞。在每个孔中加入1 mL 0.025%的十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)溶液。在此浓度下,细菌不会被溶解。巨噬细胞被溶解后离心、过滤,汇集巨噬细胞胞质提取物用于提取核苷酸和随后的HPLC/MS检测。
在其他细菌如长链蓝藻藻球菌(Synechococcuselongatus)[58]、卡介苗(Bacillus Calmette Guerin,BCG)[59]、B组链球菌(Group BStreptococcus,GBS)[60-61]、伯氏疏螺旋体(Borreliaburgdorferi)[26]、血清2型猪链球菌(Streptococcussuisserotype 2)[62]、产乳酸杆菌(Lactococcuslactis)[63]、耻垢分枝杆菌(Mycobacteriumsmegmatis)[29]、炭疽杆菌(Bacillusanthracis)[64]的细菌内c-di-AMP水平研究中,均采用HPLC/MS方法进行检测和量化。经过菌株培养、离心收集、重悬提取、孵育煮沸、冷却离心、真空干燥和溶解分析等一系列步骤,进行HPLC分离。将纯化的c-di-AMP生成标准曲线。细胞内c-di-AMP水平以相应的细菌湿重标准化。在对GBS进行c-di-AMP检测及定量时,研究者同时结合使用了文后提到的竞争性ELISA方法,提示不同的测定方法可以联合使用以达到实验目的。
此外,有研究提到薄层色谱法(Thin Layer Chromatography,TLC)可测定c-di-AMP的合成活性,枯草芽胞杆菌和耻垢分枝杆菌的c-di-AMP的合成酶活性测量可通过扫描仪色谱分析c-di-AMP来完成[65]。
2 利用甲氧檗因的荧光检测方法
甲氧檗因荧光法检测c-di-AMP的原理如图3所示,甲氧檗因与含有8个或更多腺嘌呤的聚腺嘌呤形成强复合物,但与短聚腺嘌呤寡核苷酸不形成强复合物。只包含两个腺嘌呤基的c-di-AMP 即使在微摩尔每升的低浓度下也可以与甲氧檗因形成复合物,但pApA或c-di-GMP不会与甲氧檗因形成任何复合物。与多聚腺苷和甲氧檗因形成2∶1复合物不同,c-di-AMP可与甲氧檗因形成更高阶复合物(≥6∶1)。此外,多聚腺苷在结合时降低了甲氧檗因的荧光,而c-di-AMP增强了甲氧檗因的荧光。卤化物的猝灭特性可以选择性地猝灭游离甲氧檗因的荧光。利用这种简单的选择性猝灭策略,使用一个由紫外线、稳态荧光和荧光寿命测量、圆二色光谱(circular dichroism,CD)、核磁共振等组成的仪表盘,可以用来监测DisA合成c-di-AMP或磷酸二酯酶降解c-di-AMP[38]。其中光学测量需要使用光谱仪、荧光分光光度计、荧光寿命成像显微镜系统、分光偏振计[38]。
在之前的研究中,单核增生李斯特菌c-di-AMP合成酶的体外活性可以通过HPLC/MS测量,现在也可通过c-di-AMP与甲氧檗因结合的直接荧光方法测量其形成。与HPLC/MS相比,有研究者认为当锰离子(Mn2+)与钴离子(Co2+)存在时,用这种方法检测到c-di-AMP合成效率更高[66]。也有研究表明,变异链球菌c-di-AMP的体外和体内水平可以通过基于甲氧檗因的荧光检测分析方法来定量。通过甲氧檗因、卤素化合物与样本孵育,并进行荧光测量可以直接定量c-di-AMP以及观察其合成酶的酶促特性[67]。粪肠球菌(Enterococcusfaecalis)的c-di-AMP浓度以及c-di-AMP合成酶DisA活性的测量也用到了这种方法[68]。
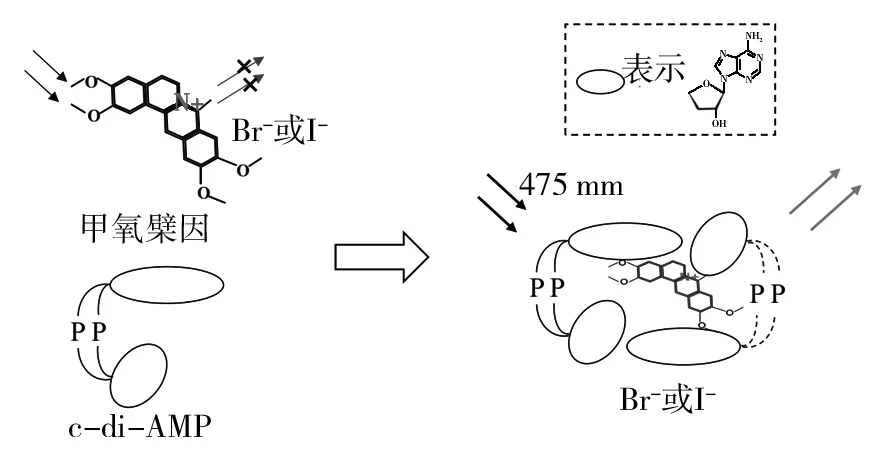
图3 甲氧檗因荧光法检测c-di-AMP的原理示意图Fig.3 Schematic diagram of detecting c-di-AMP by fluorescence fluorescent turn-on assay using coralyne
3 ELISA检测
利用与c-di-AMP具有高度亲和力的肺炎链球菌c-di-AMP结合蛋白CabP的竞争性ELISA法可以用于检测c-di-AMP。这是研究者开发出的一种快速、准确定量生物样品中c-di-AMP浓度的方法。主要利用CabP对c-di-AMP具有的高亲和力,且该蛋白的c-di-AMP结合位点具有极强的特异性。基于竞争性ELISA原理,利用已经商业化生产的生物素标记的c-di-AMP (Biotin-c-di-AMP,B-c-di-AMP)以及生物素链霉亲和素技术,使用B-c-di-AMP与c-di-AMP在样品或标准品中与CabP竞争结合,样品中c-di-AMP浓度越高,所能检测到的B-c-di-AMP就越少。该方法具有高度特异性和灵敏度,检测浓度可以达到10 nmol/L[37]。
具体实验方法可根据不同细菌中的c-di-AMP水平和各种测试条件进行改动。如图4所示,首先需要收集细菌进行样本制备,纯化CabP并在孔板中进行孵育,而后加入牛血清蛋白(BSA)进行孵育。样品、对照组样品及校准品都要在B-c-di-AMP中稀释后加入孔板孵育,在孔板中加入HRP标记的链霉亲和素孵育,再加入底物缓冲液孵育。最后加入硫酸停止反应进行比色。数据采集和分析时,使用标准曲线和适当的校正有利于获得可重复的结果。每个样品的c-di-AMP浓度通过吸光度读数来确定,并将其从对照孔中校正,然后用标准曲线生成的方程来计算。样品中c-di-AMP的含量随后根据稀释因子进行校正,并根据细菌数量或培养物的吸光度值进行标准化。
研究者在许多实验中验证了竞争性ELISA检测方法的可行性,这种方法可对变异链球菌[24]、肺炎链球菌[8,33]、结核分枝杆菌[69]和金黄色葡萄球菌[70]菌体内的c-di-AMP浓度进行定量。表达来自金黄色葡萄球菌阿拉伯糖诱导启动子DacA、YbbR或GlmM蛋白的大肠埃希菌也可采用竞争性ELISA定量细胞内c-di-AMP水平[71]。使用c-di-AMP结合蛋白CpaASP竞争性ELISA方法在基本培养基中培养的金黄色葡萄球菌中可检测到c-di-AMP[72]。

图4 ELISA法检测c-di-AMP的技术流程图Fig.4 Technical flow charts of c-di-AMP detection by ELISA
虽然HPLC/MS对单个样品的分析时间相对较短,且分辨率高、重现性好、结果灵敏度高,但技术培训和设备成本却使得这种方法对许多实验室来说既昂贵又复杂。而测定c-di-AMP的竞争性ELISA方法价格低廉,重复性好,易于操作且可同时测定多个样本。与目前依赖于单独样本的定量方法相比,这是一个巨大的优势,但也存在局限性,该方法的检出限约为10 nmol/L。测定细菌胞内c-di-AMP水平相对简单,测量在培养基中或者在宿主细胞中细菌分泌的c-di-AMP水平要复杂得多。对于某些细菌,培养基中的c-di-AMP水平可能无法直接检测到,需要在检测前对样本进行浓缩。此外,培养基中的成分可能会影响检测结果,因此研究者建议使用这种方法检测分泌型c-di-AMP时,最好用化学定义培养基[69]。
4 基于RNA荧光生物传感器的c-di-AMP活细胞成像
通过将Spinach2适配体与c-di-AMP核糖体的配体结合区域融合,生成了用于c-di-AMP的荧光生物传感器。该生物传感器用于可视化单核增生李斯特菌活菌细胞内c-di-AMP水平,并确定磷酸二酯酶PdeA的催化区域。研究者利用流式细胞仪对艰难梭状芽胞杆菌(Clostridiumdifficile)和詹氏甲烷球菌(Methanocaldococcusjannaschii)的二腺苷酸环化酶活性进行了筛选,验证了其酶活性,并将该法用于革兰阳性细菌的体内代谢产物成像,验证了来自古生菌的第一个二核苷酸环化酶。
c-di-AMP的直接检测方法包括HPLC/MS、竞争性ELISA法等,但都局限于体外检测。于是研究者开发了两种基于RNA的c-di-AMP生物传感器,它们在体外和体内表现出配体诱导的荧光激活。利用荧光显微镜和流式细胞术检测单核增生李斯特菌活细胞中c-di-AMP的水平,发现了基于RNA的生物传感器在革兰阳性菌中的应用。
这种检验方式的优点在于两种生物传感器均具有单一配体结合位点,且提供了良好的动态检测范围。yuaA-Spinach2的体外荧光信号在10%~90%之间时,可检测的c-di-AMP浓度范围为3.2~260.0 μmol/L,而与Sc1-Spinach2结合的c-di-AMP可测浓度范围是0.37~30.00 μmol/L,可以检测跨越4个数量级的c-di-AMP浓度。对于c-di-AMP的细胞内检测,yuaA-Spinach2由于其背景荧光较低被首选。虽然此前没有对c-di-AMP水平进行过体内测量,但对枯草芽胞杆菌和金黄色葡萄球菌培养的细胞提取物的HPLC分析表明,细胞中c-di-AMP的微摩尔浓度很低。因此,这种生物传感器应该能够检测生理相关浓度的c-di-AMP。
然而,这种传感器也存在不足。要监测细胞和环境条件可能导致的c-di-AMP水平的细微波动,灵敏度和荧光开启特性需要改进。此外,由于荧光信号的不稳定性,需要发展在不同条件下对荧光信号进行规范化的稳健方法[39]。可测量的c-di-AMP浓度相对较低,且范围较局限。目前关于这种方法的应用报道较少。
5 展 望
c-di-AMP主要通过改变其胞内含量来调节细菌生理功能[73],因此对于细胞内c-di-AMP的定量研究显得尤为关键。但在很多情况下,由于目前检测方法的局限性,c-di-AMP无法被检测到,阻碍了对于c-di-AMP功能的进一步认知。为了更深入地认识和了解c-di-AMP生物学功能,需要研究更加便捷且有效的定量检测方法。目前涉及到c-di-AMP检测的技术主流还是基于HPLC/MS方法,各种检测手段也在不断推陈出新,尤其是一些基于c-di-AMP特异性结合受体蛋白的生化方法吸引了更多人的注意。目前对c-di-AMP的定量检测方法均存在一定的局限性。HPLC/MS检测方法实验技术较为复杂,且需要的设备昂贵,其优点在于对单个样品的分析时间相对较短,分辨率高,重现性好,结果灵敏度高等;竞争性ELISA检测方法对样本制备以及实验条件的要求较高,需要纯化的c-di-AMP特异性结合蛋白,但其灵敏度和准确性低于HPLC/MS方法;利用甲氧檗因的荧光检测方法检测c-di-AMP的范围也较局限,不能适用于c-di-AMP检测的大多数情况;基于RNA荧光生物传感器的c-di-AMP活细胞成像也局限于活细胞内的c-di-AMP检测。结合目前的技术方法,认为可以通过优化c-di-AMP结合蛋白氨基酸序列,增加其与c-di-AMP的结合能力,以便开发更灵敏的基于c-di-AMP结合蛋白的ELISA检测方法。通过优化基于RNA的生物传感器检测的RNA序列、二级结构以及精准的RNA浓度,可以提高RNA生物传感器技术的检测灵敏度。除此之外,近期研究发现干扰素基因刺激因子(Stimulator of IFN Gene,STING)是胞质中c-di-AMP的直接受体。因此,在研究细菌宿主相互作用中,有望开发基于STING信号通路的c-di-AMP活细胞检测方法。基于以上思路开发理想的c-di-AMP检测方法以满足灵敏度、准确性、操作简便性、样本制备简易性等的要求,为今后研究c-di-AMP在调节细菌与细菌宿主关系中的重要作用提供技术支撑。