数字乳腺断层合成摄影对超声诊断为BI-RADS 4、5类≤30岁有症状女性乳腺良、恶性病变的诊断价值
黄峻琳,林青,崔春晓,苏晓慧,费洁,李丽丽,马锦竹,张敏
青岛大学附属医院乳腺影像科,山东 青岛 266100;*通信作者 林青 linqing9180@126.com
数字乳腺断层合成摄影(digital breast tomosynthesis,DBT)能对乳腺进行薄层扫描,减少数字乳腺X线摄影(digital mammography,DM)对重叠乳腺组织的掩盖效应,从而更好地显示病变特征,提高病变检出的敏感度[1-2]。亚洲国家女性的乳腺腺体致密,尤其是年轻女性,而致密的乳腺会增加患乳腺癌的风险[2-3]。目前,对年轻女性使用乳腺X线摄影的研究较少。此外,由于设备的短缺,DBT在中国的临床应用并不广泛。本研究拟探讨DBT对超声诊断为乳腺影像报告与数据系统(breast imaging reporting and data system,BIRADS)4、5类病变的≤30岁有症状女性乳腺良、恶性病变的诊断价值。
1 资料与方法
1.1 研究对象 收集2015年12月—2020年8月在青岛大学附属医院就诊的女性患者资料。纳入标准:①年龄≤30岁,有乳腺临床症状(如可触及肿块、乳头病理性溢液等);②超声检查诊断为BI-RADS 4类或5类;③超声诊断为BI-RADS 4类以下,但有乳头病理性溢液;④均行患侧乳腺DBT、DM检查;⑤经穿刺活检或手术病理证实。排除标准:①有单侧或双侧乳腺癌切除术病史;②有乳腺假体植入术病史。记录患者的年龄、乳腺癌家族史、临床表现。最终纳入716例,年龄20~30岁,中位年龄28岁,其中20~25岁189例,26~30岁527例。本研究经我院伦理委员会批准(QYFYWZLL26498)。所有患者均签署知情同意书。
BI-RADS分类[4]将可疑的恶性病变分为4、5类,且需要活检。由于活检时,不完全或不正确取样可能导致假阴性结果。因此,若活检组织学诊断为良性,则建议进行6个月的影像学随访检查,除外进行手术切除者。如果随访检查结果稳定,则认为活检组织学结果正确。
1.2 仪器与方法
1.2.1 超声检查 采用Siemens ACUSON-S2000、Hitachi EBU-7500彩色多普勒超声诊断仪,探头频率10~14 MHz,对双侧乳腺实质、腋窝、颈部、胸壁及胸骨旁区域行常规超声检查。
1.2.2 DBT及DM检查 采用数字乳腺X线摄影机(Selenia Dimensions System,Hologic,Bedford,MA)对患者进行患侧DBT和DM检查,在Combo模式下同时获得乳腺DBT和DM的头尾位及内外侧斜位片。X射线管在对乳腺进行标准压缩的情况下旋转15°(-7.5°~+7.5°),根据乳腺腺体量进行自动曝光,曝光后经机器自带的计算机后处理软件重建出一系列层厚约1 mm的DBT图像。
1.3 图像分析 采用2013年美国放射学会第5版BIRADS标准[4]进行评估及分类。记录病变的形态,包括肿块、钙化、结构扭曲、不对称。根据DM摄影片判断乳腺腺体构成,a为乳腺内几乎均为脂肪组织,b为乳腺内散在纤维腺体组织,c为乳腺组织密度不均匀,d为乳腺组织极其致密;将a、b归为非致密型乳腺,c、d归为致密型乳腺。
本研究为回顾性分析,排除了BI-RADS 0和6类病变,用BI-RADS 1~5类评估病变。纳入患者的每侧乳房均算作一个单独的检查,每个乳腺中使用最高的评估作为最终结果。将每种病变的BI-RADS类别和每种诊断方法与组织病理学结果进行比较。尽管BI-RADS 4A类需要组织病理学诊断,但良性病变的可能性大于恶性病变(恶性率2%~10%)。因此将BI-RADS 4A类视为阴性结果,以避免由于大量的良性病变而稀释恶性标准[5]。组织病理学证实为非恶性病变者,手术前DBT和DM判定为BI-RADS 3、4A类为诊断符合;组织病理学证实为恶性病变者,术前DBT和DM判定为BI-RADS 4B、4C、5类为诊断符合。
组织病理学结果直接从病理报告中获得。若患者因为活检结果而接受手术治疗,则使用最高的病理组织学结果作为最终结果。切除标本的最终病理结果除非升级为恶性,否则高危病变认为是阴性结果。任何浸润性癌或导管原位癌(ductal carcinoma in situ,DCIS)的病理诊断均被归类为恶性(阳性)结果。
由2位具有2~8年乳腺影像诊断经验的放射科医师采用双盲法分析,首先评估DM图像,并判定BIRADS类别;然后评估DBT图像。对同一图像评估的BI-RADS分类不一致时,通过讨论达成共识。
1.4 统计学方法 采用SPSS 20.0和MedCalc 15.2.2软件。参照BI-RADS分类标准,以组织病理学结果为“金标准”,分析DBT及DM的诊断敏感度、特异度、准确率、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV),采用受试者工作特征(ROC)曲线下面积(AUC)评估诊断效能。计数资料比较采用χ2检验或Fisher确切概率法。采用ROC曲线评价诊断效能,AUC比较采用Z检验。以P<0.05为差异有统计学意义。
特异度定义为某种技术识别非阳性病例的能力,通过将研究人群中的真阴性数除以总阴性数(真阴性+假阳性)计算。真阴性和假阳性的计算包括良性病变和乳腺X线漏诊的病变。如果医师漏诊了良性病变而将病例评分为BI-RADS 1类或2类,则评分错误,但作为真阴性对特异度计算有利。为了量化这个错误,本研究使用以下方法计算特异度:特异度=非恶性病变中诊断为BI-RADS 3、4A类的病变/所有非恶性病变[6]。
2 结果
2.1 临床及病理结果 临床表现:可触及肿块597例(83.4%)、乳头异常溢液86例(12.0%)、乳腺局部疼痛18例(2.5%)、有乳腺癌家族史15例(2.1%)。
最终包括771例病变:①恶性病变207例,包括浸润性导管癌169例、导管原位癌23例、黏液性癌5例、微乳头状癌4例、化生性癌3例、恶性叶状肿瘤1例、小细胞神经内分泌癌1例、浸润性小叶癌1例;②高危病变143例,包括乳腺导管内乳头状瘤83例、良性叶状肿瘤20例、硬化性腺病18例、良性梭形细胞病变10例、放射状瘢痕8例、交界性叶状肿瘤2例、非典型导管上皮增生2例;③良性病变421例,包括乳腺纤维腺瘤286例(图1)、乳腺炎64例、乳腺腺病47例、小叶或间质增生24例。
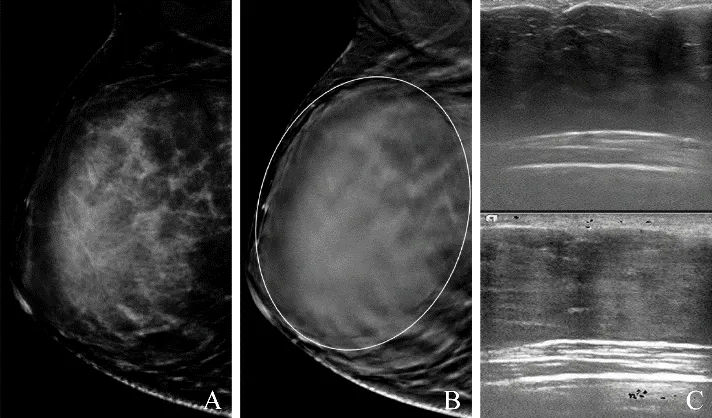
图1 女,20岁,乳腺纤维腺瘤。DM示右乳致密,未见明确病变(A);DBT示右乳见等密度团块影,边缘清楚,几乎占据4/5的腺体组织(圈,B);超声示卵圆形肿块影,边缘清楚,后方回声增强,边缘见少量血流信号(C)
2.2 DBT与DM的BI-RADS分类结果及诊断效能见表1、2。DBT与DM对乳腺恶性、非恶性病变的BIRADS分类差异有统计学意义(χ2=29.64、33.45,均P<0.001),乳腺癌检出率为26.8%(207/771)。DBT的诊断敏感度、特异度、准确率、NPV均高于DM(P<0.01、P<0.001),两者PPV差异无统计学意义(P>0.05)。DBT与DM的AUC比较,差异有统计学意义(Z=4.719,P<0.001),见图2。92.5%(713/771)为致密型乳腺,7.5%(58/771)为非致密型乳腺。

表1 DBT及DM对超声诊断为BI-RADS 4、5类≤30岁有症状女性乳腺病变的BI-RADS分类结果(个病灶)
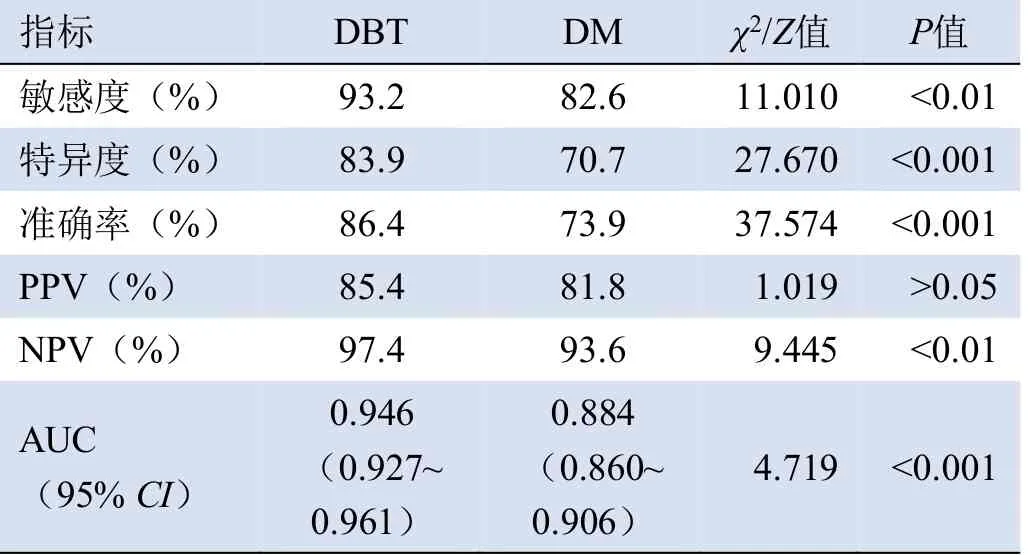
表2 DBT及DM对超声诊断为BI-RADS 4、5类≤30岁有症状女性乳腺病变的诊断效能

图2 DBT及DM诊断乳腺病变的ROC曲线
2.3 DM假阴性病例在DBT图像的形态变化及DM与DBT均为假阴性病例结果 见表3。①单独采用DM检查,有36例假阴性诊断;联合DBT后,22例病变正确诊断为乳腺癌(图3),其中17例浸润性导管癌,4例导管原位癌,1例浸润性小叶癌。②DM和DBT均为假阴性诊断14例,超声检出57.1%(8/14)的乳腺癌;其中7例浸润性导管癌,1例导管原位癌。③DM、DBT、超声均为假阴性诊断6例,其中3例浸润性导管癌,2例导管原位癌,1例黏液癌。④DM、DBT均正确诊断为乳腺癌、而超声为假阴性诊断4例(图4),其中2例浸润性导管癌,2例导管原位癌。
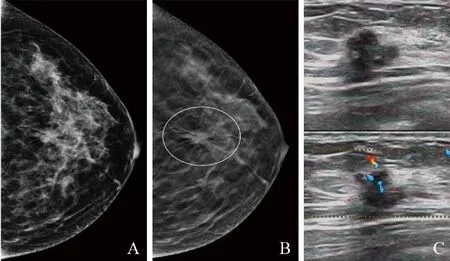
图3 女,29岁,乳腺浸润性导管癌。DM示左乳未见明确病变(A);左乳中线中后带见等密度结节影,边缘见长毛刺影(圈,B);超声示不规则肿块,边缘分叶,见毛刺影,后方伴声影,病变内较丰富血流信号(C)
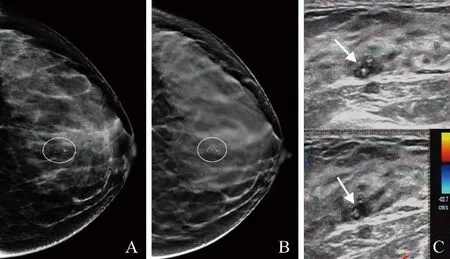
图4 女,28岁,乳腺导管原位癌。DM、DBT及放大图示粗糙不均质钙化,成簇分布(圈,A、B)。超声示小结节状低回声影,边缘欠清,其内可见粗大钙化影,未见明显血流信号(箭,C)

表3 DM与DBT检查乳腺恶性病变的影像形态变化
3 讨论
3.1 DBT在年轻女性乳腺病变中的应用 DBT在乳腺癌筛查和部分临床应用领域取得了进展,由于国际上尚未建议40岁以下女性常规行乳腺癌筛查,目前DBT在年轻女性中的应用鲜有报道。美国放射学会发布的适当性标准[7-9]指出,对于30岁以下有乳腺临床症状(可触及肿块、乳头病理性溢液等)的女性,通常建议进行超声初步成像评估,当超声检查显示可疑结果时,再进一步使用DM/DBT检查评估;若患者有病理性乳头溢液,则需要进行乳腺X线检查,因为可能与导管原位癌有关。此外,乳腺高危病变是一组异质性疾病,本身存在癌变可能[10],因此即使年轻女性也需要评估钙化情况及检出高危病变[8-10]。
本研究中乳腺癌的检出率为26.8%,与Houssami等[11]的研究结果一致,该研究显示乳腺癌患病率的中位数为28%(17%~42%)。尽管上述研究结果表明年轻患者中的绝大多数病变是非恶性病变,但是近年来年轻女性的乳腺癌发病率显著升高,亚洲国家发病率高于3.0%[2,10],并且发病率在20岁以后随年龄增长迅速上升[12]。因此,年轻女性的乳腺病变需要进行完整的影像学评估,以鉴别出恶性病变及高危病变。
DBT的辐射剂量略高于DM,但仍低于乳腺摄影质量标准(mammography quality standards act,MQSA)及食品和药物管理局(food and drug administration,FDA)允许的最大剂量[1,13-14]。另外,FDA于2011年批准了DBT与DM结合使用,因为二维图像提供了概览,并用于评估钙化的分布(当钙化分散在数个DBT切片上时,可能不会被认为是成组分布)。尽管DBT+DM的组合使辐射剂量增加了1倍,但仍低于FDA规定的3 mGy/视图的安全限值[14]。随着合成2D图像的发展,FDA已经批准通过断层图像重建出类似DM的合成2D图像,在仅接受DBT检查时可同时获得3D和2D图像,这种模式可减少患者的辐射剂量[1],可以在今后的临床诊断中进行改进。
3.2 DBT及DM对年轻女性乳腺病变的诊断价值本研究结果表明:DBT较DM具有更高的诊断效能,对BI-RADS分类评估的准确率更高、假阴性率更低。本研究中,DBT检出乳腺癌的敏感度为93.2%,与既往研究报道的75%~100%一致[1-2,15],并且不同年龄组均有差异。本研究中,DM假阴性诊断中61.6%的乳腺癌被DBT检出。另外在检出的乳腺癌结果中,DBT检出较多的肿块伴钙化病变及结构扭曲病变,而DM检出的单纯钙化病变更多,其原因可能是DBT可以减少乳腺腺体组织重叠,增加病变对比度,更好地显示结构扭曲病变及钙化背景下的肿块病变边缘[16],而病变边缘是确定病变良恶性的关键因素之一。当使用为非恶性病变提出的特异度定义时,DBT表现出明显的优势(83.9%比70.7%,P<0.001),与既往研究一致[8]。如果一种成像技术同时具有高敏感度及高特异度,则其临床应用价值非常高,高特异度可以使放射科医师更准确地识别非恶性病变,并对其进行分类。本研究中,DBT的AUC为0.946,较DM的0.884得到改善。既往研究显示DM的AUC为0.76~0.95,DBT为0.84~0.96[3,15],与本研究结果一致。上述结果表明,对于年轻女性,DBT是一种比DM更有效的诊断工具。此外,Chae等[17]研究表明:DBT对诊断效能的提高主要与乳腺致密有关,而本研究中92.5%侧乳腺为致密型。
3.3 对超声诊断为可疑病变的年轻女性应用DBT的必要性 在部分乳腺纤维腺瘤和叶状肿瘤之间可能会误诊,Liberman等[18]研究表明:叶状肿瘤通常直径较大,若病变直径>3 cm,则不能排除叶状肿瘤可能。本研究纳入对象是年轻女性,可能由于激素原因[19],部分病变较大,部分具有类似乳腺癌病变的影像学特征。另外,乳腺X线摄影更容易检出钙化病变,部分可疑钙化尤其是簇状微钙化(如无定形钙化),可能表明存在早期乳腺癌,如导管原位癌[20];本研究中,DM共检出43.5%(90/207)的恶性钙化灶。此外,乳腺高危病变在首诊活检后,在后续手术切除中可能会发现存在DCIS等成分[10],因此确诊后,相应的临床措施会有所不同;本研究中共检出143例高危病变,而假阳性诊断中,61.2%(34/53)为高危病变。因此对此类年轻女性患者,在条件许可的情况下(如非备孕期),可推荐乳腺X线摄影进一步检查。本研究中,8例乳腺癌被DBT认为是阴性结果,最后被超声正确归类为恶性;4例被超声归类为阴性结果,最后被DBT正确归类为恶性。因此,DBT与超声结合的互补应用可以从不同方面反映病变的特征,从而提高诊断准确率。
3.4 本研究的局限性 首先,本研究为回顾性研究,仅在单中心收集病例。其次,本研究纳入对象是超声诊断为BI-RADS 4、5类且有临床症状的年轻女性患者,可能对评估有部分影响,不能完全代表临床诊断流程。希望未来有多中心前瞻性研究数据补充证实本研究结果。
总之,在超声诊断为BI-RADS 4、5类且有症状的年轻女性(≤30岁)中,DBT明显提高了乳腺良、恶性病变的检出率和诊断准确率。在年轻女性患者中,DBT可作为超声的有效补充检查。

