双酚F对斑马鱼早期生命阶段内分泌干扰效应研究
杨倩,刘建梅,丁洁,陈丽红
1. 南京财经大学食品科学与工程学院,南京 210023 2. 江苏雅信昆成检测科技有限公司,南京 210034 3. 南京中医药大学药学院,南京 210023
双酚A(bisphenol A, BPA)广泛用于食品包装材料、奶瓶、水杯以及其他数百种日用品的制造过程[1]。作为一种典型的内分泌干扰物,全球许多国家和地区都出台了法律法规限制双酚A的使用。为了应对管控措施和市场需求,一些结构与BPA类似、可耐受较高温度的化合物被开发用来替代BPA,这些化合物具有2个羟苯基结构,在羟苯基和碳桥具有不同的取代基,统称为双酚A类似物,其中,双酚F(bisphenol F, BPF)在食品和环境样品中均是仅次于BPA的检出量最大的双酚A类似物[2-3]。BPF(系统名4,4二羟基二苯基甲烷,英文名为4,4’-dihydroxydiphenylmethane)和BPA的结构式如图1所示。对日本、韩国和中国采集的河水和海水中,BPF在几个采样点的浓度甚至超过1 000 ng·L-1,而在日本东京的Tamagawa河水中,BPF浓度高达2 850 ng·L-1,已经超过了欧盟规定BPA对水生生物的预测无效应浓度(1 500 ng·L-1)[4]。随着BPF使用量的逐年增加,其污染情况可能会日益严重。

图1 双酚A(BPA)和双酚F(BPF)的分子结构图Fig. 1 Chemical structures for bisphenol A (BPA) and bisphenol F (BPF)
由于BPF的结构与BPA类似,预计可能对生物系统产生同样的毒性效应。一些体内外实验结果表明,BPF具有与BPA相似的雌激素效应。Kitamura等[5]采用MCF-7细胞的荧光素酶报告基因法检测发现,BPF的雌激素活性与BPA处于同一数量级。在H295类固醇生成试验中,BPF能够引起孕激素和雌激素水平的升高,以及雄激素水平的下降[6]。对斑马鱼模式生物的研究发现,对斑马鱼进行60 d的BPF长期暴露能够导致斑马鱼性激素水平紊乱,性别比例向雌鱼偏离[7]。Ullah等[8]的研究表明,BPF具有抗雄激素效应,能够导致氧化应激损伤,进而影响大鼠的生殖功能。化合物的内分泌干扰效应会对生物体正常的内分泌活动产生干扰。生物体的内分泌系统主要由下丘脑-垂体-甲状腺(HPT)轴、下丘脑-垂体-性腺(HPG)轴和下丘脑-垂体-肾上腺(HPA)轴分别控制,这些系统通过调节激素的合成、分泌、贮存、转运和代谢过程来调控内分泌系统,每个内分泌轴与其他内分泌轴相互作用,以协调身体机能[9]。内分泌干扰物(endocrine disrupting chemicals, EDCs)进入生物体内后导致的HPT、HPG和HPA轴的改变,可能会对整个生物体的发育和繁殖机能产生影响。一些研究表明,HPT、HPG和HPA轴间具有交互作用,例如性激素能够通过应激反应,直接或间接调节HPA轴的功能,影响肾上腺皮质激素、糖皮质激素和促皮质醇释放激素(CRH)等的合成和释放[10-13],而CRH又是连接HPT和HPA轴的关键蛋白之一,并且在鱼类中,CRH比促甲状腺激素释放激素(thyrotropin-releasing hormone, TRH)能够更有效地调节HPT轴的功能[12,14]。此外,HPT和HPG轴间也具有交互作用,甲状腺激素水平可能在正常生殖、性类固醇水平和相关酶的基因表达中发挥关键作用[12-16],例如,Zhu等[17]发现甲状腺素(thyroxine, T4)可以促进鲶鱼卵泡的生长,而噻虫嗪降低了稀有鮈鲫体内的T4水平,同时抑制了性腺的发育[18]。
斑马鱼(Daniorerio)的基因与人类基因相似度达到87%,在关键性的蛋白靶点区域相似性接近100%,另外,斑马鱼内分泌系统分子性质和激素信号通路与其他脊椎动物类似,因此,斑马鱼可以作为模式生物用于内分泌干扰的机理研究[19-20]。目前针对BPF的研究多集中在雌激素效应方面,缺少BPF对HPT、HPG和HPA轴的影响及其交互作用研究。因此本文以斑马鱼为研究模型,通过对HPT、HPG和HPA轴激素以及相关基因表达水平的测定,研究BPF对胚胎和仔鱼期斑马鱼内分泌系统的影响及作用机制,以期为BPF潜在的健康风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 材料与试剂
双酚F,CAS号620-92-8,纯度>98%,购于美国J&K公司;用焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)处理过并经高温高压灭菌的超纯水(DEPC水),购于中国上海杰瑞生物工程有限公司;雌二醇酶联免疫试剂盒、睾酮酶联免疫试剂盒、糖皮质激素酶联免疫试剂盒、三碘甲状腺原氨酸酶联免疫试剂盒及四碘甲状腺原氨酸酶联免疫试剂盒(96T),购于中国武汉艾博伊科技有限公司;RNA Later,化学纯,购于美国赛默飞世尔科技公司;Trizol试剂购于美国英杰生命技术有限公司;ReverTra Ace®qPCR RT Master Mix with gDNA Remover试剂盒(200次),购于东洋纺(上海)生物科技有限公司;Sso fast EvaGreen Supermix购于美国伯乐公司;甲醇、乙醇、乙腈均为色谱纯,购于德国Merck公司;水为Milli-Q超纯水。
1.2 仪器与设备
显微镜(DM2500型,德国Leica)、冷冻离心机(2-16PK型,美国Sigma公司)、生态培养箱(CLIMACELL型,德国MMM公司)、高效液相色谱串联质谱仪(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500)、荧光定量PCR仪(CFX96TMOptics型,美国Bio-Rad公司)、酶标仪(Infinite M200型,瑞士TECAN公司)、核酸蛋白分析仪(DU800SERIES型,美国Sigma公司)、多功能水质参数测定仪(HQ40d型,美国HACH公司)、电热恒温培养箱(INNOVA®43型,中国郑州南北仪器设备有限公司)、旋转蒸发仪(R-210型、B-491型、V-850型,瑞士BUCHI公司)。
1.3 实验方法
1.3.1 斑马鱼驯化和胚胎收集
四月龄野生成年斑马鱼(AB型)购于中国科学院武汉水生生物研究所,并在实验室斑马鱼养殖系统中养殖并繁殖了3代以上。系统运行期间,光照/黑暗周期设定为16 h∶8 h(光照∶黑暗),维持温度在26 ℃±1 ℃,每天定时投喂丰年虾2次。
前1天晚上将3条雌性斑马鱼和3条雄性斑马鱼放置于每个孵化盒中,孵化盒中间用自带的隔板将雌雄鱼隔开,防止提前产卵。孵化盒底部具有筛板,可以将成鱼与缸底隔开,防止成鱼吞食鱼卵。第2天早上开灯时将隔板抽出,让雌鱼和雄鱼在光照刺激下交配产卵。1 h后收集孵化盒底部的胚胎,用清水清洗2遍,在体式显微镜下观察,去除死卵和未受精的卵,收集质量高的胚胎,置于26 ℃恒温光照培养箱中待用。在斑马鱼胚胎受精后2~4 h并处于囊胚期时进行暴露实验。
1.3.2 暴露实验
使用前将BPF用二甲基亚砜(DMSO)配制成10 000 mg·L-1的贮备液,储存于4 ℃,实验中所用相应浓度的暴露液用斑马鱼养殖水稀释,保证暴露液中的DMSO含量不超过溶液体积的0.01%(V/V)。
根据BPF对水环境的污染状况,以及BPF对斑马鱼成鱼及胚胎的96 h半数致死效应浓度(LC50)(分别为9.51 mg·L-1和7.5 mg·L-1)[21],取其1/10作为最高浓度组来研究BPF潜在的毒性效应,浓度分别设置为1、10、100和1 000 μg·L-1,同时设置空白对照组,暴露容器为1 000 mL小烧杯,加入500 mL暴露溶液,每个浓度设置3个平行,每个平行随机放置200粒发育正常且处于囊胚期的受精卵,用保鲜膜覆盖在烧杯口处以防止溶液挥发。暴露144 h期间,所有的小烧杯置于生态培养箱中,设置生态培养箱温度为26 ℃,光照周期为16 h∶8 h(光照∶黑暗),光照强度50 lux。每日及时清除死亡胚胎,以免污染到其他胚胎或仔鱼。试验期间每24 h更换暴露溶液,并清洗容器。在暴露的不同阶段,随机选取20条鱼,在显微镜下观察(×20倍),统计畸形发育情况并拍照。
1.3.3 暴露溶液中BPF的化学分析
为了确定暴露溶液中BPF的实际浓度,采用液相色谱串联质谱仪对各个暴露组进行分析。由于每天更换暴露液,因此所有暴露组都只在暴露第1天溶液配制好后(0 h)和换水前(24 h)这2个时间点收集,以表征暴露溶液在试验期间的变化情况。
水样的处理和净化方法、液相色谱条件和质谱条件见Yang等[7]的研究。
1.3.4 激素水平分析
暴露结束后,在每个平行中随机挑选出100条仔鱼置于-80 ℃保存,用于激素水平的测定。激素测定的具体的方法为:将仔鱼称重,加入4倍体积预冷的磷酸盐缓冲液(phosphate buffered saline, PBS),缓冲液中加入1 μg·L-1蛋白酶抑制剂。用匀浆器将斑马鱼仔鱼进行全组织充分匀浆后,12 000×g,4 ℃离心20 min,收集上清液并分装,置于-80 ℃保存直至采用酶联免疫吸附法进行17β-雌二醇(17β-estradiol, E2)、睾酮(testosterone, T)、三碘甲状腺原氨酸(triiodothyronine, T3)、T4和类固醇皮质醇(cortisol, C)这5种激素的测定。使用鱼类E2、T、T3、T4和C试剂盒(中国武汉艾博伊科技有限公司)进行分析时,严格按照试剂盒的说明书进行操作,用酶标仪进行测定。
1.3.5 基因转录水平分析
在暴露至受精后144 h,每个平行随机挑选取20条仔鱼,置于RNAlater中,保存于-20 ℃冰箱,用于基因转录水平的分析。采用Trizol试剂,严格按照说明书的要求提取总RNA,获得的RNA溶液分装后置于-80 ℃冰箱待用,以琼脂糖凝胶电泳法检测总RNA的质量。用核酸蛋白测定仪测定RNA样品在260 nm的吸光值,计算总RNA的浓度。同时根据总RNA的A260/A280的比值来确定总RNA的纯度。采用ReverTra Ace®qPCR RT Master Mix with gDNA Remover试剂盒对所提取的RNA进行反转录,合成cDNA。所合成的cDNA样品保存于-20 ℃,进行荧光定量PCR时,作为模板直接或稀释后添加。
实时荧光定量PCR反应在BIO-RAD公司的CFX96TMOptics仪器上进行,根据SYBR Green PCR kit说明书操作。实验中所采用的目标基因和管家基因相关引物信息如表1所示。引物信息根据引物设计标准,用Primer Premier 5.0软件设计。
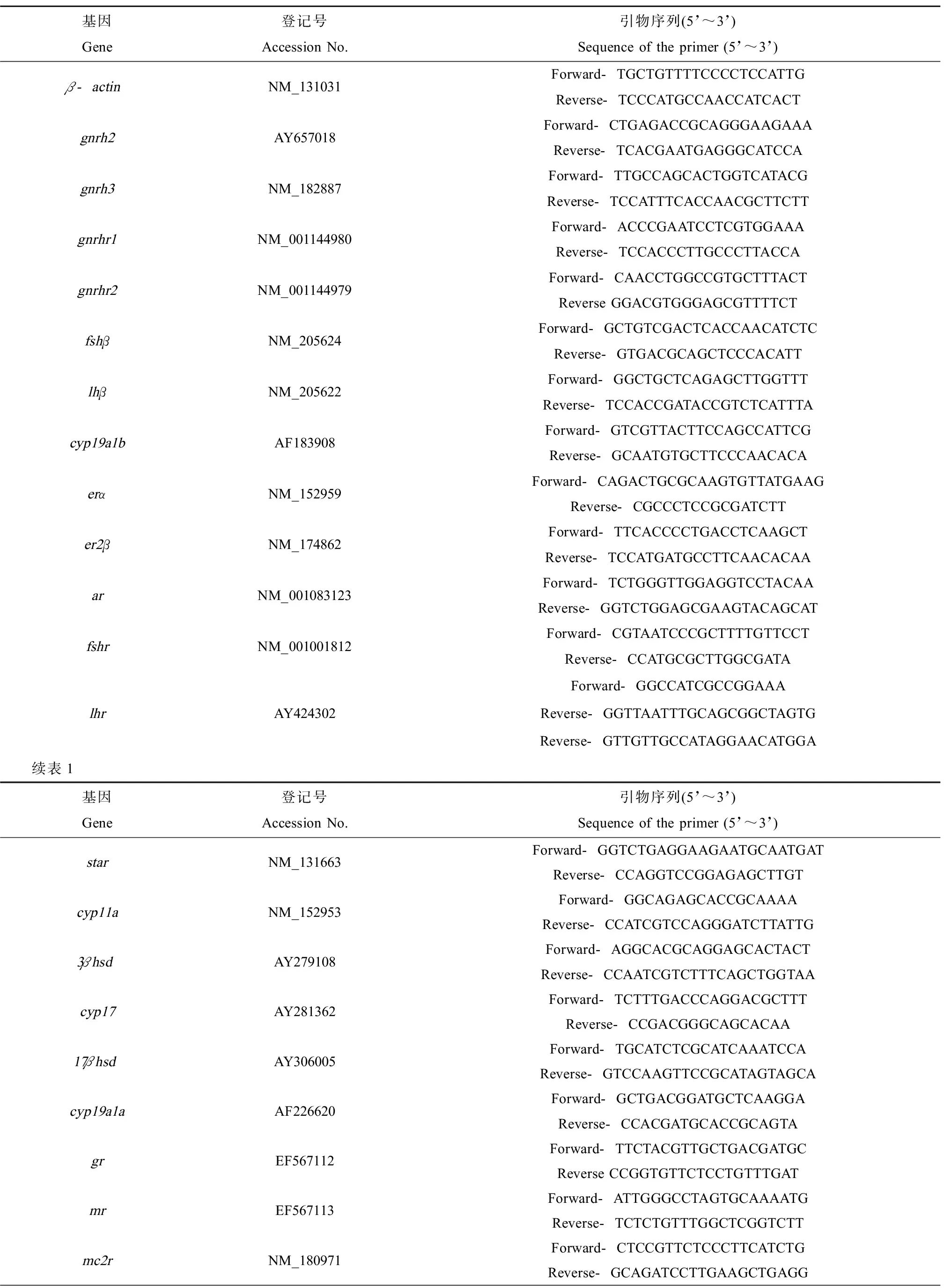
表1 下丘脑-垂体-性腺(HPG)轴、下丘脑-垂体-肾上腺(HPA)轴和下丘脑-垂体-甲状腺(HPT)轴相关基因的引物序列信息Table 1 Primers for genes related to hypothalamic-pituitary-gonadal (HPG) axis, hypothalamic-pituitary-adrenal (HPA) axis and hypothalamic-pituitary-thyroid (HPT) axis
1.3.6 数据处理
由于所测定的不同激素浓度水平差别较大、单位不同,因此ELISA的数据采用相对于空白对照组的变化倍数来表示。激素水平的改变倍数为BPF处理组相对于空白对照组改变的倍数;实时荧光定量PCR的调控倍数是以管家基因β-actin作为内参基因,以空白对照组进行标准化,采用2-△△CT方法计算所得[22]。采用IBM SPSS 9进行统计学分析。基因转录水平在暴露组和空白对照组之间的差异性运用单因素方差分析。当P<0.05表示暴露组与对照组之间具有显著性差异。
2 结果(Results)
2.1 暴露溶液中BPF的实际浓度分析
在暴露期间,空白对照中的BPF浓度低于检出限;BPF在试验开始时(0 h)和换水前(24 h)的实测浓度均无较大差异,并且所有实测浓度都非常接近所设置的名义浓度(表2),这说明BPF在胚胎暴露实验中浓度保持相对稳定。为了方便叙述,所有暴露浓度均以所设置的名义浓度来表示。

表2 暴露过程中BPF的名义浓度和实测浓度Table 2 The nominal and measured concentrations of BPF
2.2 BPF对斑马鱼早期胚胎发育的影响
BPF暴露对斑马鱼胚胎的孵化率、存活率和畸形率的影响如表3所示。与空白对照组相比,100 μg·L-1和1 000 μg·L-1BPF暴露显著降低了胚胎的孵化率和存活率,而1 000 μg·L-1的BPF暴露使斑马鱼胚胎/仔鱼的畸形率显著升高。BPF导致的斑马鱼发育异常情况主要包括发育延迟、卵凝结、心包水肿和脊柱弯曲等情况(图2)。之前的研究报道表明,多种双酚A类化合物,如BPA、BPAF、四溴双酚A(tetrabromobisphenol A, TBBPA)和四氯双酚A(tetrachlorobisphenol A, TCBPA),均会对斑马鱼胚胎/仔鱼产生类似的发育损伤[23-25]。

图2 BPF暴露下斑马鱼胚胎/仔鱼在不同发育阶段的发育损伤注:所有图片均放大20倍;(a)正常发育胚胎(空白对照组,受精后48 h);(b)正常发育胚胎(空白对照组,受精后96 h);(c)正常 发育胚胎(空白对照组,受精后120 h);(d)心包水肿胚胎(10 μg·L-1 BPF,受精后48 h);(e)脊柱弯曲仔鱼(100 μg·L-1 BPF, 受精后96 h);(f)心包水肿仔鱼(100 μg·L-1 BPF,受精后120 h);(g)心包水肿胚胎(1 000 μg·L-1 BPF,受精后48 h); (h)心包水肿仔鱼(1 000 μg·L-1 BPF,受精后96 h);(i)脊柱弯曲仔鱼(1 000 μg·L-1 BPF,受精后120 h)。Fig. 2 Developmental toxicity of BPF on zebrafish embryos/larvae during the exposure periodNote: All images are shown at ×20; (a) Normal development of embryos (control group, 48 hpf); (b) Normal development of larvae (control group, 96 hpf); (c) Normal development of larvae (control group, 120 hpf); (d) Edematous development of embryos (10 μg·L-1 BPF, 48 hpf); (e) Larvae with a malformed trunk (100 μg·L-1 BPF, 96 hpf); (f) Edematous development of larvae (100 μg·L-1 BPF, 120 hpf); (g) Edematous development of embryos (1 000 μg·L-1 BPF, 48 hpf); (h) Edematous development of larvae (1 000 μg·L-1 BPF, 96 hpf); (i) Larvae with a malformed trunk (1 000 μg·L-1 BPF, 120 hpf).
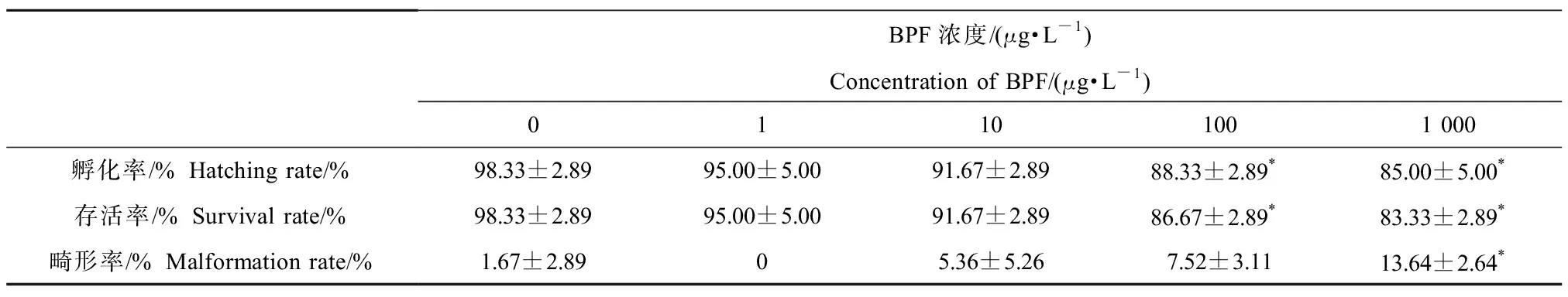
表3 BPF暴露144 h对斑马鱼孵化率、存活率和畸形率的影响Table 3 Hatching rates, survival rates and malformation rates of zebrafish after BPF exposure for 144 h
2.3 BPF暴露对激素水平的影响
斑马鱼胚胎/仔鱼暴露于不同浓度的BPF中至受精后144 h,对甲状腺激素、性激素和肾上腺糖皮质激素的影响如图3所示。其中,100 μg·L-1和1 000 μg·L-1的BPF导致T4水平分别为对照组的0.68倍和0.43倍,呈显著降低趋势;而T3的水平显著升高,分别是对照组的1.46倍和1.78倍。10、100和1 000 μg·L-1的BPF暴露组的性激素E2水平分别为对照组的1.37倍、1.57倍和1.82倍,显著高于对照组;而T的水平分别为对照组的0.71倍、0.62倍和0.51倍,呈显著降低的趋势;在100 μg·L-1和1 000 μg·L-1浓度下,C水平也显著性降低,分别为对照组的0.68倍和0.57倍。
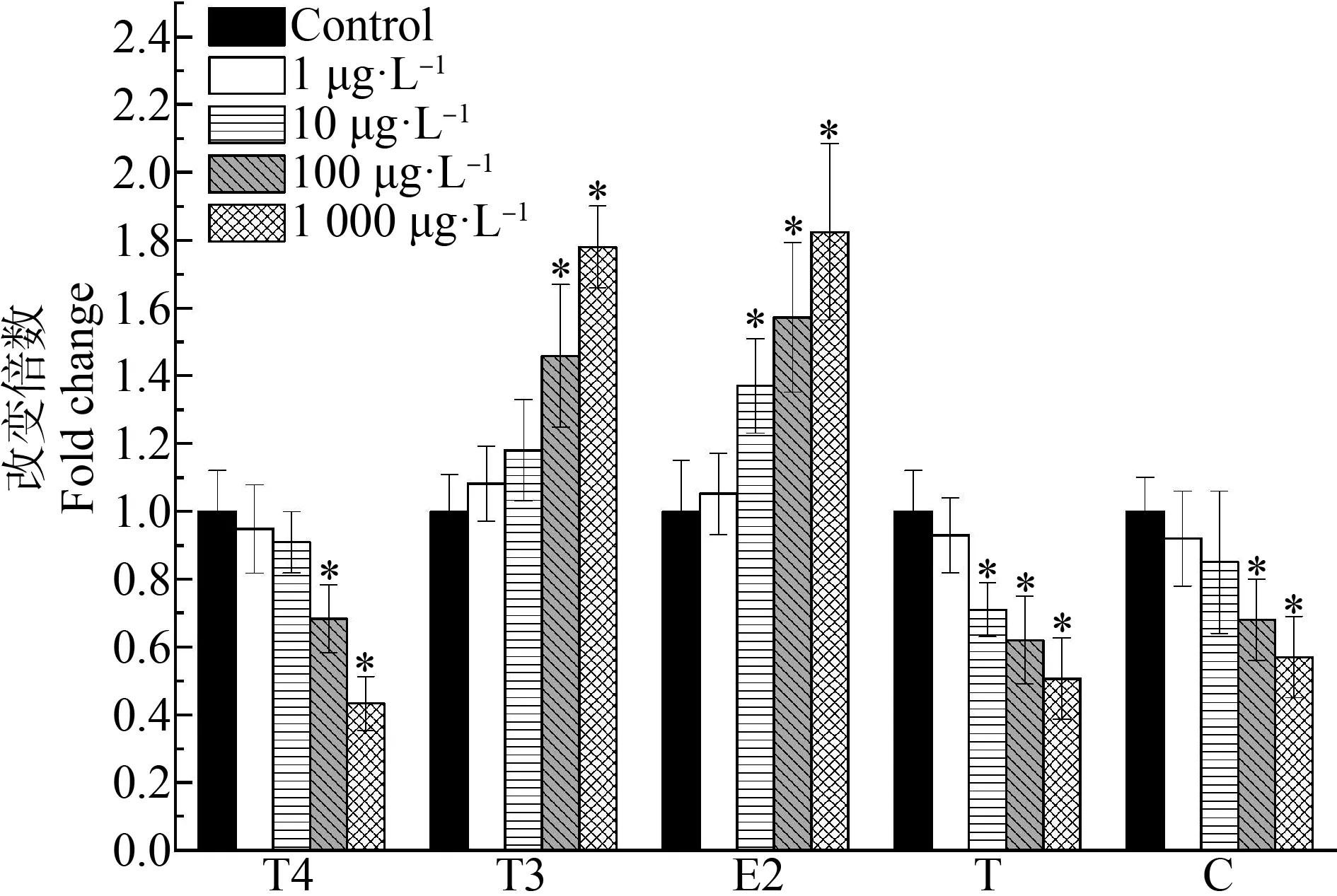
图3 BPF暴露对斑马鱼胚胎/仔鱼的HPT、HPG和 HPA轴相关激素水平的影响注:T4表示甲状腺素,T3表示三碘甲状腺原氨酸,E2表示17β- 雌二醇,T表示睾酮,C表示类固醇皮质醇;结果以3次重复的平均 值±SD表示,*表示暴露组与对照组之间具有显著性差异(P<0.05)。Fig. 3 Effects of BPF on hormone levels of HPT, HPG and HPA axes in zebrafish embryos/larvaeNote: T4 stands for thyroxine; T3 stands for triiodothyronine; E2 stands for 17β-estradiol; T stands for testosterone, C stands for cortisol; the results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
2.4 BPF暴露对斑马鱼胚胎/仔鱼HPT、HPG和HPA轴相关基因表达的影响
鱼类的甲状腺激素、性激素和皮质醇激素主要是通过内分泌系统HPT、HPG和HPA轴控制的,通过内分泌轴上一系列基因的调节来维持激素的合成和平衡,而激素水平通过正、负反馈调节内分泌轴上各部分的功能,从而完成整个生长发育和繁殖过程。因此通过检测HPT、HPG和HPA轴上的基因表达水平,可以进一步揭示BPF的内分泌干扰效应及其作用机制。
与空白对照组相比,BPF所有处理组(1、10、100和1 000 μg·L-1)分别导致HPT轴thrα和trhr1基因表达水平的显著上调(分别上调1.61倍、1.78倍、1.99倍、1.93倍和1.65倍、2.76倍、2.20倍、1.66倍);10 μg·L-1以上浓度组的BPF使trh的表达水平显著降低,分别为空白对照组的0.35倍、0.32倍和0.09倍;在100 μg·L-1和1 000 μg·L-1BPF暴露下,tshβ的表达水平显著上调至1.83倍和1.87倍,tshr显著上调至2.26倍和4.29倍,dio1显著上调至1.45倍和2.07倍,dio2的基因表达水平显著性上调至2.48倍和2.79倍,而nis的转录水平显著性下调至对照组的0.52倍和0.37倍(图4(a))。
与空白对照组相比,暴露于10 μg·L-1以上浓度的BPF时,HPG轴基因cyp19a1b、fshβ、fshr和lhβ的水平显著性上调,其中在10 μg·L-1时,分别上升至对照组的2.62倍、1.79倍、1.56倍和1.52倍;100 μg·L-1和1 000 μg·L-1浓度暴露后,erα的基因表达水平分别上升至1.37倍和1.64倍、gnrh2上调至1.87倍和1.56倍、gnrh3上升至1.52倍和1.83倍、cyp11a上升至1.92倍和1.62倍、cyp19a1a上升至1.66倍和1.88倍、lhr的基因表达水平上调至1.48倍和1.68倍;而cyp17的表达水平分别下调至0.72倍和0.52倍;只有1 000 μg·L-1的BPF暴露使gnrhr2的表达水平显著性升高(为空白对照组的1.79倍),17βhsd的表达水平显著下调(为空白对照组的0.65倍)(图4(b))。
BPF暴露后,4个浓度组(1、10、100和1 000 μg·L-1)均使HPA轴crh和mc2r的基因表达水平显著上调(分别上调1.98倍、2.86倍、4.71倍、6.92倍和1.71倍、1.85倍、1.56倍、2.14倍);10 μg·L-1以上浓度的BPF导致pomc基因表达水平分别上调2.04倍、2.38倍和1.96倍,与对照组具有显著性差异;100 μg·L-1和1 000 μg·L-1浓度组显著提高了mr的表达水平,分别为空白对照组的1.85倍和2.83倍(图4(c))。

图4 BPF暴露对斑马鱼胚胎/仔鱼HPT、HPG和HPA轴相关基因表达水平的影响注:(a) HPT轴;(b) HPG轴;(c) HPA轴;结果以3次重复的平均值±SD表示,*表示暴露组与对照组之间具有显著性差异(P<0.05)。Fig. 4 Gene expression of the HPT, HPG and HPA axes in zebrafish embryos/larvae exposed to BPFNote: (a) HPT axis; (b) HPG axis; (c) HPA axis; the results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
3 讨论(Discussion)
BPF对斑马鱼HPT、HPG和HPA轴的影响及其交互作用如图5和图6所示。鱼类甲状腺滤泡主要分泌甲状腺激素T4以及少量的T3。T4与血液中的运载蛋白结合后,脱去一个碘原子,转化为T3。在鱼类的早期生命阶段,甲状腺系统在其正常的生长发育中发挥着重要的调控作用。一些化合物能够通过干扰甲状腺激素的合成、转运和代谢等过程,引起甲状腺激素水平的紊乱,进而影响生物体的生长、发育和繁殖等生理过程。本研究中,BPF对斑马鱼胚胎暴露至受精后144 h,低浓度组并未对甲状腺激素产生影响,但是2个高浓度组均使仔鱼体内T3水平显著升高,T4水平显著降低,说明BPF能影响斑马鱼甲状腺激素的水平,具有甲状腺系统内分泌干扰效应。

图5 BPF暴露对斑马鱼HPT、HPG和HPA轴的影响注:(a)HPT轴;(b)HPG轴;(c)HPA轴;TSH表示促甲状腺激素,TPO表示甲状腺过氧化物酶,FSH表示促卵泡激素, LH表示促黄体激素,ACTH表示促肾上腺皮质激素,HDL表示高密度脂蛋白,LDL表示低密度脂蛋白。Fig. 5 Proposed toxicity pathways along HPT, HPG and HPA axes for zebrafish exposed to BPFNote: (a) HPT axis; (b) HPG axis; (c) HPA axis; TSH stands for thyroid stimulating hormone; TPO stands for thyroid peroxidase; FSH stands for follicle-stimulating hormone; LH stands for luteinizing hormone; ACTH stands for adrenocorticotropic hormone; HDL stands for high density lipoprotein; LDL stands for low density lipoprotein.
性激素包括雌激素和雄激素,可以促进性器官和第二性征的发育,并维持其功能。雌二醇是硬骨鱼体内含量最高的雌激素,而睾酮是含量最高也是最重要的雄激素,测定鱼类体内性激素水平的变化情况可以用来筛选环境内分泌干扰物[26]。在本研究中,暴露于10、100和1 000 μg·L-1的BPF均导致仔鱼体内睾酮水平的显著性下调,以及雌二醇水平的显著性上调。当雄激素水平降低,雌激素水平升高时,鱼类雄性特征的发育和维持将会受到影响,因此BPF对斑马鱼胚胎/仔鱼都具有一定的雌激素效应。
研究发现,当鱼类长时间暴露于环境中污染物时,将导致HPA轴受损,肾间腺“疲惫”,皮质醇水平降低[27]。本研究中,100 μg·L-1和1 000 μg·L-1的BPF导致类固醇皮质醇水平的降低,与其他学者的研究结果一致。
甲状腺激素水平受HPT轴的调控,内分泌干扰物可以通过作用于HPT轴,干扰HPT轴作用位点,破坏甲状腺激素平衡,从而对生长发育造成一系列的危害。TRH和促甲状腺激素(thyroid stimulating hormone, TSH)的分泌在鱼类HPT轴上的调节作用会因为循环系统中的甲状腺激素水平发生变化而变化,因此可以通过检测促甲状腺激素tshβ基因转录水平的变化来评估环境化合物是否会引起甲状腺功能紊乱,进而阐明化合物扰乱甲状腺功能的作用机制。已有的研究报道证明,在鱼类中T3和T4能够通过负反馈机制调节tshβ的基因表达[27-32]。在本研究中,BPF暴露后,tshβ和受体tshr的转录水平均显著性提高,可能是由于T4水平的降低而引起的反馈调节机制所导致的。在BPF暴露后的仔鱼中,trh基因的表达受到了抑制,与tshβ基因上调的变化相反,可能的原因是促甲状腺激素释放激素除了能够调控甲状腺轴外,还可以促进垂体分泌α-促黑激素[33],以及调控摄食等[34]。因此,本文BPF使trh基因的转录水平下调,可能并不只是其对HPT轴的影响所致。钠/碘转运体蛋白(Na+/I-symporter, NIS)将碘从血液中运输到甲状腺滤泡细胞,是甲状腺激素合成的第一步[35]。甲状腺球蛋白(thyroglobulin, Tg)是甲状腺激素的前体蛋白,被甲状腺用于合成甲状腺激素T3和T4[36]。因此nis和tg基因转录水平的变化可能对甲状腺激素的浓度有影响。脱碘酶(DIO)的主要功能是将T4转换成T3。斑马鱼体内有2种类型的脱碘酶,DIO1和DIO2。BPF对斑马鱼胚胎/仔鱼暴露144 h后,nis基因的表达水平显著性下调,可能导致T4的合成受阻,而dio1和dio2的表达水平均显著升高,导致T4向T3的转化速率加快,这可能是T4水平下降、而T3水平升高的原因。有研究将脱碘酶基因表达水平的高低作为评价甲状腺干扰的标志物[37],这进一步证明了BPF对斑马鱼胚胎/仔鱼具有甲状腺激素干扰效应。甲状腺激素通过与受体结合起作用。Chen等[29]发现T3浓度水平的升高会引起甲状腺激素受体基因表达的上调,并影响到甲状腺轴上其他基因的转录水平。BPF暴露诱导了thrα表达水平的上调,thrβ基因转录水平却均未发生明显的变化。Thrα和thrβ结构的异常可能会导致甲状腺激素不能与受体结合和激活相应的受体后的级联反应的发生,已有的一些研究也报道了斑马鱼仔鱼经化学品暴露后thrα和thrβ的变化不一致的现象[28-29],因此推测thrα和thrβ可能作用于不同的功能区,对甲状腺激素的生理功能具有不同的作用。
性激素的水平主要受HPG的调控,通过HPG轴上一系列基因的调节来维持性激素的合成和平衡,从而完成整个生殖过程。斑马鱼胚胎暴露于BPF之后,导致斑马鱼下丘脑和垂体中gnrh和gnrhr、促性腺激素fshβ、lhβ以及受体fshr和lhr基因表达水平显著性提高,这可能会促进类固醇激素的合成和分泌。促卵泡激素(follicle stimulating hormone, FSH)、促黄体激素(luteinizing hormone, LH)的浓度与甲状腺激素的浓度呈负相关[12],本文观察到的促性腺激素及其受体的基因表达水平升高也可能是由降低的T4水平引起的,以促进类固醇激素的生成。P450是将雄激素催化转化为雌激素的关键限速酶,对性激素的平衡起到至关重要的作用。CYP17在类固醇激素合成过程中,可以将孕酮催化转化为17-羟孕酮,然后进一步催化转化为雄烯二酮,接着在17β-HSD的催化下转化为高生物活性的睾酮[38-39]。BPF对斑马鱼胚胎/仔鱼暴露144 h能诱导cyp19a1a和cyp19a1b基因表达水平的上调,致使睾酮向雌二醇的转化速率加快,从而导致斑马鱼体内的睾酮水平的下降及雌二醇水平的升高。而cyp17、17βhsd和3βhsd转录水平的降低,将会抑制孕酮向雄激素的转化,并将进一步导致雄激素水平的降低。雌激素的信号通路是由雌激素受体介导的,在本文的研究中,暴露于BPF导致了雌激素受体erα基因转录水平的显著上调,而对er2β没有显著的影响。体外实验发现,BPF可以与雌激素受体结合,表现出类雌激素效应[40-41],因此,我们推测BPF通过与erα结合而发挥雌激素效应的。一些研究表明,HPT轴和HPG轴间具有交互作用,甲状腺激素水平可能会影响生殖、性激素水平和相关酶的基因表达。在本研究中,我们观察到BPF对HPT的激素水平和相关基因的表达水平都产生了影响,而HPG轴也受到了直接或间接的影响。Roy等[42]的研究表明,GnRH能够促进T4的分泌,在本研究中,我们观察到T4的水平降低,而gnrh的表达水平升高,可能是gnrh的反馈调节机制导致的,以促进T4的分泌,调节激素的平衡。
斑马鱼HPA轴的能够调节外界压力引起的生理生化反应,皮质醇通过与其受体结合调节外界压力引起的生理生化反应,从而调节和维持机体内环境的稳定[43]。有研究表明,HPA轴和HPG轴间具有交互作用,E2会影响促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)和促肾上腺皮质激素释放激素(corticotrophin releasing hormone, CRH)的合成,从而影响类固醇皮质醇的分泌和合成[12]。本研究中crh、crhr、pomc、mr和mc2r表达水平的上调可能与E2浓度的升高相关。而cyp17和3βhsd基因表达水平的下调可能直接导致了类固醇皮质醇水平的降低。此外,一些研究表明,HPT轴和HPA轴也具有交互作用,CRH既可以参与HPA轴的调控,也可以参与HPT轴和HPG轴的调控[14]。下丘脑分泌的CRH可以刺激垂体分泌TSH,而当甲状腺激素分泌过多时,甲状腺激素又会通过反馈调节来刺激下丘脑与垂体,抑制下丘脑分泌的CRH与垂体分泌的TSH,从而减少甲状腺激素的分泌[12]。本研究中观察到的crh基因的上调能够促进CRH浓度的升高,进而刺激TSH的分泌,达到调节甲状腺激素平衡的作用。
综上所述,BPF暴露造成了斑马鱼仔鱼体内激素水平的紊乱,说明BPF对斑马鱼胚胎具有内分泌干扰效用。通过对斑马鱼HPT、HPG和HPA轴基因表达水平的分析发现,BPF对3条内分泌轴的基因和激素间存在交互影响作用(图6)。
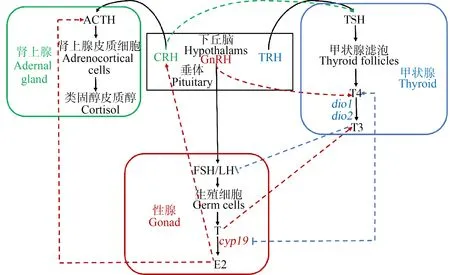
图6 BPF暴露对斑马鱼HPT、HPG和HPA轴间交互作用影响的示意图注:CRH表示促肾上腺皮质激素释放激素,GnRH表示促性腺激素释放激素,TRH表示促甲状腺激素释放激素, FSH表示促卵泡激素,TH表示促黄体激素。Fig. 6 Schematic representation of interaction between the HPT, HPA and HPG axes after exposure to BPFNote: CRH stands for corticotropin-releasing hormone; GnRH stands for gonadotropin-releasing hormone; TRH stands for thyrotropic hormone releasing hormone; FSH stands for follicle-stimulating hormone; LH stands for luteinizing hormone.

