黑磷纳米片应用及生物毒性研究进展
向思靓,曾洁,阮锋凯,左正宏,何承勇
厦门大学生命科学学院,细胞应激生物学国家重点实验室,厦门 361102
黑磷(black phosphorus, BP)是纳米材料家族的新成员,主要包括黑磷量子点(black phosphorus quantum dot, BPQD)、黑磷纳米颗粒(black phosphorus nanoparticle, BPNP)和黑磷纳米片(black phosphorus nanosheet, BPNS)。2014年,Li等[1]将二维层状BPNS从块状黑磷(Bulk-BP)中剥离出后,便引起了研究人员的广泛关注。BPNS是二维结构材料,由单原子层厚度的纳米片堆积而成。BPNS的层状结构赋予其较大表面积,有利于在医学上用于药物运载[2]。BPNS可通过机械剥离[3]、液相剥离[4]或电化学剥离[5]等方法制备。随着纳米技术的飞速发展和人们对BP材料的研究深入,BPNS在生产生活中的应用会愈加广泛,我们可能频繁接触到BPNS,或使用BPNS制成的药物,因此,有必要深入了解BPNS对人体和生物体潜在的影响。近期Qu等[6]全面详细地综述了BP相关研究进展,从BP的物理化学特性、合成、钝化、生物医学应用,到BP与生物分子、细胞、动物间的相互作用,以及BP潜在的生态风险和BP的改性修饰。这篇综述对BP纳米材料实验研究的开展及未来发展方向,提供了重要的指导。本文主要关注和论述BPNS的生物毒性研究进展,试图更详细地分析BPNS对人体和环境生物的影响,阐述BPNS生物安全性研究的现状与不足,为将来的研究提供方向和思路。
本文首先简要介绍BPNS在电子、光电、电化学、环境和生物医学等领域的应用前景,并从BPNS的环境危害和健康危害的角度进行综述。通过对环境生物包括细菌及单细胞水生生物的毒性检测,来评估BPNS潜在生态风险。通过对哺乳动物体内外毒理实验综述,以期评估BPNS对人类的健康风险。由于哺乳动物的结构更加复杂、生命周期更长,BPNS与其之间的相互作用更加繁杂。但不管是哺乳动物还是单细胞生物,BPNS对它们的毒性机制可能存在一定的相似之处,比如BPNS与生物膜界面的相互作用方式、BPNS体内降解产物诱发毒性损伤等。本文重点论述国内外在BPNS生物毒性方面的研究进展,为开发应用更加安全、更加环境友好的BP纳米材料提供科学依据。
1 BPNS的结构性能及应用(Structural performance and application of BPNS)
1.1 BPNS的结构性能
BP属于磷的一种同素异形体,相比于白磷和红磷,它的活性较弱,在空气中不易自燃,比较稳定[7]。BP晶体具有层状结构,该结构是由正交晶体中的褶皱六边形环组成[8]。而BPNS是BP的单层或几层形式,在其层状结构中,每个磷原子都与相邻的3个磷原子通过共价键结合,从而形成了沿锯齿状方向的双层结构和沿扶手椅方向的皱缩结构。层间靠范德华力维系[9]。这种结构对于BPNS的光学特性、力学特性、导电性能以及拓扑结构都有重要影响。
相比其他二维材料,BPNS拥有独特的优势。石墨烯近10年来发展迅速,但其零带隙结构特点限制了石墨烯在半导体领域的应用[10]。而BPNS的带隙取决于它的层数,可剥离成少数几层,故它拥有可调节的带隙宽度,若应用于光电设备,可优化设计,提高灵活性[11]。BPNS在平面内还有极高的各向异性,可应用于生物传感[12]。同时,BPNS能够广泛吸收可见光、红外光以及紫外光,拥有优异的光学性能[13]。BPNS还有很高的开关电流比,可应用于场效应晶体管传感[14]。相比于MoS2,BPNS有很高的载流子迁移率,可应用于气体传感器等领域[14]。此外,BPNS还拥有很高的生物相容性,在体内可降解为对人体无害的磷酸盐,这是其他无机纳米材料所不具备的,具有应用于生物医学领域的良好前景。总的来说,BPNS具有直接带隙、高度各向异性、广谱光吸收性、高开关电流比、高载流子迁移率和高生物相容性等优点。因此,BPNS在电子、光电、电化学、环保和生物医学等领域具有广泛的应用前景(图1)。

图1 黑磷纳米片(BPNS)结构及应用领域Fig. 1 The structure and applications of black phosphorus nanosheet (BPNS)
1.2 BPNS的应用
1.2.1 BPNS在电子、光电及电化学领域的应用
在2014年,新型的BPNS二维半导体材料出现后,由于其场效应与硅相似,有望代替硅,应用于制作场效应晶体管。研究发现,BPNS场效应管可进行双极操作[15],优化传输性能[16]。另外,纳米BPNS对周围环境非常敏感,当处于气体环境或有气体吸附其上时,电阻率会发生变化,因此可用于制备气体传感器[17-18]。
由于有可调带隙,BPNS吸收能量后,可以光子形式将能量再释放出来。因此,BPNS能够高效地将电信号转化为光信号。BPNS还可广泛吸收红外光、可见光以及紫外光,可制备优良的光电元件[19-20]。
BPNS的可调带隙特性使得它还可作为电化学装置中的电极材料。以BPNS作为电极材料,制备的超级电容器,具有快速的充电/放电速率,高功率密度以及长循环寿命等优势[21]。BPNS也可用于锂离子电池的阳极,如此制得的电池具有高容量、高导电性和长寿命[22]。
1.2.2 BPNS在生物医学领域的应用
由于BPNS尺寸较小,它可以利用肿瘤的增强渗透滞留效应,在肿瘤部位富集。同时,相比于小分子药物,BPNS又不至于因为尺寸太小而被肾脏过滤排出[2]。除此之外,由于BPNS的本质是磷元素,而磷元素是生物体的大量元素之一,故BPNS拥有出色的生物相容性。BPNS还拥有良好的光敏和光动力特征。因此,BPNS在生物医学领域拥有巨大的应用前景。
BPNS被光照射后,能将其吸收的光子能量以热能形式散发,然后引起温度迅速升高。而当温度升高到一定时,肿瘤细胞可被诱导凋亡。因此BPNS可制成高效的光热制剂,用于光热疗法(photothermal therapy, PTT)。通过对肿瘤细胞BPNS富集部位局部照射,抑制肿瘤的生长,同时减少周围正常细胞的损伤[23-24]。BPNS还可以制成光敏剂,用于光动力治疗(photodynamic therapy, PDT)。研究表明,在整个可见光区域里,超薄BPNS在肿瘤细胞内产生活性氧(reactive oxygen species, ROS)[25],进一步抑制肿瘤细胞增殖、诱导凋亡。相比其他光敏剂,BPNS所需量更少,产生ROS需要光照时间更短[26]。更重要的是,BPNS在光照下可以转化为生物相容性良好的磷酸盐化合物,生物残留少。另外,在Yang等[27]研究中,BPNS可与糖酵解抑制剂协同作用,可以抑制自噬和能量代谢,有望在肿瘤饥饿治疗中发挥重要作用。
由于BPNS的比表面积大,它还可以作为药物载体,与带正电的小分子药物结合。相比其他二维纳米材料,BPNS载药量较大[28]。而且,在酸性肿瘤微环境下,BPNS能快速释放药物;以BPNS作为药物载体,还可保持药物的稳定状态且对生物体副作用较小[29-30]。
研究表明,BPNS可用于治疗金属离子浓度过高导致的神经退行性疾病。由于BPNS可以选择性地捕获Cu2+,降低神经毒性。而且在近红外光(near infrared, NIR)照射下,BPNS透过血脑屏障比例显著提高,还能抑制神经细胞凋亡[31]。BPNS所制成的复合支架在轻度氧化应激刺激下,可诱导血管和神经生成,促进轴突伸长和髓鞘增厚[32]。除了神经损伤修复以外,BPNS还可用于骨再生[33],修复肿瘤引起的骨缺损;还可作为伤口敷料,在NIR照射下,能显著促进伤口愈合和皮肤再生[34]。
1.2.3 BPNS在环境与能源领域的应用
太阳能产氢是绿色环保的新方法,但需要非常高效的光催化剂。BPNS具有可调带隙和高载流子迁移特性,可利用以BPNS为原料设计的光催化剂来实现电子有效迁移,驱动水分解反应[35]。BPNS经过可见光和NIR活化,可催化氢气产生,快速析出氢气[36-37]。BPNS作为光催化剂,还可用于污染物降解,解决环境污染问题[38-40]。
2 BPNS的环境危害(Environmental hazard of BPNS)
2.1 BPNS对细菌毒性
Xiong等[41]研究了BPNS对2种模式细菌——大肠杆菌和枯草芽孢杆菌的毒性,结果表明,BPNS的毒性呈现时间和剂量依赖性。当BPNS浓度为100 μg·mL-1时,其对大肠杆菌的杀菌效果最大可达91.65%,对枯草芽孢杆菌可达99.69%。相比于枯草芽孢杆菌,BPNS处理6 h时对大肠杆菌的毒性更强,随后毒性减弱。其原因可能是大肠杆菌的细胞壁相较薄,对BPNS更敏感,在更早期就表现出毒性反应。另外,由于大肠杆菌外膜有自我修复能力,使得毒性部分逆转,随着暴露时间推移BPNS对大肠杆菌的毒性降低。BPNS的杀菌机制主要是产生ROS和破坏细胞膜。Ouyang等[42]用银纳米粒子(Ag nanoparticles, AgNP)修饰BPNS,构建了Ag@BP纳米杂化物。Ag@BP经NIR照射,可在短时间内通过局部高温杀死金黄色葡萄球菌,显示出良好的杀菌能力。
2.2 BPNS对水生单细胞生物毒性

综上所述,BPNS对于环境生物具有较显著的毒性,可破坏生物膜结构,甚至导致死亡。其次,BPNS会通过吞噬内在化或降解成磷酸盐,干扰水生生物的正常生长、代谢和繁殖等,以上研究表明BPNS对环境生物具有毒性效应,可能对生态环境造成不良影响(表1)。

表1 BPNS对环境生物的毒性Table 1 Toxicity of BPNS on environmental organisms
3 BPNS健康危害(Health risks of BPNS)
纳米材料尺寸较小,易穿透各种屏障。但同时,纳米材料在人体内半衰期长、不易被清除,容易积累在特定的细胞或组织,可能对机体造成损害。而且,纳米材料的组成、横向尺寸、厚度、表面功能化和晶体结构等都能影响其在生物界面上的作用[45]。BPNS由于其独特的物理化学性质,在生物医药领域被寄予厚望。随着BPNS将来广泛应用,BPNS对哺乳动物毒性研究是必不可少的。
3.1 BPNS体外毒性
BPNS毒性主要集中在体外细胞毒性研究。我们将主要从BPNS的细胞毒性及修饰对细胞毒性影响进行论述。
Qiu等[46]为了检测BPNS细胞毒性,用不同浓度BPNS处理MDA-MB-231、A549、HeLa和B16这4种细胞,结果显示,即使在200 μg·mL-1高浓度下,也几乎没有观察到毒性作用。Chen等[28]将BPNS与红细胞共培养8 h,溶血率<5%;然后又测试了BPNS对4T1、HeLa、L929和A549这4种细胞的毒性,发现当BPNS浓度高达200 μg·mL-1时,也几乎没有毒性作用。相反地,Latiff等[47]将不同浓度BPNS处理A549细胞,BPNS细胞毒性具有剂量依赖性,50 μg·mL-1BPNS可将细胞存活率降至48% (WST-8法检测)和34% (MTT法检测),细胞毒性介于石墨烯和MoS2之间;他们还观察到,高浓度的BPNS由于对光具有显著的吸收作用,对WST-8和MTT这类通过检测吸光度值的实验结果存在干扰。在后续研究中[48],比较了磷其他同素异形体(紫磷和红磷),以及气相生长的BP (BP VPG)和高压转化的BP (BP HPC)细胞毒性,发现BP细胞毒性较紫磷和红磷更高,较薄的BP HPC比BP VPG毒性大,另外氧化比例高的磷材料毒性更大。
Zhang等[49]的研究证明BPNS的细胞毒性还有材料尺寸大小和靶细胞类型依赖性。横向尺寸和厚度最大的BPNS表现出最强细胞毒性,而尺寸过大的BPNS可直接破坏细胞膜的完整性,导致细胞内容物释放,甚至细胞死亡。并且不同细胞系敏感性有所差异,该实验中对BPNS的敏感度顺序为293T>NIH3T3>HCoEpiC。Song等[50]研究了BPNS对成纤维细胞L-929的毒性,结果表明,毒性与BPNS浓度及暴露时间成比例,且毒性机制是氧化应激介导的代谢活性降低与膜完整性破坏。Sun等[51]的BPNS体外研究结果表明,BPNS会降低人支气管上皮细胞活力,且具有时间和剂量依赖性。机制研究表明,BPNS会降低线粒体电位,导致细胞内ROS增加,进而活化caspase-3,引起细胞凋亡。
另外,Mo等[53]的研究证明,血浆蛋白会吸附到BPNS上,形成BP纳米材料-蛋白冠复合物,这会影响巨噬细胞的摄取,且复合物激活了NF-κB通路,使得促炎细胞因子分泌增加,增强巨噬细胞的促炎和免疫干扰作用。为了进一步开发可有效用于生物医学的BPNS,后续应更加关注BPNS的修饰,控制蛋白冠的形成。另一方面,Zhang等[54]研究了BPNS与牛血清白蛋白(bovine serum albumin, BSA)和牛血红蛋白(bovine hemoglobin, BHB)的结合机理,结果表明,BPNS抑制了BSA和BHB的固有荧光,诱导了蛋白质肽链的延伸,改变了BHB的三级结构,破坏了BHB与胆红素的结合域。Tao等[55]的研究表明,聚乙二醇(polyethylene glycol, PEG)修饰的BPNS可使自噬体数量显著增加,诱导癌细胞自噬。
在环境条件下,BPNS较不稳定性,对氧气和水具有很高的反应性,导致化学变化、发生降解[56]。BPNS降解速率也影响它的毒性,而降解速率与BPNS的厚度和表面修饰关系密切,较薄的BPNS降解速度更快[57]。目前,针对BPNS的不稳定性,研究人员已从多个方面进行改良。例如,Zhao等[58]使用几种不同的离子溶液,再结合研磨与超声处理,剥离到厚度分别为3.58、5.50和8.90 nm的多层BPNS。Zhao等[56]将磺酸钛配体(TiL4)用于BPNS的表面配位,配位后的BPNS在水环境中或长期暴露于空气时,均表现出良好的稳定性,显著延长了BPNS寿命。Qu等[59]的研究表明,TiL4配位的BPNS可逃避巨噬细胞的摄取,并减少细胞毒性和抑制促炎作用。还有聚多巴胺[60]、尼罗蓝染料[61]等也被应用于BPNS的表面修饰,增强其稳定性。
细胞毒性机制可能是BPNS诱导细胞内产生ROS,进而致使其凋亡,还可破坏生物膜的完整性。而且BPNS进入细胞内,还可能诱导细胞自噬。除此之外,BPNS可形成蛋白冠影响免疫细胞的功能,还可导致某些特定蛋白质结构的改变。
总而言之,BPNS的体外毒性呈现出剂量、时间、尺寸以及靶细胞类型依赖性,且与BPNS降解速率相关。为了更加准确地测定BPNS毒性,需要运用多种标准方法综合评价其体外毒性,以减少不同方法间的系统误差。研究细胞毒性时,为了减少细胞敏感性差异,还需要采用多种细胞系综合判定。而且,有必要区别BPNS对肿瘤细胞和正常细胞的影响,如果BPNS在治疗肿瘤方面应用,应对肿瘤细胞有较好的抑制作用,而对正常细胞的影响可忽略不计[62]。目前,纳米材料体外毒性评价主要是利用二维培养的细胞系,可以利用原代细胞[63]、干细胞[64]、诱导性多潜能细胞[65],以及类器官等模型进行毒性评估。其中,类器官在体外环境下培育形成,具备类似真实器官的三维结构,能部分模拟来源组织或器官的生理功能,类器官比二维培养细胞更具代表性,具有类似组织的三维结构和细胞间相互作用,维持细胞对药物、污染物的代谢能力,因此在纳米材料生物安全性评价等方面具有诱人的应用前景[66]。我们前期成功构建出小鼠肾类器官,并利用它筛选发现BPQD具有肾脏毒性,其敏感性显著高于二维培养的人近曲小管上皮细胞株HK-2,同时还发现BPQD会引起胰岛素敏感度下降以及内质网应激。类器官将来也可应用于BPNS生物安全性评价和毒性机制研究[67]。针对不同尺寸、电荷和修饰的纳米材料,需要充分比较这些物理化学特征及其对BPNS毒性影响,可以运用计算毒理学的技术手段找到影响生物安全性的关键影响因素。关于BPNS毒性效应机制的研究,需要区分是BPNS本身还是其降解产生的磷酸盐导致的毒性[43]。此外,仅仅有体外毒性评价远远不够,需要进行开展体内暴露实验,才能更全面的评价BPNS的生物安全性。表2归纳了相关文献中有关BPNS的细胞毒性的实验及结论。

表2 BPNS对不同细胞的毒性Table 2 Toxicity of BPNS to different cells
3.2 BPNS体内毒性
关于BPNS的体内暴露实验较少,对于其体内毒性效应还不甚清楚。本文也将从目前仅有的BPNS毒性效应和机制进行论述。
Shao等[68]制备了结合BPNS的温度敏感水凝胶(BP@PLEL),可用于PTT治疗癌症。单次皮下注射BP@PLEL到小鼠的背部,20 d后,主要器官无明显病变。Chen等[28]在给健康小鼠单次注射BPNS,7 d后未检测到肝肾功能的明显变化。Jin等[69]合成了负载有药物氟西汀(fluoxetine, Flu)的BPNS用来治疗抑郁症,体内毒性研究结果显示,小鼠的血液生化指标均正常,肝肾功能无显著变化。Hou等[70]通过实验发现,BPNS会优先积累在肾脏,在生物体内最终降解为PxOy离子,对心、肝、脾、肺和肾均无明显损伤。Sun等[71]向小鼠静脉注射100 μg PEG修饰的BPNP,通过组织病理学分析,没用观察到明显的器官损伤。然而在Sun等[51]的研究中,单次注射的BPNS(20 mg·kg-1)对小鼠器官没有明显损伤,但当3次注射BPNS后,小鼠的肝脏和肾受损,不过一定时间后可恢复正常。Kong等[72]的研究表明,低剂量时BPNS可用于抑制肿瘤和药物负载,当小鼠静脉注射过高剂量的BPNS(30 mg·kg-1)时,肝脏与肾脏内的ROS增加,并观察到水肿现象,炎性细胞浸润导致的凝固性坏死,淋巴细胞浸润,肾小球萎缩以及肾小管肿胀。在表3中归纳了以上关于BPNS急性暴露后体内毒性损伤效应。
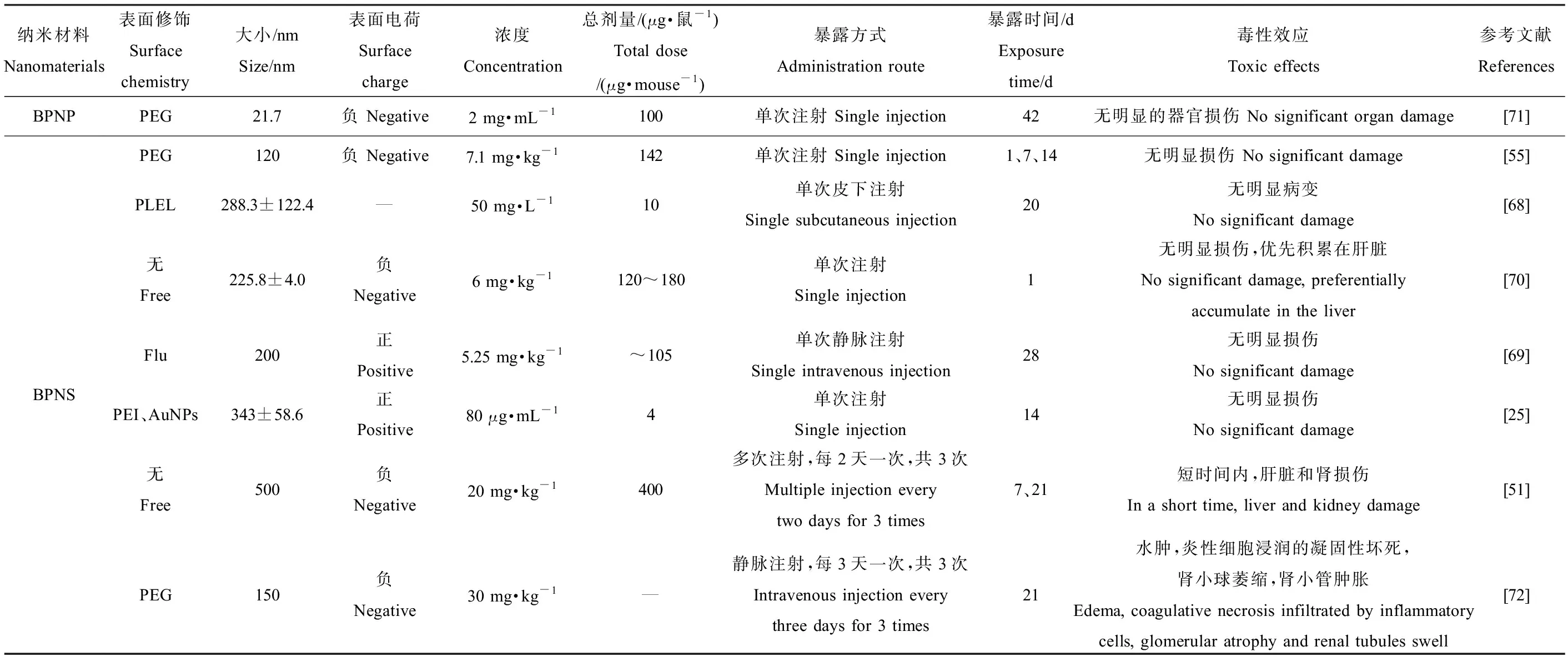
表3 BPNS体内毒性Table 3 In vivo toxicity of BPNS
总体而言,目前BPNS体内毒性试验一般都是单次急性暴露,大部分结果显示BPNS相对比较安全,但剂量过高会引起组织损伤和炎症反应。另外,Qu等[59]发现当给小鼠按500 μg·kg-1静脉注射暴露于BPQD后,短时间内会出现明显的炎症反应,例如嗜中性粒细胞数量增加,一部分炎症细胞因子浓度升高。长时间后症状消失。Mu等[73]评估了BPQD对机体的毒性,其体内研究表明,BPQD可短暂地诱导氧化应激反应和脂质过氧化,降低过氧化氢酶活性,诱发DNA断裂以及骨髓有核细胞损伤,但这些损伤可逐渐恢复。这些BPQD相关的体内毒性研究结果可能对于BPNS毒性研究具有一定参考价值,但是否完全相似有待后续研究比较。
然而,仅有急性毒性数据不足以全面评价BPNS生物安全性,需要继续开展体内急性重复暴露、亚急性、亚慢性、慢性暴露实验,以及遗传毒性、生殖毒性、代谢动力学等方面实验。另外,目前组织病理实验主要是观察肝、肾、心、肺、脾。而之前有研究表明,一些无机纳米材料可对肠道或胰腺产生损伤,可能促进炎症性肠病,导致肠道屏障功能异常,以及影响肠膜的正常结构,致使肠道通透性增加,损害胰腺的正常功能,从而影响代谢[74-77]。BPNS如果长期重复暴露,也可能会对肠道及胰腺产生不良作用。除了小鼠之外,也还需对其他模式动物如爪蟾、斑马鱼、四膜虫和线虫等,进行BPNS的潜在毒性研究。
4 总结与展望(Summary and prospect)
近些年来,BPNS在很多领域成为热门,与此相关的研究也日益增多。虽然BPNS在电子学、光电学、电化学、环境以及生物医学尤其是肿瘤治疗方面取得了可喜的进展,但还必须考虑BPNS对机体以及环境可能存在的毒性效应。影响BPNS毒性的因素有很多(图2),BPNS对不同类型的细胞引起的毒性效应可能不尽相同,不同尺寸的BPNS对同种细胞的毒性效果也存在差异,文献结果表明尺寸大的BPNS毒性可能更大[49]。暴露时间、材料浓度和降解速率也是影响BPNS毒性的重要因素。另外,检测方法在一定程度上也可影响实验结果。对BPNS进行表面修饰可改变其毒性大小,如PEG、水凝胶、聚多巴胺和TiL4等,修饰后可中和BPNS表面部分负电荷,增强纳米材料稳定性,降低毒性效应。

图2 BPNS毒性作用和毒性影响因素注:ROS表示活性氧。Fig. 2 The toxic effects of BPNS and its influencing factorsNote: ROS means reactive oxygen species.
在毒性机制方面(图3),BPNS可在细胞内产生ROS,引起氧化应激、相关酶活性下降和DNA损伤,最终诱导细胞凋亡[51, 72]。BPNS进入细胞内还可导致自噬体数量增加,诱导细胞自噬[55]。层状的BPNS还可破坏细胞膜的完整性,释放内容物,导致细胞死亡[50]。BPNS还能对免疫细胞[53]和血浆蛋白[54]产生影响,导致溶血现象[28]。
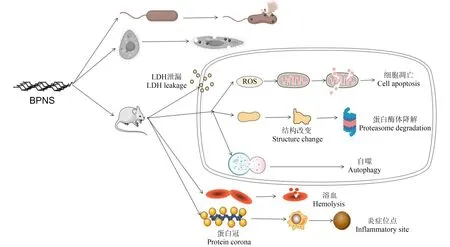
图3 BPNS生物毒性机制Fig. 3 Mechanisms of BPNS’s biotoxicity
目前,关于BPNS的生物毒性和机制均未完全了解。在毒性评估过程中,细胞类型会影响BPNS毒性检测结果,所以将来研究要以多种细胞系作为研究对象。还可以用原代细胞[63]、干细胞[64]以及类器官[65-66]等更接近人体细胞或真实体内环境的模型,评估BPNS纳米材料生物毒性效应和作用机制。其次,在研究BPNS细胞毒性时,最好运用多种标准的方法综合评估,以减少不同方法间的系统误差。再者,还要分析比较BPNS材料本身物理化学性质对生物毒性的影响,例如尺寸、形状、聚集状态、电荷密度和带隙等。表面修饰也会影响BPNS稳定性和降解速率。例如,有研究通过粒子掺杂和表面钝化等方式设计出更安全的纳米材料[78],这也为解决BPNS将来在临床转化中的安全性问题提供了一个思路。
动物实验对于全面评估BPNS毒性至关重要,现有关于BPNS体内毒性研究还不够全面、深入。(1)目前BPNS体内毒理学实验较少,实验对象也局限在小鼠上,缺乏对BPNS在其他脊椎动物体内的研究,如鱼类、两栖类等。Peng等[79]将体外建立的氧化应激模式应用于水生生物斑马鱼体内,以此来评估纳米颗粒对生物的潜在损伤作用。(2)BPNS缺乏急性重复、亚急性和慢性暴露实验数据,目前实验多数采取的是单次急性暴露。将来BPNS大量投入使用,人们势必在日常生产、生活中通过接触、摄入、吸入等多种方式频繁暴露于BPNS。因此,有必要开展多种途径、长期毒性暴露实验。(3)还要研究BPNS对不同器官、组织的影响,寻找BPNS的毒性靶器官,全面评估BPNS生物安全性,深入研究揭示BPNS的毒性机制。(4)在对BPNS纳米材料进行风险评估时,应该将暴露特征与潜在危害综合起来分析。如同Lin等[80]总结了纳米材料进入水环境的潜在接触途径、纳米材料的命运、在不同介质间的转移,以及使用模式生物进行的毒性测试,以此对纳米材料进行更系统的风险评估。
总而言之,BPNS与生物大分子及生态环境之间的相互影响和作用机制亟待开展研究,BPNS生物安全性研究有助于其未来的安全应用,可促进BP纳米材料的产业转化,保障人群和生态环境健康。

