儿童吉兰-巴雷综合征需要辅助呼吸的危险因素分析
李承 孙瑞迪 冯丽 江军
(华中科技大学同济医学院附属武汉儿童医院神经电生理室,湖北武汉 430016)
吉兰-巴雷综合征(Guillain-Barrésyndrome,GBS)是一种自身免疫性多发性神经根神经病,典型临床表现为逐渐进展的运动无力,伴腱反射减弱或消失,是儿童急性弛缓性麻痹的常见病因之一[1]。呼吸肌受累为GBS最危险并发症。儿童GBS中,高达40%患儿会发生呼吸肌无力,需进入重症监护室(intensive care unit,ICU)进行治疗,严重者可导致死亡[2]。准确预测和判断病情可让临床医生早期进行针对性治疗,从而改善预后。既往研究显示起病速度快、颅神经受累、轴突亚型、自主神经受累等是儿童GBS需要辅助呼吸的危险因素[3-5]。迄今为止,国外儿童GBS前瞻性研究和横向研究主要集中在临床症状、电生理分型和神经传导数据方面[3-4]。2020年,国内儿童GBS回顾性研究显示脑脊液蛋白浓度与辅助呼吸无相关性[5],但 缺 乏C-反 应 蛋 白(C-reactive protein,CRP)与GBS辅助呼吸相关性的报道。CRP在固有免疫中发挥重要作用,微生物感染或无微生物的炎症反应中均可见CRP水平增高[6],目前国内尚缺乏相应实验室指标与疾病严重程度的报道。本研究通过回顾性总结武汉儿童医院儿童GBS的临床资料,了解其GBS需要辅助呼吸的发生率,探讨儿童GBS需要辅助呼吸的相关危险因素,为早期识别需要辅助呼吸的高危GBS患儿和提高儿童GBS的预后提供临床依据。
1 资料与方法
1.1 研究对象
回顾性选取我院2010年12月至2020年12月107例GBS患儿为研究对象,入组标准为:(1)诊断年龄3~16岁;(2)经典型GBS[7]。排除标准:复发和变异型GBS,慢性脱髓鞘性多发性神经病。根据是否需要辅助呼吸,分为需要辅助呼吸组(n=16)和不需要辅助呼吸组(n=91)。
本研究获华中科技大学同济医学院附属武汉儿童医院人类研究伦理委员会批准(2019010)。
1.2 临床资料收集
收集所有研究对象的临床资料,包括诊断年龄,前驱感染病史、颅神经和自主神经受累、肢体疼痛,脑脊液结果(细胞数和蛋白水平)和治疗情况。根据休斯功能分级量表(Hughes Functional Grading Scale,HFGS)判断疾病严重程度[8]。如果患儿在住院期间进行2次或多次腰椎穿刺检查,记录第1次检查结果。
1.3 神经电生理检测和分型
应用丹麦Dantec公司Keypoint 4肌电图仪。操作按标准化流程完成。患儿放松卧位于安静、屏蔽的室内,室温25~28℃,肢体温度32~34℃。表面电极用于神经传导检查:所有患儿均行至少2条运动神经、2条感觉神经传导检查,范围包括单侧上下肢运动和感觉神经传导测定。GBS分为急性炎症性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyneuropathy,AIDP)、轴索型、不能分类型[9]。如果患儿在住院期间进行2次电生理检查,根据第2次检查结果判定电生理亚型。
1.4 统计学分析
用SPSS17.0软件进行数据分析。正态分布计量资料以均数±标准差(±s)表示,组间比较采用两样本t检验;非正态分布计量资料以中位数和四分位数间距[M(P25,P75)]表示,组间比较采用Wilcoxon秩和检验。计数资料以例数和率(%)表示,组间比较采用χ2检验或校正χ2检验。多因素分析采用二分类logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床一般资料
共纳入107例GBS患儿,其中男63例(58.9%),女44例(41.1%),中位诊断年龄6.9(4.7,9.9)岁。前驱感染病史见于78例(72.9%)患儿,其中腹泻21例,上呼吸道感染56例,水痘1例。整个病程中,颅神经受累26例(24.2%),其中面肌和/或延髓肌无力21例。肢体疼痛34例(31.8%),自主神经受累16例(15.0%),需要辅助呼吸16例(15.0%)。脱髓鞘型73例(68.2%),轴突型21例(19.6%),不能分类型13例(12.1%)。中位脑脊液蛋白浓度为1.01(0.66,1.57)g/L,中位脑脊液细胞数为4(2,5)×106/L。
107例GBS患儿均予静脉注射用免疫球蛋白(intravenous immunoglobulin therapy,IVIG)治疗,95例(88.8%)疗效良好,12例(11.2%)疗效不佳,其中9例给予第2次IVIG治疗,间隔时间在6.0(5.5,7.0)d,3例在第1轮IVIG治疗后给予血浆置换,无死亡病例。
2.2 GBS患儿需要辅助呼吸的单因素分析
需要辅助呼吸组起病到病情高峰期天数短于不需要辅助呼吸组,首次就诊HFGS得分高于不需要辅助呼吸组,延髓和/或面肌无力比例高于不需要辅助呼吸组(P<0.05)。两组间前驱感染病史、肢体疼痛、CRP异常、自主神经受累、轴突亚型比例,以及诊断年龄、脑脊液蛋白含量差异均无统计学意义(P>0.05)。见表1。

表1 GBS患儿需要辅助呼吸的单因素分析
2.3 GBS患儿需要辅助呼吸的多因素分析
单因素统计分析中P<0.05的因素,即面肌和/或延髓肌无力比例、首次就诊HFGS得分、起病到病程高峰期天数纳入多因素logistic回归分析。结果显示,面肌和/或延髓肌无力(OR=5.053,95%CI:1.412~18.083,P<0.05)和起病到病情高峰期天数短(OR=1.239,95%CI:1.026~1.496,P<0.05)是需要辅助呼吸的危险因素,见表2。
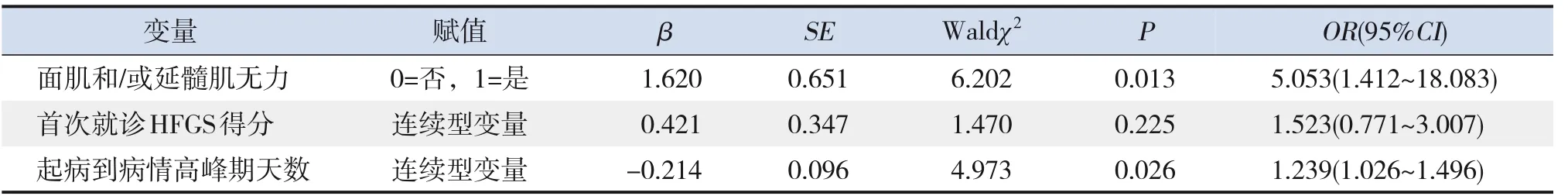
表2 GBS患儿需要辅助呼吸的多因素分析
3 讨论
GBS是儿童急性弛缓性麻痹最常见的原因,18岁以下儿童发生率为(0.66~1.8)/100 000[3]。呼吸功能不全是GBS的最严重并发症,儿童GBS发生率为9.6%~40%[2-5]。预防和识别呼吸功能不全是GBS治疗的重点目标,需探讨儿童GBS呼吸功能不全的相关危险因素,以早期识别,及时干预。本研究显示,面肌和/或延髓肌无力和起病到病情高峰期天数短为GBS需要辅助呼吸的危险因素。
国外文献显示,面肌和/或延髓肌无力与GBS辅助呼吸有关,口咽部反射受损影响呼吸功能为可能原因[10-11]。儿童GBS前瞻性研究、预测辅助呼吸模型和Meta分析均显示颅神经受累或延髓肌无力是辅助呼吸危险因素[3,12-13]。GBS电生理亚型与辅助呼吸的相关性存在争议[4,11],脱髓鞘型为欧洲和北美GBS主要亚型,但轴突型为亚洲GBS的主要亚型,不同区域亚型构成存在差异性[14]。可逆性传导阻滞影响亚型分类为不同亚型与辅助呼吸间关系存在争议的可能原因[14-15]。2020年国内儿童GBS辅助呼吸危险因素研究中,轴突亚型为GBS需要辅助呼吸的危险因素[5]。本研究数据显示轴突亚型不是GBS需要辅助呼吸的危险因素,分析可能与两个研究中轴突亚型构成不同有关。电生理亚型是否为GBS辅助呼吸危险因素仍需大样本、多中心的研究进行验证。起病到病情高峰期天数为评估疾病进展速度指标之一,2018年Meta分析证实疾病进展速度快为GBS需要辅助呼吸风险因素[13]。本研究多因素logistic回归分析显示,起病到病情高峰期时间短为GBS需要辅助呼吸的危险因素,而Hu等[16]研究显示儿童GBS起病到病情高峰期时间不是GBS辅助呼吸的危险因素。两研究结果的不同,可能与病情高峰时间点的确定受主观判断影响有关。
Erasmus GBS呼吸功能不全评分(Erasmus GBSRespiratory Insufficiency Score,EGRIS)用 于评估成人GBS需要辅助呼吸的风险。EGRIS预测入院第1周内辅助呼吸发生率,指标包括从开始无力到入院的天数、入院时面肌和/或延髓肌无力,以及入院时医学研究理事会评分(Medical Research Council Score,MRC),在成人GBS中方便适用[17]。MRC评估肌力需要患者良好配合程度,与MRC量表相比较,HFGS需要的配合程度较低,更适合儿童运动功能评估。本研究显示入院首次HFGS得分与是否需要辅助呼吸有关,但不是GBS需要辅助呼吸的危险因素,分析可能与HFGS评估运动状态而MRC评估四肢肌力有关。儿童GBS自主神经受累发生率为14%~77%[4-5,12,18-19]。GBS自主神经受累是周围神经系统受累严重的临床特征,伴有自主神经功能受累的GBS病死率和运动功能预后更差[20]。在国外一项GBS与自主神经受累研究中,50%的轻症GBS伴有自主神经功能异常且与疾病严重程度无相关性[19]。自主神经受累与GBS需要辅助呼吸关系存在争议[4,18-20],本研究显示自主神经受累与需要辅助呼吸无相关性。分析可能原因:首先,需要辅助呼吸的GBS患儿长时间卧床、呼吸肌和镇静药物的使用均可增加自主神经受累发生率[20];其次,各医疗机构样本量不同和心电检查持续时间长短影响心脏功能异常率判断[20]。脑脊液中蛋白浓度的升高为GBS重要实验室检查指标,国外回顾性研究显示发病1周内50%GBS患者脑脊液蛋白浓度增加,发病第2周内80%GBS患者脑脊液蛋白浓度增加[21],起病到腰椎穿刺的天数影响脑脊液蛋白浓度。GBS脑脊液中蛋白含量增加是血脑屏障水平毛细血管扩张能力增强和鞘内免疫球蛋白增加的综合效应。脑脊液蛋白增高与神经根炎症、抗体和补体沉积及神经功能障碍相关联,且与疾病严重程度和是否需要辅助呼吸相关联[22]。本研究显示脑脊液蛋白与是否需要辅助呼吸无相关性。分析可能与入组GBS起病到进行脑脊液检查的时间存在差异性有关。CRP是一种由肝脏合成的正性急性期因子,炎症和感染发生后数小时内升高,CRP可用于预测GBS辅助呼吸和预后判断[6]。因CRP为定性数据,限制其在预测GBS辅助呼吸中的作用。
综上,面肌和/或延髓肌无力、起病到病情高峰期天数短为GBS需要辅助呼吸的危险因素。对危险因素的识别可尽早预防并发症发生和改善GBS患儿的预后。

