慢性阻塞性肺疾病并发肺部曲霉菌感染的危险因素分析
陈杰 吴科芳
1慈溪市第三人民医院医疗健康集团(总院)呼吸与危重症医学科,浙江宁波315324;2慈溪市第三人民医院医疗健康集团长河分院内科,浙江宁波315324
据2018年中国成人肺部健康研究流行病学调查报告显示,我国慢性阻塞性肺疾病(COPD)患者人数接近1亿,其中40岁以上人群患病率为13.7%,60岁以上患病率超过27%[1]。COPD常伴随肺部感染,易反复,可继发呼吸衰竭[2]。近年来随着广谱抗菌药物的使用及侵袭性操作次数的增加,侵袭性肺部真菌感染的发生率逐渐增高。曲霉菌是侵袭性肺部真菌感染常见的病原体之一,多发于老年COPD患者。本研究选取2016年1月至2019年1月慈溪市第三人民医院收治的60例COPD患者,分析COPD患者并发肺部曲霉菌感染的危险因素,期望为COPD并发肺部曲霉菌的诊断、治疗与预防提供参考,现报告如下。
对象与方法
一、研究对象
收集2016年1月至2019年1月于慈溪市第三人民医院收治的60例COPD患者作为研究对象,其中男性33例,女性27例;年龄(65.15±5.38)岁,范围48~74岁;病程(9.16±2.23)年,范围5~11年。纳入标准:(1)符合《慢性阻塞性肺疾病基层诊疗指南(2018年)》[3]对COPD的诊断;(2)肺部曲霉菌感染符合2007年Bulpa提出的诊断标准[4];(3)患者病历资料完整,随访依从性高。排除标准:(1)其他致病菌引起的上呼吸道感染或其他部位的感染;(2)合并其他有呼吸道症状的疾病如支气管扩张、哮喘、肺结核、间质性肺疾病、肺癌等;(3)药物滥用史;(4)意识、沟通障碍或合并精神疾病;(5)实验期间中途退出或死亡者。所有患者均对本研究知情同意,本研究经慈溪市第三人民医院医学伦理委员会审批通过(审批号:LS2021-KY-016)。
二、诊断方法
根据Bulpa提出的COPD合并肺部曲霉菌感染的诊断标准[4],结合临床表现、痰培养结果、生化指标、病理、影像学等检查确诊肺部曲霉菌感染,具体如下:3个月内肺部组织样本细针活检可见曲霉菌菌丝及孢子或组织培养有曲霉菌生长,并伴以下任何项目之一者:①呼吸道分泌物样本曲霉菌培养阳性;②血清曲霉菌特异性抗原(G试验或GM试验)/或抗体筛查阳性;③痰液样本直接涂片镜检找到曲霉菌或组织病理学检查呈阳性。最终确诊22例COPD合并肺部曲霉菌感染患者,设为感染组,其中痰液培养曲霉菌阳性10例,血清曲霉菌抗原或抗体阳性8例,镜检发现曲霉菌菌丝或组织病理学阳性4例;另将38例未感染者设为非感染组。
三、观察指标
收集两组患者的一般情况包括性别、年龄、病程、肺功能分级(GOLD分级)、吸烟史、合并糖尿病、慢性心力衰竭、使用糖皮质激素、抗菌药使用及血清白蛋白等,临床表现包括咳嗽、咳痰、胸痛、发热、呼吸困难、乏力、食欲减退,以及胸部CT检查等资料,进行对比分析。
四、统计学方法
采用SPSS22.0软件处理数据。符合正态分布的计量资料以±s表示,组间比较采用t检验;计数资料以例数和构成比表示,组间比较采用χ2检验。以是否感染为因变量,采用Logistic回归分析COPD并发肺部曲霉菌感染的危险因素。P<0.05表示差异具有统计学意义。
结 果
一、COPD患者感染肺部曲霉菌的单因素分析
肺部曲霉菌感染组与非感染组患者在合并糖尿病、使用糖皮质激素、抗菌药使用时间及血清白蛋白水平等方面比较差异有统计学意义(χ2=4.411、10.094,t=12.462、-5.943,P均<0.05)。影像学表现上,除渗出表现外(χ2=3.579,P>0.05),两组患者在胸膜下密度增高结节实变、晕轮征、新月征、空洞表现等方面比较差异有统计学意义(t=6.313、5.455、7.073、4.689,P<0.05)。两组患者在性别、年龄、病程、肺功能分级(GOLD分级)、吸烟史、慢性心力衰竭、咳嗽、咳痰、胸痛、发热、呼吸困难、乏力、食欲减退方面等方面比较差异不具有统计学意义(P均>0.05)。详见表1。
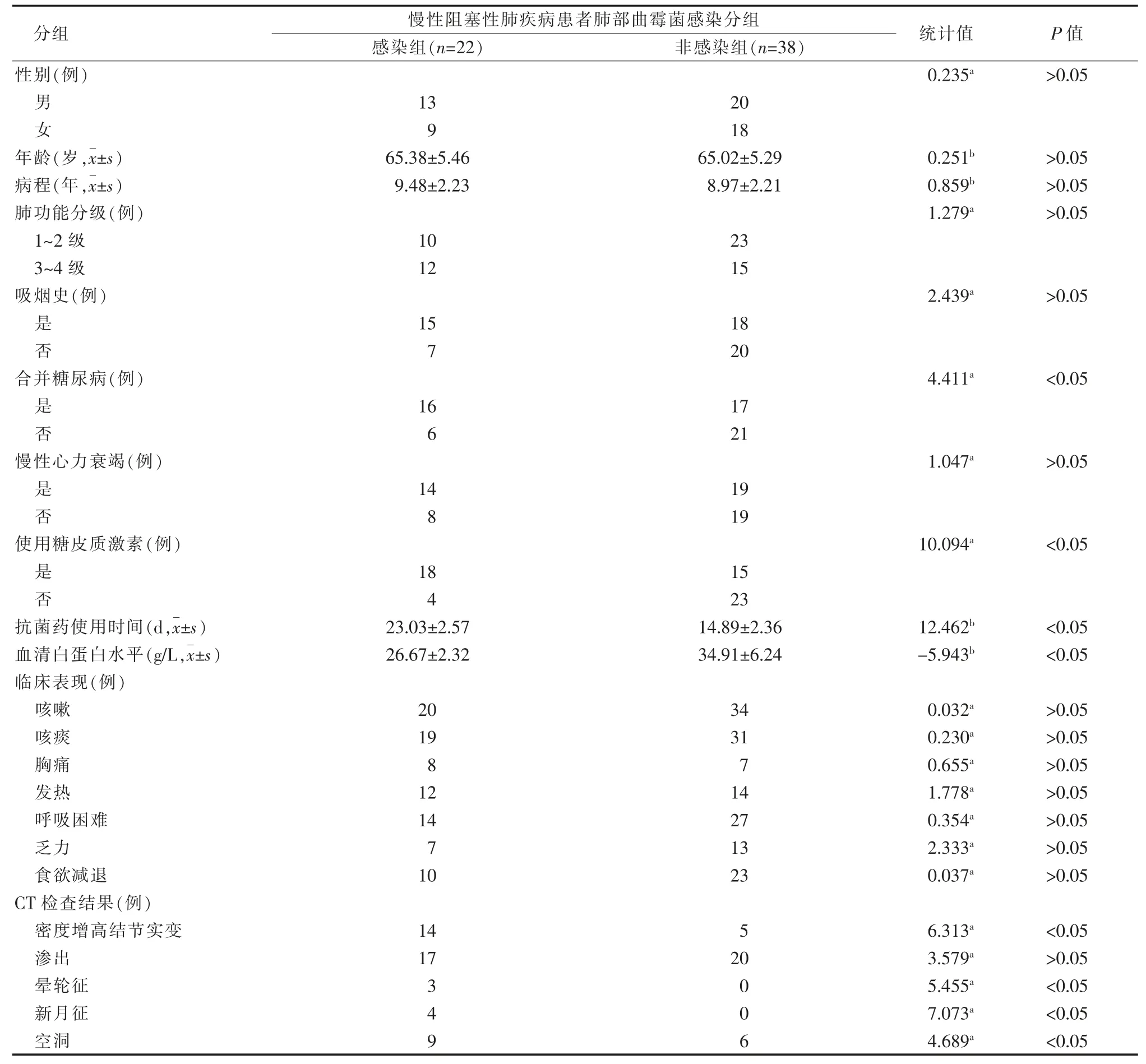
表1 慢性阻塞性肺疾病患者肺部曲霉菌感染的单因素分析
二、多因素Logistic回归分析结果
将表1中有统计学意义的变量纳入Logistic回归模型,结果显示合并糖尿病(OR=3.294,95%CI:1.058~10.253)、使用糖皮质激素(OR=6.900,95%CI:1.950~24.415)、 抗 菌 药 物 使 用 时 间 长 (OR=8.396,95%CI:1.093~64.493)及血清白蛋白水平低(OR=0.569,95%CI:0.416~0.778)是导致COPD并发肺部曲霉菌感染的独立危险因素,见表2。
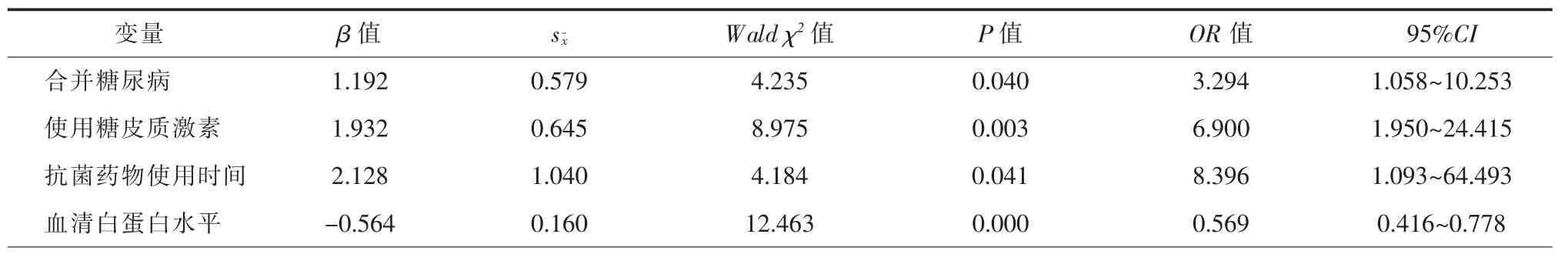
表2 慢性阻塞性肺疾病患者肺部曲霉菌感染的危险因素分析
三、两组患者预后的比较
经止咳、祛痰、平喘、抗感染及氧疗治疗后,肺部曲霉菌感染组患者好转14例(63.64%),未愈或死亡8例(36.36%);非感染组患者好转34例(89.47%),未愈或死亡4例(10.53%)。两组预后比较差异有统计学意义(χ2=5.813,P<0.05)。
讨 论
曲霉菌病多为继发性疾病,在长期应用广谱抗菌药物、免疫力低下或使用免疫抑制剂等情况下病原菌可经皮肤黏膜损伤处或呼吸道,进入血液循环到其他组织或器官而致病。COPD患者以老年人群为主[5],而肺部感染又进一步加重COPD病情,形成恶性循环。调查研究表明,住院COPD患者发生侵袭性曲霉菌病的概率为1.3%~3.9%[6]。由于曲霉菌感染后的临床表现往往缺乏特异性,因此早期诊断具有一定难度[7],加上缺乏有效的治疗手段,COPD合并肺部曲霉菌感染患者的死亡率居高不下。本研究结果显示,感染和非感染组患者临床症状大多和原发病相似或被掩盖,与吴克和赵丽敏[8]的研究结果一致。此外本研究还发现除渗出表现外,两组患者CT检查显示胸膜下密度增高结节实变、晕轮征、新月征和空洞表现有差异,这些表现可辅助曲霉菌感染的诊断。
本文多因素分析结果显示,合并糖尿病、使用糖皮质激素、抗菌药物使用时间长及血清白蛋白水平低均是导致COPD并发肺部曲霉菌感染的独立危险因素,这与吴钟辉等[9-10]得出的结果相近。糖尿病患者由于胰岛素缺乏长期处于高血糖状态,使得糖、脂质代谢障碍,体液免疫和细胞免疫都存在功能紊乱,更有可能发生肺部感染。有资料表明,COPD的治疗方案中抗感染和糖皮质激素治疗占重要地位,糖皮质激素可通过不同分子机制抑制细胞因子的释放,影响免疫细胞的活性、分化、迁移能力及部分炎症因子的表达,造成获得性免疫缺陷[11],长期、大量使用抗菌药物同样会破坏机体正常菌群的平衡,包括曲霉菌在内的机会致病菌大量增殖,从而增加感染的机会。另外血清白蛋白水平反映了机体营养状况,血清白蛋白水平偏低,表现为营养不良,进一步导致低蛋白血症,患者处于高代谢应激状态,导致机体免疫细胞(如巨噬细胞、中性粒细胞、淋巴细胞等)对抗原的免疫反应能力下降[12]。上述因素均可能加重气道黏膜损伤和免疫功能损害,增加曲霉菌感染发生率。本文感染组死亡率明显高于非感染组,与李小美等[13]的研究结果接近,说明COPD合并肺曲霉菌感染患者预后相对较差,需要尽早发现感染危险因素并干预。
综上所述,COPD并发肺部曲霉菌感染影像学结果在多数情况下具有特异性,临床医师还需早发现、早诊断、早预防。COPD并发肺部曲霉菌感染的高危因素包括合并糖尿病、使用糖皮质激素、长时间使用抗菌药物及低血清白蛋白水平,临床需加强以上危险因素的预防和控制,从而降低COPD的病死率。由于本研究统计样本量偏少,可能对结果造成偏差,有待今后扩大样本量进一步研究。
利益冲突所有作者均声明不存在利益冲突

