黑曲霉羧肽酶CapA的克隆表达与酶学性质解析
冯玮,宋鹏
(聊城大学生命科学学院,山东 聊城 252000)
羧肽酶(caboxypeptidases,CPs)是一类重要的外切蛋白酶,水解蛋白或多肽链的C端特定肽键,逐个降解释放游离氨基酸。根据催化机制不同,羧肽酶分为丝氨酸羧肽酶(EC3.4.16.-)、金属羧肽酶(EC3.4.17.-)和半胱氨酸羧肽酶(EC3.4.18.-)[1]。羧肽酶由于具有独特的水解作用,在食品工业中常用于酶法生产氨基酸[2]、制备寡肽[3]、蛋白水解物脱苦和提升风味[4],部分特殊种类的羧肽酶还应用到生物技术领域中多肽的特异性裂解[5]和多肽氨基酸序列测定[6]。
羧肽酶在动植物、真菌及细菌中均有发现[7],但动植物体内羧肽酶含量低、成分复杂,提取成本较高,利用微生物发酵是当今获得羧肽酶的主要方法。目前已有多种来源的羧肽酶被克隆表达,主要是微生物羧肽酶尤其是真菌来源的羧肽酶[8]。其中,已被克隆表达的黑曲霉羧肽酶有2种:羧肽酶D-I(PepF)和羧肽酶DII(PepG)[9]。
黑曲霉CBS 513.88的基因组序列于2007年完成解析并公布,但黑曲霉的蛋白数据库显示还有许多功能未确定的蛋白[10]。本文通过对黑曲霉CBS 513.88基因组全面阅读和必要的比对分析,发现了一个疑似编码丝氨酸羧肽酶的基因,并将该基因在毕赤酵母进行克隆与表达,系统解析了重组酶的酶学性质,为进一步挖掘其应用价值奠定了良好的基础。
1 材料与方法
1.1 材料与仪器
黑曲霉CGMCC 3.7193:中国普通微生物菌种保藏管理中心保藏;克隆宿主菌大肠杆菌(E.coli JM109)、表达宿主菌毕赤酵母(P.pastoris GS115)、表达质粒pPIC9K:聊城大学生物工程实验室保藏;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、LB 培养基:北京奥博星生物技术有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、最小葡萄糖(minimaldextrose,MD)培养基、缓冲复合甘油(buffered glycerol-complex medium,BMGY)培养基、缓冲复合甲醇(buffered methanol-complex medium,BMMY)培养基:北京索莱宝生物技术有限公司。
聚合酶链式反应引物CapA-F:5′-GTAGTCCTCCAGCCAGAGGAACCATC-3′、CapA-R:5′-TGCTCTAGATCACTCAGTAAACGATGCCCCG-3′(下划线部分为限制性酶切位点):由生工生物工程(上海)股份有限公司合成。
限制性内切酶、Pyrobest DNA聚合酶、T4DNA连接酶:TaKaRa公司;质粒提取试剂盒、DNA纯化回收试剂盒:北京庄盟国际生物基因科技有限公司;RNA提取试剂盒、cDNA合成试剂盒:Invitrogen公司;化学合成底物苄氧羰基-丙氨酰-精氨酸(N-carboben zoxy-L-alanyl-L-arginine,CBZ-Ala-Arg)、苄氧羰基-脯氨酰-甘氨酸(N-carboben zoxy-L-prolyl-L-glycine,CBZPro-Gly)、苄氧羰基-丙氨酰-赖氨酸(N-carboben zoxy-L-alanyl-lysine,CBZ-Ala-Lys)、苄氧羰基-甘氨酰-丙氨酸(N-carboben zoxy-L-glycyl-alanine,CBZGly-Ala)、苄氧羰基-丙氨酰-谷氨酸(N-carboben zoxy-L-alanyl-glutamate,CBZ-Ala-Glu)、苄氧羰基-苯丙氨酰-亮氨酸(N-carboben zoxy-L-phenylalanyl-L-leucine,CBZ-Phe-Leu):由浙江昂拓莱司生物技术有限公司合成。
ArktikTMPCR热循环仪:赛默飞世尔公司;MicroPulser电穿孔仪:美国伯乐(Bio-Rad)公司;DYCP-31DN凝胶电泳仪、DYCZ-25E型P4垂直电泳仪:北京六一仪器厂;JY04S-3C凝胶成像系统:北京君意东方电泳设备有限公司;SP-2012UV型分光光度计:上海光谱仪器有限公司。
1.2 试验方法
1.2.1 基因克隆与重组菌构建
黑曲霉总RNA提取,反转录合成第一链cDNA,用已合成引物以第一链cDNA为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,及后续的PCR产物纯化、酶切、连接、转化E.coli JM109,筛选阳性克隆子按照实验室常规方法进行[11];重组质粒线性化、电转化P.pichia GS115及毕赤酵母重组菌GS115(pPIC-CapA)的筛选按照毕赤酵母表达手册提供的方法进行。
1.2.2 重组酶的诱导表达与初步纯化
毕赤酵母重组菌GS115(pPIC-CapA)在YPD平板上纯化,挑选单菌落接种于YPD液体培养基(25 mL),于30℃、200 r/min培养18 h~20 h,然后,1%接种量转接BMGY培养基(25 mL),于30℃、200 r/min培养16 h~18 h至对数期(OD600=2.0~6.0),8 000 r/min 离心5 min收集菌体,再将菌体重悬于适当体积BMMY培养基,至OD600值为1.0,于30℃、200 r/min培养诱导,每24 h补加无水甲醇至终浓度0.5%,维持诱导120 h,发酵结束。发酵液4℃,8 000 r/min离心收集上清液,即为粗酶液。
粗酶液经30%~70%的硫酸铵分级沉淀,用截留分子量为50 kDa的透析袋透析,实现初步纯化。
1.2.3 重组羧肽酶活力测定
羧肽酶酶活测定参照Morita等[3]的方法,并做简单优化。酶活测定以CBZ-Phe-Leu为底物,用pH6.0的磷酸氢二钠-柠檬酸缓冲液(0.1 mol/L)配制1 mmol/L底物溶液。取450 μL底物,加入50 μL适当稀释的酶液于37℃反应60 min,立即加入500 μL 0.5%茚三酮溶液,混合液置于100℃水浴加热15 min,加热完毕后自来水冷却5 min,用分光光度计测定A570的吸光值。配制不同浓度标准酪氨酸溶液,同样条件下与茚三酮反应,绘制标准曲线。
酶活定义:在37℃,1 min水解底物生成1 μg酪氨酸的酶量定义为一个酶活力单位(U)。
1.2.4 重组羧肽酶的酶学性质分析
1.2.4.1 最适温度及温度稳定性测定
分别检测羧肽酶在30℃~70℃,pH 6.0条件下的酶活值,确定该酶最适作用温度。
将酶液分别置于30℃~70℃,保温处理0.5、1、1.5、2 h,按1.2.3项进行酶活测定,未进行热处理的酶液作对照(酶活为100%),计算相对酶活,考察羧肽酶的热稳定性。
1.2.4.2 最适pH值及pH稳定性测定
分别检测羧肽酶在pH 4.0~8.0,45℃条件下的酶活值,确定该酶最适作用pH值。
将酶液分别置于pH 4.0~8.0缓冲液中保温1 h(温度45℃),按1.2.3项进行酶活测定。酶活最高值为100%,考察羧肽酶的pH稳定性。使用的缓冲液是0.1 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH 4.0、5.0、5.5、6.0、6.5、7.0、8.0)。
1.2.4.3 金属离子和化学试剂对酶活的影响
在羧肽酶和底物反应体系中分别加入终浓度1 mmol/L的金属离子和化学试剂。按1.2.3项进行酶活测定。以不加金属离子和化学试剂体系中的酶活为100%,计算各金属离子和化学试剂存在时的相对酶活。
1.2.4.4 底物特异性分析
羧肽酶分别与1 mmol/L的CBZ-Ala-Arg、CBZPro-Gly、CBZ-Ala-Lys、CBZ-Gly-Ala、CBZ-Ala-Glu 或CBZ-Phe-Leu反应,按照1.2.3项进行酶活测定。以CBZ-Phe-Leu为底物时的酶活测定值为100%,计算其它底物与羧肽酶反应的相对酶活值。
1.2.5 生物信息学分析
利用美国国家生物信息中心网站查找黑曲霉和其它来源丝氨酸羧肽酶氨基酸序列;用Clustal X2和Biodit进行序列比对分析;MEGA 5.0以临近法(Neighbour-joining)构建进化树,分析亲缘关系[12]。
2 结果与分析
2.1 羧肽酶基因的克隆与序列分析
A.niger CBS 513.88基因组(EMBL AM270980-AM270998)已经解析[10],通过阅读其基因组信息和BLAST分析,发现一个新的疑似丝氨酸羧肽酶基因(carboxypeptidase,CapA)。以CapA-F和CapA-R为引物,提取的黑曲霉F0510 cDNA为模板,成功扩增出该基因,并构建了重组质粒pPIC-CapA。测序确定CapA具有完整的开放阅读框(open reading frame,ORF),而且核苷酸序列与A.niger CBS 513.88基因组公布的序列完全一致。该丝氨酸羧肽酶基因1 479 bp,编码492个氨基酸。
采用Clustal X2分析比对不同来源的丝氨酸羧肽酶氨基酸序列,整理后汇总于图1。
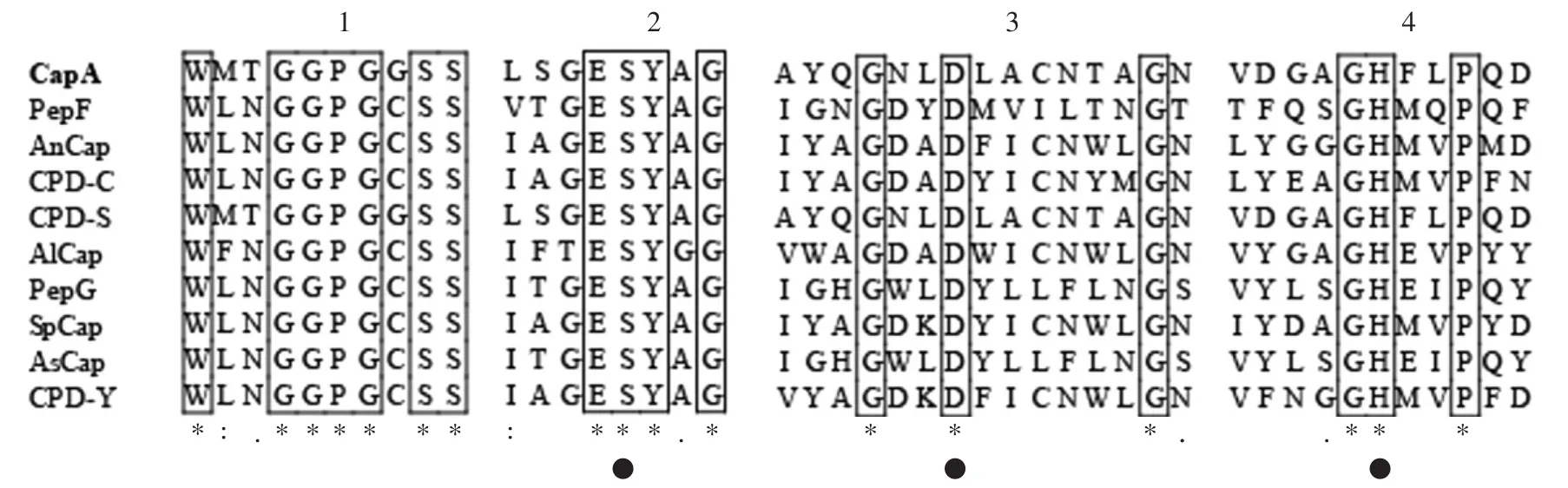
图1 不同来源丝氨酸羧肽酶的氨基酸序列比对Fig.1 Multiple sequence alignment of serine carboxypeptidases from different microorganisms
CapA在结构上存在4个参与底物结合和催化的保守结构域,其中结构域1是保守的底物结构域,结构域2~4是保守的催化结构域,包含由丝氨酸(S)、天门冬氨酸(D)和组氨酸(H)组成的保守三联体(Ser-Asp-His)[3,7],以及一个空间上包围丝氨酸活性残基的GX-S-X保守序列(位于结构域1中)[13]。在负责催化的丝氨酸残基之前有一个保守的谷氨酸(Glu)(位于结构域2中),被认为是丝氨酸羧肽酶在酸性条件发挥最佳催化作用的原因[13]。与其它羧肽酶一样,CapA属于SC族羧肽酶中的S10家族[14]。
利用MEGA 5.0将CapA进一步与已报道的丝氨酸羧肽酶的氨基酸序列进行对比,并构建系统进化树,如图2所示。
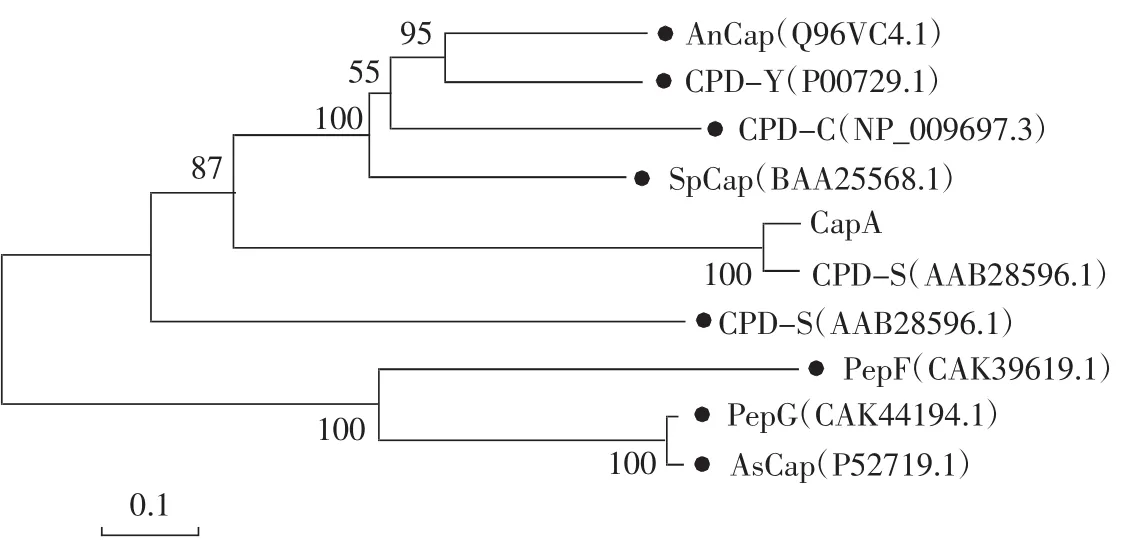
图2 进化树描述不同来源的丝氨酸羧肽酶的遗传距离Fig.2 Phylogenetic tree describing the genetic distances among various serine carboxypeptidases from different microorganisms
进化树反映了10种不同来源丝氨酸羧肽酶之间的遗传距离,遗传距离短说明亲缘关系近,并聚集在一起。CapA与其他丝氨酸羧肽酶氨基酸序列相似度介于 15.76%(SpCap)~93.09%(AlCap),平均值为30.45%。CapA与AlCap的相似度最高,为93.09%。
2.2 羧肽酶的诱导表达
重组质粒pPIC-CapA经限制性内切酶SacⅠ线性化,电转化毕赤酵母GS115,经过一系列筛选,获得重组菌GS115(pPIC-CapA)。采用摇瓶培养,并伴随甲醇诱导120 h后,粗酶液酶活达到最高值109.7 U/mL。通过盐析、透析对CapA的粗酶液初步纯化后,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electropheresis,SDS-PAGE)见图 3。

图3 蛋白电泳分析重组酶CapA的纯化效果Fig.3 SDS-PAGE analysis of the purification of the recombinant enzyme CapA
由图3分析表明,CapA的分子量约为60.0 kDa,略大于理论分子量52.7 kDa,推断是糖基化所致,丝氨酸羧肽酶在合成过程中普遍要进行糖基化修饰[7]。
2.3 羧肽酶的酶学性质
2.3.1 最适温度及温度稳定性
温度对CapA酶活性和稳定性的影响如图4。

图4 温度对CapA酶活性和稳定性的影响Fig.4 Effect of temperature on the activity and stability of CapA
由图4a可知,CapA的最适温度是45℃,在30℃~55℃相对酶活可维持在70%以上。热稳定性研究表明(图4b),在30℃~50℃孵育1 h后,CapA的酶活可保持80%以上,在60℃和70℃孵育2 h,酶活仍能分别保留30%和10%以上。
CapA的最适反应温度和热稳定性明显高于A.oryzae羧肽酶的最适温度(30℃)和热稳定性(60℃孵育 30 min,酶活低于 10%)[3],也高于 S.cerevisiae来源重组羧肽酶Y的最适温度(约30℃)和热稳定性(60℃孵育1 h,几乎检测不到酶活)[16]。CapA相比于其它羧肽酶有更好的耐热性,使其应用时在简化工艺、提高效率和降低成本等方面存在优势[21]。
2.3.2 最适pH值及pH值稳定性
pH值对CapA的酶活性和稳定性的影响如图5所示。

图5 pH值对CapA的酶活性和稳定性的影响Fig.5 Effect of pH on the activity and stability of CapA
由图5a可知,CapA的最适pH值是6.0,在pH 5.0~6.5相对酶活可维持在60%以上。pH值小于5.0或大于6.0时,酶活快速下降。pH值稳定性研究表明(图 5b),CapA 在 pH 4.0~8.0都比较稳定,孵育 1 h,酶活可保持60%以上,CapA和其它来源的羧肽酶相似,都在酸性条件发挥最佳水解作用,但与大多丝状真菌和酵母菌来源的羧肽酶最适pH值位于4.0附近不同[3,22-23],CapA的最适反应pH值和pH值稳定范围更偏向中性,和已报道的S.cerevisiae来源的羧肽酶Y相似[16],其发挥作用偏向中性pH值的反应体系,更方便酶作用后产物的后续处理。
2.3.3 金属离子和化学试剂对酶活的影响
金属离子和化学试剂对CapA酶活的影响见表1。
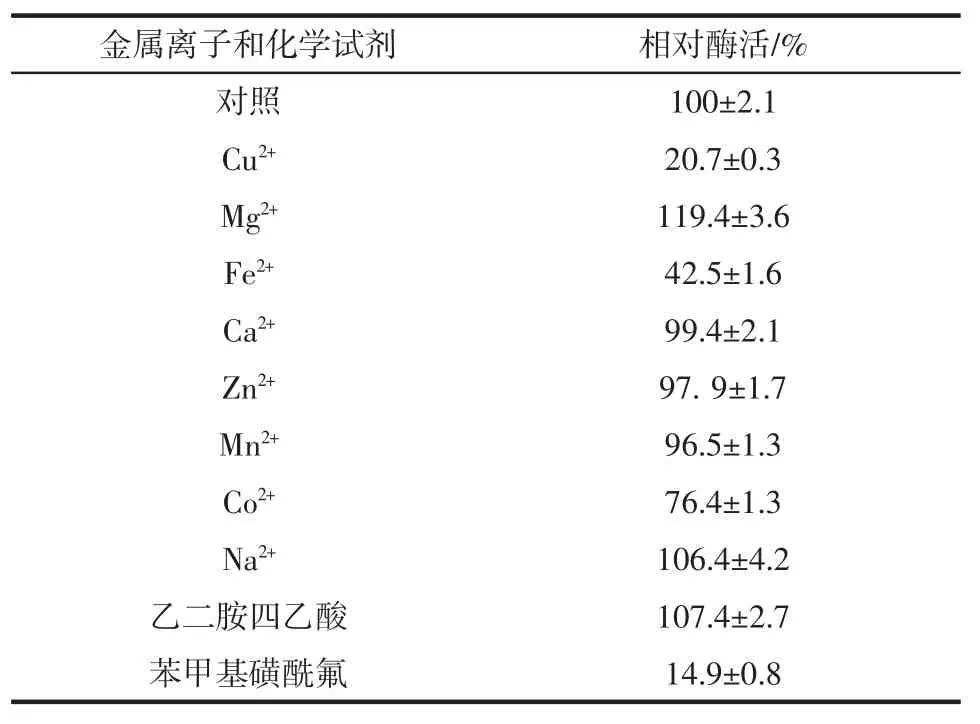
表1 金属离子和化学试剂对CapA酶活的影响Table 1 Effect of metal ions and chemicals on the enzymatic activity of CapA
Mg2+显著提高 CapA 酶活,Cu2+、Fe2+和 Co2+明显抑制酶活,而Ca2+、Zn2+和Mn2+则对酶活几乎没有影响。CapA属丝氨酸蛋白酶,其活性中心不需要金属离子辅助[23],乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)螯合后,酶活不受影响也说明了这一点。所以金属离子应该是与酶的一些关键氨基酸形成配位键后改变了酶的构象,从而影响了酶的活性[24]。苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)对重组酶的酶活性抑制率达80%以上,PMSF作为丝氨酸蛋白酶的特异性抑制剂,对曲霉羧肽酶OcpC、红曲霉羧肽酶等丝氨酸羧肽酶都有抑制作用[3]。
2.3.4 CapA水解底物特异性
以6种CBZ-aa-aa为底物,CapA的水解特异性结果见图6。
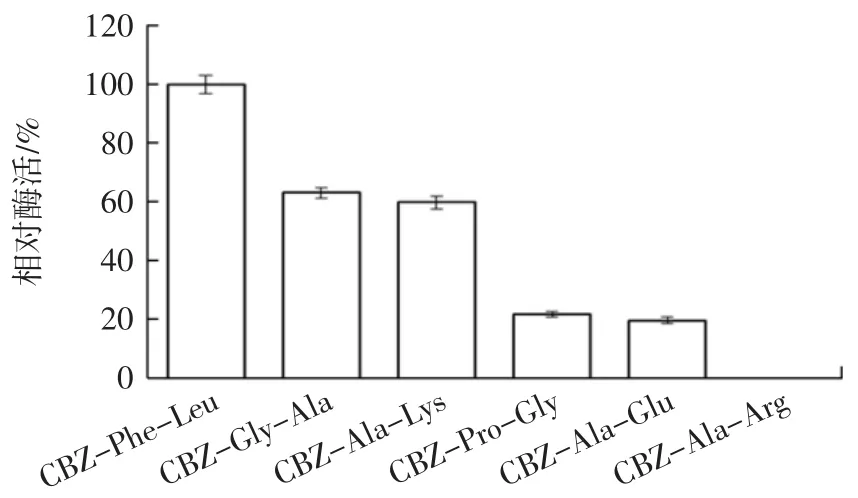
图6 重组羧肽酶的底物特异性Fig.6 Substrate specificity of recombinant carboxypeptidase
CBZ-Phe-Leu是CapA的最适作用底物。CapA水解6种底物能力大小如下:CBZ-Phe-Leu>CBZ-Gly-Ala>CBZ-Ala-Lys>CBZ-Pro-Gly>CBZ-Ala-Glu>CBZAla-Arg(无水解活性)。CapA底物特异性较广泛,并且偏好水解形成寡肽苦味的羧基端疏水性氨基酸Leu和Lys,在蛋白C端测序和寡肽脱苦中有良好的应用潜力[6,8,25],有待进一步研究。
3 结论
本研究首次鉴定了黑曲霉来源的丝氨酸羧肽酶CapA,并成功进行了异源表达。解析了CapA的最适反应温度和温度稳定性、最适反应pH值和pH值稳定性、金属离子和化学试剂对酶活影响、底物特异性等基本酶学特征。系统研究表明,CapA最适反应温度和pH值分别为45℃和6.0;相比已报道羧肽酶,有更好的耐热性(60℃孵育2 h,酶活仍能保留30%)和pH值稳定性(在pH 4.0~8.0环境孵育1 h,酶活可保持60%);其水解底物特征表明CapA在蛋白C端测序和寡肽脱苦中具有应用潜力。

