牛病毒性腹泻病毒两种基因型双重RT-PCR检测方法的建立及应用
王 勤,何 博,欧云文,刘俐君,杨 磊,潘 琴,张 杰
(1.达州职业技术学院,四川达州 635001;2.开江县动物疫病预防控制中心,四川达州 636250;3.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃兰州 730046;4.达州市动物疫病预防控制中心,四川达州 635000)
牛病毒性腹泻(Bovine viral diarrhea,BVD)又称黏膜病(Mucosal disease,MD),是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种急性、热性、高度接触性传染病,BVDV除感染牛外,还可感染猪、羊、鹿以及野生动物,可减少宿主动物外周循环系统和组织内中性粒细胞数量,导致淋巴细胞功能异常,进而机体发生免疫抑制[1]。BVDV感染宿主动物后主要引起腹泻、急慢性黏膜感染、繁殖和免疫障碍,同时伴有其他病原的继发感染与混合感染。怀孕母牛感染后可引起流产和死胎,耐过犊牛则成为持续感染动物(PI),PI牛终生带毒且不断向外排毒,成为BVDV的重要传染源,难以净化[2-3]。目前,该疫病世界范围内流行,流行趋势呈明显上升态势,给养牛业的安全生产带来了严重的挑战,是进出口重点检疫的动物疫病[4-5]。
BVDV为单股正链RNA病毒,属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),病毒基因组全长约12 kb~13 kb,由5′端非编码区(5′-UTR)、3′端非编码区(3′-UTR)和1个开放阅读框(ORFs)组成,其中5′-UTR在BVDV不同毒株间具有高度保守性[6-7]。因此,根据5′-UTR的序列差异可将BVDV分为2种基因型,即BVDV-1型和BVDV-2型。我国的主要流行亚型为BVDV-1,近年来相关监测数据表明BVDV-2感染情况逐步增多[8-10]。BVDV-1和BVDV-2之间具有一定交叉保护作用,但无法达到高效保护,BVDV-1疫苗无法对BVDV-2提供完全保护作用,也无法完全抵抗BVDV-2感染[11-13]。鉴于BVDV-1和BVDV-2型临床症状高度相似,加强BVDV-1和BVDV-2的实验室分型诊断对其综合防控至关重要。本研究根据BVDV-1(AF091605.1、KF501393.1、MK204904.1、MN513404.1和MG923683.1)和BVDV-2 (AF502399.1、MG436782.1、 AF145969.1、KC176777.1和MN513411.1)流行毒株5′-UTR序列设计特异性引物,摸索和优化RT-PCR反应条件,建立一种BVDV双重RT-PCR检测方法,为BVDV的实验室诊断提供技术支持。
1 材料与方法
1.1 材料
1.1.1 毒株及临床样品 BVDV-1(Oregon C24V毒株)、BVDV-2(HLJ-10毒株)、牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)、牛轮状病毒(Bovine rotavirus,BRV)、牛冠状病毒(Bovine coronavirus,BCV)、牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV-3)和猪瘟病毒(Classical swine fever virus,CSFV),均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;临床样品源自2017年-2019年采集于四川省达州及周边地区养牛场。
1.1.2 主要试剂 一步法RT-PCR扩增试剂盒、DNA Marker DL2 000、病毒DNA/RNA提取试剂盒、pMD19-T载体,宝生物工程(大连)有限公司产品;质粒小量制备试剂盒、DNA胶回收试剂盒、PCR清洁试剂盒,AxyPrep公司产品;TaqDNA聚合酶,Fermentas公司产品;牛肾传代细胞(MDBK)、MEM细胞培养液,美国Gibco公司产品;琼脂糖凝胶粉,北京索莱宝科技有限公司产品;蛋白胨、酵母提取物,英国OXOID公司产品;其他试剂为国产分析纯。
1.1.3 主要仪器 PCR仪(T100)、凝胶成像系统,美国Bio-Rad公司产品;冷冻高速离心机,大龙公司产品;琼脂糖凝胶电泳仪,北京六一生物科技有限公司产品;超微量蛋白核酸分析仪(NanoDrop2000),美国Thermo公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank公布的BVDV-1(GenBank:AF091605.1、KF501393.1、MK204904.1、MN513404.1和MG923683.1)和BVDV-2 (GenBank:AF502399.1、MG436782.1、 AF145969.1、KC176777.1和MN513411.1)流行毒株5′-UTR保守序列,设计2对特异性引物(表1),引物由重庆擎科生物有限公司合成。

表1 引物序列
1.2.2 病毒核酸提取 按照病毒DNA/RNA提取试剂盒使用说明书分别提取牛传染性鼻气管炎病毒(IBRV)、牛轮状病毒(BRV)、牛冠状病毒(BCV)、牛副流感病毒3型(BPIV-3)、猪瘟病毒(CSFV)、BVDV-1和BVDV-2核酸,置-70 ℃保存备用。
1.2.3 重组质粒标准品的制备 分别以BVDV-1和BVDV-2总RNA为模板,P1、P2和P3、P4为引物,反应程序:50 ℃ 30 min;95 ℃ 5 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。进行RT-PCR扩增,RT-PCR产物克隆至pMD19-T载体,构建pMD19-T-BVDV-1、pMD19-T-BVDV-2重组质粒,重组质粒送重庆擎科生物有限公司测序鉴定,并测定重组质粒浓度。
1.2.4 单项RT-PCR反应条件的建立及优化 以重组质粒pMD19-T-BVDV-1为模板,重组质粒pMD19-T-BVDV-2、pMD19-T-BVDV-1+pMD19-T-BVDV-2等量混合物和ddH2O为对照组,P1、P2为引物,采用统计学方法依次对模板含量为10 μg、1 μg、0.1 μg、10 ng和1 ng,引物含量为0.25、0.5、0.75、1.0 mmol/L,退火温度为52、53、54、55 ℃进行摸索、优化,确定BVDV-1单项RT-PCR扩增的最适反应条件。与此同时,以重组质粒pMD19-T-BVDV-2为模板,重组质粒pMD19-T-BVDV-1、pMD19-T-BVDV-1+pMD19-T-BVDV-2等量混合物和ddH2O为对照组,P3、P4为引物,按照上述方法摸索和优化BVDV-2单项RT-PCR扩增的最适反应条件,扩增产物进行10 g/L琼脂糖凝胶电泳。
1.2.5 双重RT-PCR反应条件的建立及优化 以重组质粒pMD19-T-BVDV-1和pMD19-T-BVDV-2等量混合物为模板,ddH2O为阴性对照组,P1、P2、P3、P4为引物,采用统计学方法依次对模板含量为10 μg、1 μg、0.1 μg、10 ng和1 ng,引物含量为0.25、0.5、0.75、1.0 mmol/L,退火温度为52、53、54、55 ℃进行摸索、优化,确定BVDV双重RT-PCR扩增的最适反应条件,RT-PCR扩增产物进行10 g/L琼脂糖凝胶电泳。
1.2.6 特异性试验 采用优化的双重RT-PCR最佳反应条件依次对BVDV-1、BVDV-2、IBRV、BRV、BCV、BPIV3和CSFV的核酸,以及BVDV-1、BVDV-2核酸等量混合物进行RT-PCR扩增,对双重RT-PCR检测方法进行特异性分析。
1.2.7 敏感性试验 采用优化的双重RT-PCR最佳反应条件依次对不同稀释度的BVDV-1、BVDV-2核酸分别进行RT-PCR扩增,稀释比例为10-1、10-2、10-3、10-4、10-5、10-6倍,对双重RT-PCR检测方法进行敏感性分析。
1.2.8 重复性试验 采用优化的双重RT-PCR最佳反应条件依次对BVDV-1、BVDV-2、IBRV、BRV、BCV、BPIV-3和CSFV核酸,以及BVDV-1、BVDV-2核酸等量混合物重复检测3次,验证双重RT-PCR检测方法的重复性。
1.2.9 临床样品检测 采用优化的双重RT-PCR最佳反应条件对2017年-2019年采集于达州及周边地区332份具有腹泻症状牛的新鲜粪便样品进行检测,了解四川省达州及周边地区BVDV-1和BVDV-2流行形势,并对双重RT-PCR检测方法进行临床适用性分析。
2 结果
2.1 单项RT-PCR反应条件的建立及优化
对RT-PCR反应条件进行优化,确定了单项RT-PCR扩增反应最适模板用量为5 μL(模板含量为0.1 μg),上、下游引物最适用量各为0.5 μL(引物浓度为0.5 mmol/L),其中BVDV-1最适退火温度为54 ℃,BVDV-2最适退火温度为53 ℃。单项RT-PCR反应体系为:2×One step buffer 25 μL、One step Enzyme Mix 0.5 μL、上游引物0.5 μL、下游引物0.5 μL、模板RNA 5.0 μL、补ddH2O至50 μL。RT-PCR反应程序为:50 ℃ 30 min;95 ℃ 5 min;95 ℃ 30 s,54 ℃(或53 ℃) 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。10 g/L琼脂糖凝胶电泳结果发现,BVDV-1单项RT-PCR对BVDV-1组、BVDV-1+BVDV-2组均扩增出大小约为279 bp的特异性条带,大小与预期相符,而BVDV-2组和阴性对照组均无目的条带(图1);BVDV-2单项RT-PCR对BVDV-2组、BVDV-1+BVDV-2组均扩增出与预期大小相符的特异性条带,大小约为180 bp,而BVDV-1组和阴性对照组均无目的条带(图2)。

M.DNA 标准DL 2 000;1.BVDV-1;2.BVDV-2;3.BVDV-1+BVDV-2;4.阴性对照
2.2 双重RT-PCR反应条件的建立及优化
对RT-PCR反应条件进行优化,确定了双重RT-PCR扩增反应最适模板用量为5 μL(模板含量为0.1 μg),引物P1、P2、P3、P4最适用量各为0.5 μL(引物浓度为0.5 mmol/L),最适退火温度为55 ℃。双重RT-PCR反应体系为:2×One step buffer 25 μL、One step Enzyme Mix 0.5 μL、引物P1 0.5 μL、引物P2 0.5 μL、引物P3 0.5 μL、引物P4 0.5 μL、模板RNA 5.0 μL、补ddH2O至50 μL。RT-PCR反应程序为:50 ℃ 30 min;95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。10 g/L琼脂糖凝胶电泳结果发现,BVDV-1组可扩增出大小约为279 bp的特异性条带,BVDV-2组可扩增出大小约为180 bp的特异性条带,BVDV-1+BVDV-2可同时扩增出大小约为279 bp和180 bp的2条特异性条带,大小均与预期相符,而阴性对照组无目的条带(图3)。

M.DNA 标准DL 2 000;1.BVDV-1;2.BVDV-2;3.BVDV-1+BVDV-2;4.阴性对照

M.DNA 标准DL 2 000;1.BVDV-1;2:BVDV-2;3.BVDV-1+BVDV-2;4.阴性对照
2.3 特异性试验结果
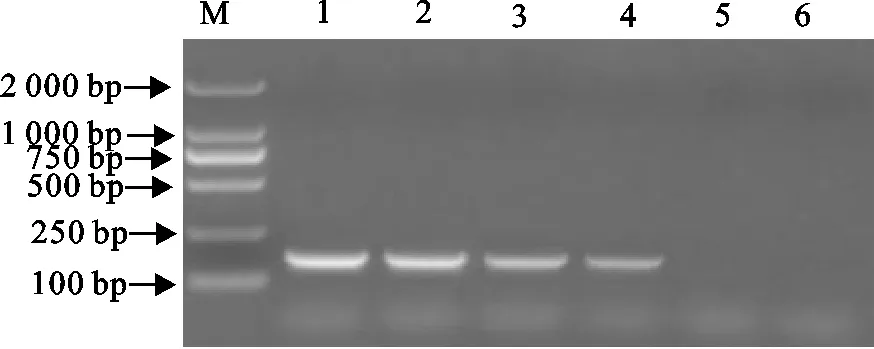
双重RT-PCR方法对BVDV-1、BVDV-2可分别扩增出279 bp、180 bp目的片段,对BVDV-1+BVDV-2可扩增出2条特异性条带,大小分别为279 bp和180 bp,而对IBRV、BRV、BCV、BPIV-3、CSFV均未扩增出任何特异性条带(图4),表明BVDV双重RT-PCR检测方法具有良好的特异性。

M.DNA 标准DL 2 000;1.BVDV-1;2.BVDV-2;3.BVDV-1+BVDV-2;4.IBRV;5.BRV;6.BCV;7.BPIV3;8.CSFV;9.阴性对照
2.4 敏感性试验结果
双重RT-PCR方法对10-3倍稀释的BVDV-1基因组可扩增出279 bp的目的条带(图5),对10-4倍稀释的BVDV-2基因组可扩增出180 bp的目的条带(图6)。经紫外分光光度计测定核酸浓度,并计算拷贝数,结果发现该双重RT-PCR方法对BVDV-1和BVDV-2的最低检测量分别为1×103拷贝/μL和1×102拷贝/μL,表明BVDV双重RT-PCR检测方法具有良好的灵敏度。

M.DNA 标准DL 2 000;1.10-1;2.10-2;3.10-3;4.10-4;5.阴性对照
M.DNA 标准DL 2 000;1.10-1;2.10-2;3.10-3;4.10-4;5.10-5;6.阴性对照
2.5 重复性试验结果
双重RT-PCR方法对BVDV-1、BVDV-2、BVDV-1+BVDV-2、IBRV、BRV、BCV、BPIV-3、CSFV核酸重复检测3次的结果完全一致(表2),表明BVDV双重RT-PCR检测方法具有良好的重复性和稳定性。
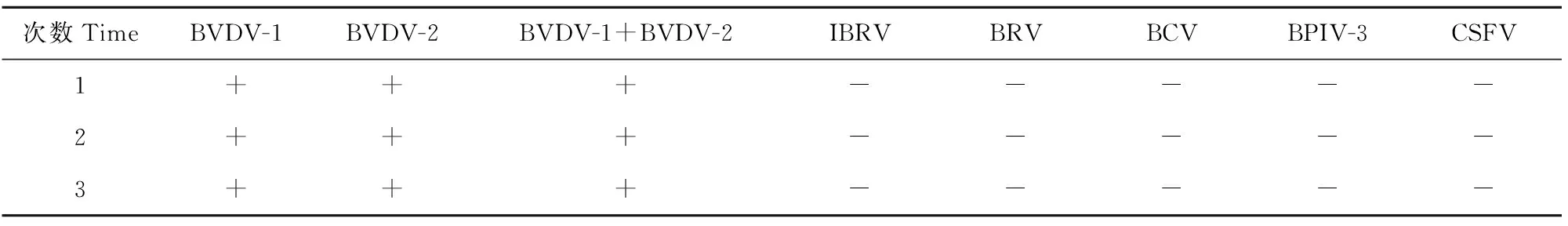
表2 双重RT-PCR重复性试验结果
2.6 临床样品检测
应用BVDV双重RT-PCR检测方法对2017年-2019年采集于四川省达州及周边地区的332份临床粪便样品进行检测,共检测出BVDV-1阳性样品26份,BVDV-2阳性样品3份,BVDV-1+BVDV-2混合感染样品0份,BVDV-1阳性率达7.83%,BVDV-2阳性率达0.90%,差异显著(P<0.05),其中2017年、2018年和2019年的BVDV-1阳性率分别为6.82%、8.49%和7.97%,差异不显著(P>0.05),BVDV-2阳性率分别为0、0.94%和1.44%,差异不显著(P>0.05)(表3)。表明该地区存在一定程度BVDV-1和BVDV-2感染。

表3 临床样品检测结果
3 讨论
近年来,随着我国养殖产业的快速发展,动物及其产品的跨地区调运日益频繁,由此带来的动物疫病传播风险剧增,牛病毒性腹泻作为一种重要的牛传染性疫病,严重威胁养牛业健康发展。因此,实验室监测和分子流行病学调查工作在BVDV防控中发挥重要作用。有学者采用PCR方法先后对我国南疆、天津地区奶牛和吉林地区肉牛,以及川藏部分高原地区牦牛样品进行BVDV病原学分析,发现上述地区主要流行毒株为BVDV-1型[14-17]。对江浙地区奶牛腹泻粪便进行检测,发现该地区同时存在BVDV-1和BVDV-2型感染,并且在江苏地区发现一定程度的BVDV-1+BVDV-2型混合感染[18-19]。BVDV与CSFV同属黄病毒属,具有抗原相似性,可发生血清学交叉反应。有关疫苗生产企业为掌握其2012年-2017年生产的猪瘟疫苗中BVDV污染情况,采用RT-PCR方法对猪瘟疫苗生产所用的原辅材料、半抗原及成品等进行BVDV检测,发现新生牛血清、新生牛睾丸、猪瘟抗原和成品猪瘟疫苗均存在不同程度的BVDV污染。使用BVDV污染的猪瘟疫苗免疫猪群可导致其感染BVDV,并出现类似于非典型猪瘟症状。因此,带有BVDV抗原的血清和牛睾丸严禁用于CSFV培养[20]。有学者发现猪群中存在BVDV感染的迹象,一旦BVDV强毒株在猪群内流行,将会给养猪业的健康发展造成新威胁[21]。
BVDV-1和BVDV-2临床症状极为相似,仅凭外部观察无法对其做出准确的临床诊断。因此,BVDV分型检测方法在实验室诊断中扮演重要角色。PCR方法具有操作简单、成本低廉、灵敏特异等优点,是当前最简单、最常用的分子生物学技术,特别适合于基层兽医实验室进行动物疫病临床诊断和流行病学分析,而双重PCR方法是在同一个反应体系中加入2种病原的特异性引物,根据不同病原扩增片段大小而实现2种病原的鉴别诊断。BVDV为单股RNA病毒,其在PCR扩增前需将病毒基因组反转录为cDNA,而一步法RT-PCR扩增试剂盒将反转录和PCR扩增过程合并,只需一个反应体系即可实现病毒基因组的快速扩增,大大缩短检测时间,增加检测灵敏度,可降低交叉污染的发生率。
本研究根据BVDV-1(AF091605.1、KF501393.1、MK204904.1、MN513404.1和MG923683.1)和BVDV-2 (AF502399.1、MG436782.1、 AF145969.1、KC176777.1和MN513411.1)流行毒株5′-UTR保守序列设计2对特异性引物,以BVDV-1和BVDV-2毒株基因组为模板,摸索、优化反应条件,建立BVDV双重RT-PCR检测方法,对检测方法的特异性、敏感性和重复性进行验证。试验结果表明,建立的BVDV双重RT-PCR方法对BVDV-1和BVDV-2可分别扩增出279 bp和180 bp目的条带,与IBRV、BRV、BCV、BPIV-3和CSFV不发生交叉反应;该双重RT-PCR方法对BVDV-1和BVDV-2的最低检测量分别为1×103拷贝/μL和1×102拷贝/μL;3次重复试验结果完全一致,表明建立的检测方法具有良好的特异性、敏感性和重复性,可用于BVDV的临床诊断和分子流行病学调查。对2017年-2019年采于达州及周边地区的332份临床样品进行检测发现,BVDV阳性率为8.73%,其中2017年-2019年BVDV-1阳性率分别为6.82%、8.49%和7.97%,BVDV-2阳性率分别为0、0.94%和1.44%,3个年度BVDV-1阳性率为7.83%,BVDV-2阳性率为0.90%,并未检出2种病原混合感染的临床样品,该地区BVDV阳性率显著低于文献报道的四川地区和国内其他区域[16-17,22]。这与达州地区多年来对动物疫病防控工作的重视和辛勤付出密切相关,但该地区BVDV流行形势复杂多变,主要流行毒株仍为BVDV-1,但近年来BVDV-2阳性感染时有发生,因此,加强BVDV的监测和防控,特别是BVDV-2的监测应予以高度重视。

