MeCP2与物质相关障碍的研究进展
沈宝玉杨根梦刘鹏亮王 上洪仕君李利华
(昆明医科大学法医学院,昆明 650500)
物质相关障碍(substance-related disorders,SRDs)主要包括:酒精相关障碍(alcohol-related disorders)、苯丙胺相关障碍(amphetamine-related disorders)、可卡因相关障碍(cocaine-related disorders)及阿片相关障碍(opioid-related disorders)等。SRDs作为严重的世界公共卫生问题,给家庭和社会卫生事业带来了巨大负担[1]。甲基化CpG序列结合蛋白2(methyl-CpG-binding protein 2,MeCP2)是一种与甲基化CpG特异性结合的染色体蛋白,在调节基因表达方面发挥重要作用[2],其生物学功能表现为促进神经系统发育、调节神经发生及分化、调节突触及神经回路形成、成熟大脑功能维持等[3]。越来越多的研究表明,MeCP2作为中枢神经系统功能的关键调节因子,在SRDs中发挥重要作用。本文针对MeCP2与多种SRDs的研究进行综述,为SRDs相关研究提供参考。
1 MeCP2与酒精相关障碍
作为酒精消费大国,中国成年人总体饮酒率为30.5%,男性饮酒率高达53.8%,其中约四分之一的饮酒者每日饮酒[4]。此外,过量饮酒引发的酒精相关障碍已经成为迫待解决的世界卫生问题[5]。越来越多的研究表明,MeCP2在酒精相关障碍中扮演着重要角色。
胎儿酒精谱系障碍(fetal alcohol spectrum disorders,FASD)是一组由于孕期母体饮酒导致胎儿生长缺陷的疾病,是一种常见的酒精相关障碍[6]。Kim等[7]研究发现,孕鼠酒精重复摄入可致其后代出现了多动、注意力缺陷及易冲动等行为改变。而在子代前额叶皮质和纹状体中,MeCP2表达下调、多巴胺转运体(dopamine transporter,DAT)及去甲肾上腺素转运体(norepinephrine transporter,NET)表达上调,并与母体酒精摄入呈剂量依赖性。这些结果表明,产前暴露于酒精可诱发鼠类后代行为控制障碍,这可能与MeCP2介导的表观遗传变化和儿茶酚胺神经递质转运系统异常有关[7]。Shukla等[8]研究发现,孕期小鼠酒精摄入可诱导其雄性子代出现社交行为缺陷,而额叶皮质中MeCP2转录下调,白介素6(interleukin-6,IL-6)、白介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等转录上调,并伴随着血清中的IL-6、IL-1β及TNF-α水平上调;但雌性子代并无上述变化。而对于类Toll受体4(toll-like receptor 4,TLR4)缺失的孕鼠而言,酒精摄入不能诱导其雄性子代出现上述变化[8]。这表明TLR4介导的MeCP2和炎症因子转录参与了雄性FASD中社交行为缺陷的形成。此外,孕鼠产前和产后的联合酒精摄入也能下调其子代海马中MeCP2的转录水平[9]。Gangisetty等[10]的研究发现,大鼠孕期摄入酒精可诱导其雄性子代下丘脑内侧叶中MeCP2的表达上调,并伴随着前阿片黑素细胞皮质激素(proopiomelanocortin,POMC)基因的转录下调。而MeCP2表达抑制后,酒精诱导的POMC转录下调也随之恢复。此外,母体酒精摄入也上调了其雄性子代下丘脑中促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)的转录;而下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴应激反应上调了促肾上腺皮质激素(adreno-cortico-tropic-hormone,ACTH)及皮质酮(corticosterone)在血浆中的释放,当MeCP2表达抑制后,上述改变均恢复正常。综上所述,MeCP2在FASD中起着重要的调控作用,其中可能涉及儿茶酚胺转运系统、炎症反应及激素分泌,从而影响个体行为控制及社交行为反应。
MeCP2不仅在FASD中起着关键的调控作用,也在个体大脑发育的不同阶段中,调控着机体对酒精摄入的行为及神经反应。Subbanna等[11]的研究发现,新生小鼠早期的酒精摄入可诱导其大脑皮质和海马中DNA甲基化下调,并伴随着MeCP2的表达下调。而在大麻素1型受体(cannabinoid receptor type-1,CB1R)表达抑制后,酒精诱导的MeCP2表达下调也随之恢复。此外,在CB1R敲除小鼠中,CB1R的缺失也阻断了酒精对MeCP2的下调作用。另一方面,半胱氨酸天冬氨酸蛋白酶(Caspases)的广谱抑制剂Q-VD-Oph亦可逆转酒精对MeCP2的抑制作用。该研究进一步发现,在新生小鼠和成年小鼠中,酒精摄入均能下调其大脑皮质和海马中环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化及活性调节细胞骨架相关蛋白(activity regulated cytoskeleton-associated protein,Arc)的表达,并诱导成年小鼠空间及社交认知缺陷,而Q-VD-Oph均能逆转这些改变[11]。因此,机体发育早期的酒精摄入可通过CB1R及Caspases通路调控MeCP2的表达,在个体上表现为空间及社交认知缺陷。对于成年个体而言,酒精慢性摄入可致成年大鼠内侧前额叶皮质MeCP2的转录及表达上调,而在酒精短期摄入的成年大鼠中,MeCP2的转录及表达没有明显变化[12]。Repunte-Canonigo等[13]的研究发现,在小鼠慢性酒精摄入的戒断期,其内侧前额叶皮质及伏隔核中出现了MeCP2的转录上调;而MeCP2308/y突变小鼠比正常小鼠摄入更少的酒精,并对酒精摄入具有较高的敏感性,酒精撤消后伴随着更为严重的戒断症状;但在等量的酒精摄入后,MeCP2308/y突变小鼠与正常小鼠的血液酒精浓度并无区别。
以上研究表明,MeCP2在酒精相关障碍中发挥着重要的调节作用,而在个体大脑发育的不同阶段及脑区,MeCP2对酒精相关障碍起着差异调节作用。在大脑发育早期,MeCP2可通过调控基因表达、儿茶酚胺转运系统、炎症反应及激素分泌,从而影响个体行为控制、社交行为及空间认知反应;而在成年大脑中,MeCP2主要介导了个体的酒精反应及摄入。
2 MeCP2与苯丙胺相关障碍
苯丙胺(amphetamine,AMPH),也称安非他明,苯丙胺类毒品是AMPH及其衍生的一系列精神刺激剂(psychostimulants),主要包括甲基苯丙胺(methamphetamine,METH)、2,5-二甲氧-4-甲基苯丙胺(2,5-dimethoxy-4-methylamphetamine)、3,4-亚甲二氧苯丙胺(3,4-methylenedioxyamphetamine)、N-甲基-3,4-亚甲二氧苯丙胺(n-methyl-3,4-methylenedioxyamphetamine)等。以往的20多年间,苯丙胺相关障碍逐渐成为了严重的公共卫生问题,针对苯丙胺类毒品问题急需系统的研究、预防和治疗方案[14]。大量研究表明,MeCP2在苯丙胺相关障碍形成中起着重要作用,但MeCP2调控苯丙胺相关障碍的具体机制尚存争议。
Deng等[15]的研究发现,小鼠伏隔核中MeCP2的表达抑制或MeCP2基因的整体缺失均可增加AMPH诱导的条件位置偏爱(conditioned place preference,CPP)效应和行为敏化(behavioral sensitization)。此外,MeCP2对于小鼠伏隔核中γ-氨基丁酸(gamma-aminobutyric acid,GABA)能突触的形成是很重要的,这些突触可能会影响小鼠对精神刺激剂的行为反应,而MeCP2缺失减弱了AMPH诱导的神经突触可塑性和即刻早期基因(immediate early genes,IEGs)表达[15]。同时,急性AMPH摄入可显著诱导小鼠伏隔核MeCP2 Ser421位点磷酸化,该诱导作用是通过多巴胺D1受体(dopamine receptor D1,DRD1)信号通路介导的[15]。Deng等[16]进一步研究发现,缺乏MeCP2 Ser421位点磷酸化的小鼠对急性AMPH摄入有正常的行为反应;而在AMPH重复摄入情况下,该种小鼠对AMPH诱导的行为反应有较低的阈值,并伴随着中间多棘神经元的兴奋性降低及伏隔核GABA能神经元中IEGs的表达下调。综上研究结果,在个体脑发育过程中,MeCP2的激活可促进抑制性神经元的突触形成,进而在AMPH诱导的奖赏行为中发挥抑制作用;而成熟个体中MeCP2表达的局部改变可能作为一种自我平衡的补偿机制来限制AMPH的奖赏特性。
与上述研究不同,在METH自我给药的大鼠模型中,METH显著诱导了大鼠行为敏化及其伏隔核中MeCP2的表达,而通过慢病毒转染降低成年大鼠伏隔核中MeCP2的表达可抑制大鼠对METH的行为反应[17]。此外,Wu等[18]的研究发现,METH重复摄入可显著诱导小鼠行为敏化,并伴随着小鼠内侧前额叶皮质、伏隔核中MeCP2的表达上调。Jiang等[19]的研究发现,METH急性摄入后可显著降低大鼠黑质中MeCP2与编码α-突触核蛋白(αsynuclein)的Snca基因结合。此外,METH重复摄入亦可下调小鼠海马中MeCP2的表达,并诱导突触素(synaptophysin,Syn)启动子区低甲基化、突触缩短及空间记忆增强;而在前额叶皮质中,METH诱导了MeCP2高表达、Syn启动子区高甲基化、突触密度增高及认知记忆削弱[20]。
综上所述,MeCP2对神经突触可塑性具有重要的调控作用,在苯丙胺类相关的奖赏行为、空间记忆及认知记忆方面扮演着重要角色;而对于AMPH和METH研究中MeCP2的差异调节作用目前还没有合理的解释,是否因AMPH和METH在结构上的不同引起了这种差异调节作用,还需更多研究。其中MeCP2对大脑发育过程中的差异调控可能部分解释了这种差异调节作用。
3 MeCP2与可卡因相关障碍
可卡因(cocaine)是一种从古柯树和叶子中提取的生物碱,名为古柯碱,具有强效的中枢兴奋作用和药物依赖性。过去的十多年间,可卡因相关障碍日益严重,给公共卫生事业带来了严重的负担[21]。以往的研究表明,MeCP2在可卡因相关障碍中发挥着重要的调控作用。
Im等[22]的研究表明,可卡因长期摄入可上调大鼠纹状体中MeCP2的表达,并伴随着前额叶皮质的表达下调。此外,在可卡因长期摄入的大鼠中,纹状体MeCP2的表达抑制可限制大鼠可卡因摄入,该限制作用可能是通过上调microRNA-212(miR-212)的表达,并进一步激活CREB信号通路而发挥作用的;而在可卡因短期摄入的大鼠中,MeCP2表达抑制对大鼠可卡因摄入并无明显影响。另一方面,在可卡因摄入的大鼠纹状体中,miR-212过表达抑制了MeCP2的表达上调;而在可卡因长期摄入的大鼠中,该抑制作用更加显著[22]。该研究进一步发现,可卡因长期摄入可上调大鼠纹状体中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达,而纹状体中MeCP2表达抑制或miR-212过表达均能显著抑制BDNF的表达上调。此外,在可卡因长期摄入的大鼠纹状体中,BDNF过表达可促进大鼠可卡因摄入,而BDNF表达抑制可削弱大鼠可卡因摄入[22]。上述研究结果表明,在大鼠纹状体中存在着MeCP2与miR-212相互抑制的稳态作用,该稳态作用调节着BDNF对大鼠可卡因摄入的调控作用,其中可能涉及CREB信号通路。
最近的研究表明,在可卡因相关性障碍中,MeCP2对BDNF的转录调控并不局限于与miR-212的相互抑制作用。在可卡因自我给药的大鼠中,可卡因能诱导海马和伏隔核中MeCP2的表达上调,但在前额叶皮质中并没有显著的上调作用。此外,可卡因可显著上调海马中MeCP2 Ser421位点磷酸化[23]。而可卡因对MeCP2 Ser421位点磷酸化的诱导作用在以往的研究中,已被深入探讨。Mao等[24]的研究发现,可卡因摄入可在大鼠纹状体和伏隔核中诱导MeCP2 Ser421位点磷酸化,该诱导作用在伏隔核中出现较早且持久,而纹状体中pMeCP2的诱导需要NMDA谷氨酸受体(n-methyl-d-aspartate glutamate receptor)的参与。此外,可卡因摄入可诱导小鼠伏隔核中MeCP2 Ser421位点磷酸化[15],而缺乏MeCP2 Ser421位点磷酸化的小鼠中对可卡因摄入具有较高的行为敏化反应,并伴随着伏隔核中CREB的表达下调[16]。
大量的研究表明,MeCP2在可卡因相关障碍中的调控作用可能涉及更多的转录调控机制。Deschatrettes等[25]的研究发现,在大鼠前额叶皮质中定位注射高剂量环磷酸鸟苷(cyclic GMP,cGMP)类似物Br-cG可显著降低大鼠可卡因摄入,并伴随着前额叶皮质、伏隔核及纹状体中MeCP2的表达下调。Anier等[26]的研究发现,可卡因可诱导蛋白磷酸酶-1催化亚基(protein phosphatase-Ⅰcatalytic subunit,PPⅠc)启动子高甲基化和MeCP2的结合增加,并伴随着PPⅠc的表达抑制;而IEGs中fosB启动子低甲基化和MeCP2的结合减少,并伴随着fosB的表达上调。此外,可卡因可诱导MeCP2308/y突变小鼠行为敏化和IEGs中Fos、Junb及Arc基因的转录;相对野生型小鼠而言,MeCP2308/y突变小鼠对可卡因摄入具有较高的行为敏化,并伴随着Junb和Arc基因的转录上调[27]。
综上研究结果,MeCP2在可卡因相关障碍形成中扮演重要角色,其中主要涉及MeCP2对BDNF、PPⅠc及IEGs等基因的表达调节作用,而该调节作用可能由miR-212和cGMP等介导,最终反映为MeCP2对可卡因奖赏行为的调控作用。
4 MeCP2与阿片相关障碍
阿片(opium),也称鸦片,是罂粟壳及其未成熟种子的风干渗出液。其中包含许多生物碱,但只有吗啡、可待因和罂粟碱等具有临床意义。而阿片相关障碍是阿片类药物摄入后产生的严重副作用,也限制了阿片类药物在临床上的应用[28]。大量研究表明,MeCP2也参与了阿片相关障碍的形成。
以往的研究表明,MeCP2在阿片相关障碍的行为学改变中起着重要的调控作用,其中主要涉及MeCP2的转录调控作用。Zhang等[29]的研究发现,吗啡摄入可诱导小鼠CPP效应形成,而吗啡诱导的CPP效应随吗啡摄入剂量的增加而上调。此外,杏仁中央核(central nucleus of the amygdala,CeA)中MeCP2和BDNF表达上调、转录抑制组蛋白二甲基转移酶(transcriptionalrepressorhistone dimethyltransferase)G9a表达下调,而MeCP2与G9a基因启动子结合增加、G9a在BDNF基因启动子上的结合减少。当小鼠杏仁中央核中MeCP2表达抑制后,BDNF表达下调、G9a表达上调,而MeCP2与G9a基因启动子结合减少、G9a在BDNF基因启动子上的结合增加,吗啡诱导的CPP效应也随之削弱。Moulaei等[30]研究雌性大鼠吗啡慢性摄入对子代空间记忆能力的影响,发现其第一代和第二代子代中,雄性大鼠空间记忆能力明显下降,并伴随着海马中MeCP2的表达上调;而雌性子代的空间记忆能力及MeCP2表达无明显变化。
最近的研究表明,MeCP2对阿片相关障碍的调控作用可能也涉及了microRNA的参与。海洛因慢性摄入可下调大鼠伏隔核中miR-218水平,而miR-218可直接靶定于MeCP2[31]。此外,大鼠伏隔核中miR-218过表达可限制大鼠的海洛因寻求行为;而在MeCP2308/y突变小鼠中,大鼠的海洛因寻求行为也被显著削弱[31]。Jimenez-Gonzalez等[32]的研究发现,吗啡可诱导斑马鱼胚胎中miR-212下调及miR-132上调,而μ阿片受体(opioid receptors mu,OPRM)拮抗剂纳洛酮可显著逆转吗啡的诱导作用。此外,该研究通过荧光素酶测定(luciferase assay)发现斑马鱼中miR-212/132与MeCP2的直接结合,而该结合作用调控着BDNF及其受体酪氨酸激酶受体B(tyrosine receptor kinase B,TrkB)的表达。
综上研究表明,MeCP2通过G9a和microRNA调控着BDNF及TrkB的表达,而在个体上表现为对CPP效应、空间记忆和药物寻求的调控作用。
5 MeCP2与SRDs的行为反应
SRDs是一系列躯体及精神障碍,对于动物而言,表现为行为控制下降、社交行为缺陷、空间障碍及认知障碍,还包括CPP效应、行为敏化、药物寻求等奖赏行为。在SRDs的一系列行为反应过程中,MeCP2起着重要的调控作用。目前的研究发现,MeCP2可调控POMC、IEGs、Snca、PPⅠc、BDNF及TrkB等基因的表达,其中涉及了CB1R、Caspase、CREB、DRD1等通路及microRNA和DNA甲基化的参与,进而引起激素分泌、炎症反应及神经突触可塑性方面的改变,最终调控SRDs的行为反应。
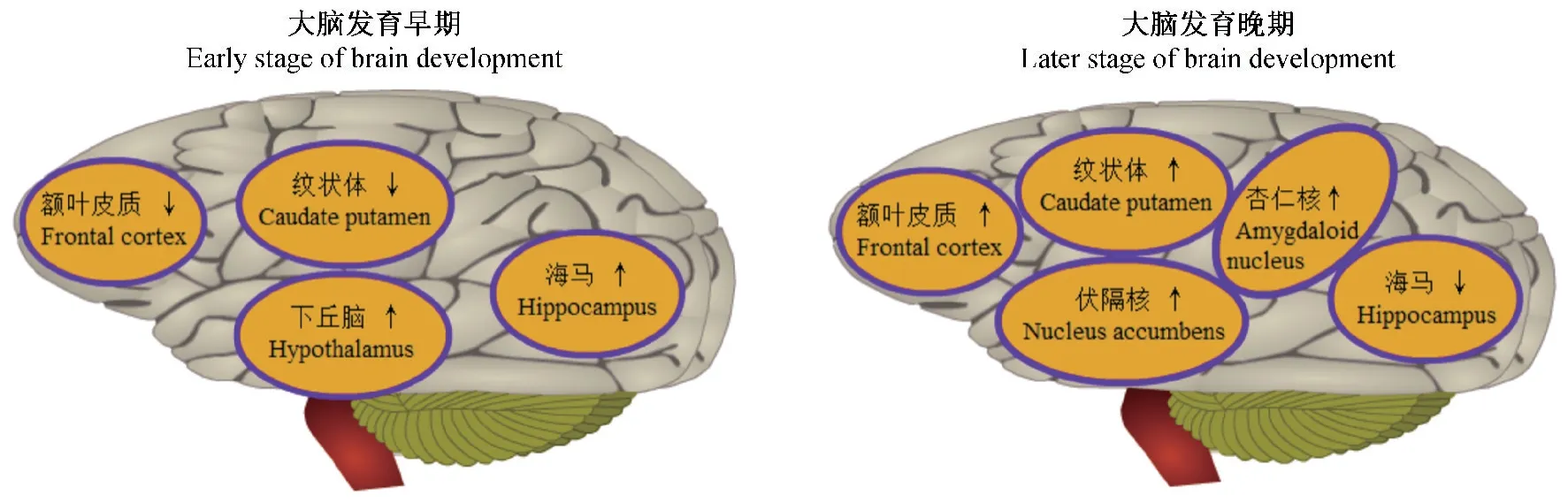
注:在大脑发育的不同阶段,酒精及精神刺激剂调节几个脑区中MeCP2的表达。图1 MeCP2在SRDs中的表达情况Note.At different stages of brain development,alcohol and psychostimulants regulate the expression of MeCP2 in several brain regions.Figure 1 Expression of MeCP2 in SRDs
6 小结与展望
以往的研究表明,在大脑发育的不同阶段,酒精及精神刺激剂均能诱导不同脑区中MeCP2的差异表达(图1),而MeCP2在时段和部位的差异表达是其对SRDs调控的基础。MeCP2对SRDs的调控机制主要涉及基因表达调控(包括POMC、IEGs、Snca、PPⅠc、BDNF及TrkB等基因),从而引起生物学功能改变(包括激素分泌、炎症反应及神经突触可塑性等),最终反应为MeCP2对行为学的影响(包括奖赏行为、社交行为、认知行为及空间记忆等)(图2)。综合来看,MeCP2对SRDs的调控作用可能是多效应稳态的结果,调控机制较为复杂,目前的研究尚不充分,还需更深入的研究。今后的研究可综合基因表达、生物学功能和行为学三个层面,并结合体内、体外实验全面地探讨MeCP2对SRDs的调控机制;而研究MeCP2在SRDs中的调控机制对于酒精、毒品及其戒断干预研究具有重要的理论价值和现实意义,这也是SRDs研究的新视角和方向。

图2 MeCP2在SRDs中的调控网络Figure 2 Regulatory network of MeCP2 in SRDs

