新型相同钠离子混合熔盐相图预测及物性测量
何 聪,鹿院卫,宋文兵,陈晓彤,吴玉庭,樊占胜
(北京工业大学传热强化与过程节能教育部重点实验室暨传热与能源利用北京重点实验室,北京 100124)
聚光式太阳能热发电技术与热能储存技术的结合,可以利用丰富但间歇性的太阳能来提供可调度和低成本的电力[1]。熔盐由于其低成本、高热稳定性和低蒸气压等优势,在太阳能热电站中已有多年成功商业化运行的经验,因此被列为第三代太阳能热发电技术的首选储热工质。为了降低热发电站的度电成本,第三代太阳能热发电系统需要开发出具有更高使用温度(>565℃)的新型熔盐储热材料。常见熔盐热物性如表1所示,目前已经商业化运行的聚光式太阳能热发电技术以太阳盐(Solar Salt,NaNO3-KNO3)作为传热蓄热工质(最高使用温度为565℃),不能满足第三代热发电所需介质温度的要求,基于此本文开展了关于开发新型高温熔盐储热材料的研究。

表1 常见熔盐热物性表[2]Table 1 Thermophysical properties of common molten salts[2]
硝酸盐作为使用最广泛的熔盐,具有熔点低、热容量大、成本低的特点。目前在太阳能热电站中已商业化运用的介质是太阳盐(NaNO3/KNO3,60/40,质量分数,余同),熔点为240℃,可在约56℃的温度下稳定使用[3-4]。另一种传热流体是Hitec盐(KNO3/NaNO3/NaNO2,53/7/40),Hitec盐的熔点为142℃,Hitec盐的主要优点是其熔点(142℃)远低于太阳盐(220℃)[5]。Peng等[6]研究了Hitec盐随温度的热稳定性。结果表明在500℃下30 h后熔盐质量损失仅为1.48%,但在550℃下显著增加至19.12%。这两种硝酸盐混合物的热物理性质包括熔点、密度、比热容等已被广泛研究,但局限性在于使用上限温度较低,在高于600℃的温度下变得不稳定,需要进一步拓展最高使用温度。LiNO3-NaNO3-KNO3三元体系熔盐的熔点为120℃,Wang等[7]在氩气气氛中测量了LiNO3-NaNO3-KNO3三元共晶盐的热稳定性,在500℃的长期稳定性测试中失重率约为8.6%。Divakar等[8]基于热力学原理预测并制备了新型低熔点高蓄热密度的四元熔盐混合物,预测LiNO3-NaNO3-KNO3-NaNO2体系的共晶温度为98.61℃,这些研究通过添加锂盐进一步降低了硝酸盐体系的熔点,但由于锂盐的添加导致成本太高。
氯化盐(NaCl、KCl等)和碳酸盐(Na2CO3、K2CO3等)由于其热稳定性高、成本低,被列为下一代热发电技术中很有前景的储热材料[2]。Sergeev等[9]对复杂四元体系NaCl-KCl-NaNO3-KNO3的最低液相线进行了预测,优化得到最低共熔点为276℃,为多元体系熔盐的研究提供了参考。Jiang等[10]借助FactSage软件确定共晶二元盐Na2CO3-NaCl的组成,并使用同步热分析仪和X射线衍射研究其热物理性质,结果表明共晶盐的熔点为637.0℃,共晶熔盐在低于700℃的CO2环境中具有良好的热稳定性。Li2CO3-Na2CO3-K2CO3(LiNaK-CO3)的混合物是针对该应用而探索的应用最广的碳酸盐混合物,Wu等[11]研发了LiNaK-CO3的混合物以替代太阳盐提高太阳能热发电效率,将碳酸盐体系的熔点成功降低至400℃,使用上限温度在600~800℃之间,但锂盐含量过高,导致制造成本偏高。
综合上述研究,传统的硝酸盐体系存在使用上限温度较低的局限性,氯盐和碳酸盐体系熔点较高导致系统有冻堵的风险,并且在高温下氯化盐对金属材料具有较高的腐蚀性,因此需要开发出新型适用于中高温的熔盐体系。目前的研究关于相同阳离子体系(即由两种或多种相同阳离子、不同阴离子的盐组成的多元熔盐体系)的研究还较少,因此本文选取相同钠离子的NaNO3、NaCl、Na2CO3为基盐配置三元混合熔盐。为了从理论上指导混合熔盐的配制,减少实验的工作量和盲目性,通过FactSage软件对三元体系NaNO3-NaCl-Na2CO3的最低共熔点进行预测和实验研究,拟开发出具有高潜热、较高热稳定性、低成本的中高温储热蓄热工质。
1 相图计算基本原理和方法
相图计算方法即基于热力学理论和所获得的热力学数据库进行计算,基本原理是通过获取各低组元(如二元系)间的热力学相平衡数据,确定低组元中各项的热力学参数,然后通过建立模型并外推、优化参数等逐步获得高组元混合物的吉布斯自由能,最终计算得出多组元混合物相图。
1.1 热力学基本原理
相图计算的基本原理通常采用的是能量最小化原则。即在给定的封闭环境中,当整个体系达到热力学平衡时,整体总能量应取极小值。确定体系平衡态的方面主要有两类,即吉布斯自由能最小法和等化学势法两种方法[12]。
(1)吉布斯自由能最小法
当整个体系处于恒温恒压下时达到平衡的一般条件是体系的总自由能达到最小值Gmin,即

吉布斯自由能最小法即通过对整个体系总吉布斯自由能求最小值,得到平衡态时整个体系中各组分的具体组成以及温度。
(2)等化学势法
当整个体系处于热力学平衡状态时,任一组元i在各相中的化学势相等,即
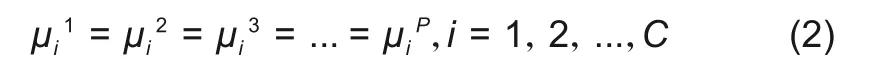
式中,P为体系的总相数;i表示其中某一组分;C表示体系含有的组元数。也可以采用某一组分的偏摩尔吉布斯自由能表示为
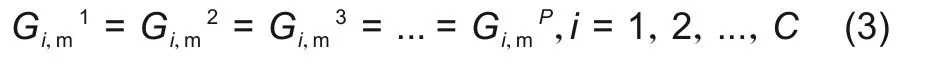
1.2 纯物质数据库
NaNO3、NaCl、Na2CO3纯组元的热力学性质如表2所示,数据来源于FactSage数据库。
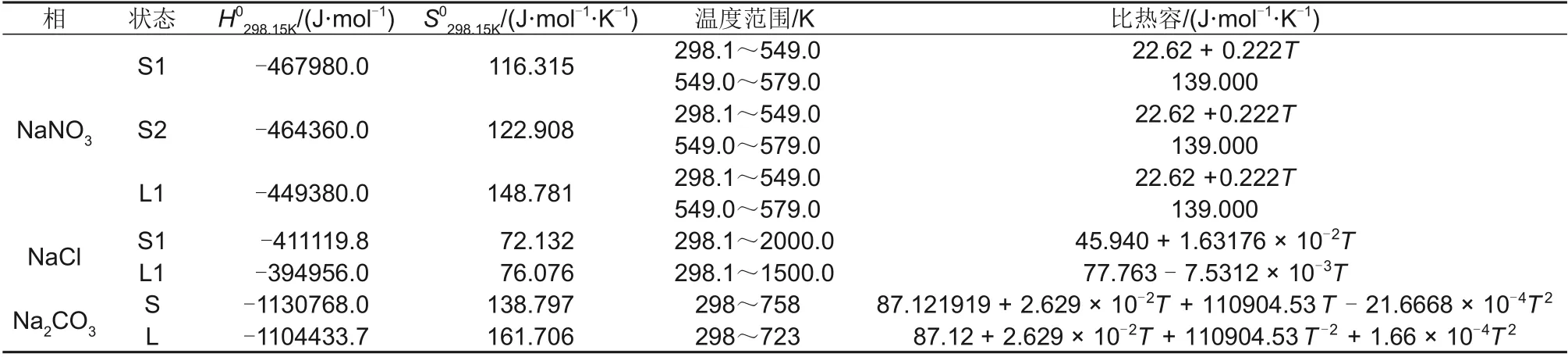
表2 纯组元热力学性质表Table 2 Thermodynamic properties of pure components
2 实验部分
2.1 实验材料及设备
本文主要实验原料为硝酸钠、碳酸钠、氯化钠,均为分析纯。实验所使用的主要仪器和设备有电子天平(瑞士梅特勒公司)、同步热分析仪(德国耐驰,STA-449F3)、差示扫描量热仪(瑞士梅特勒公司,DSC-3)。
2.2 实验方案
(1)理论计算:利用FactSage软件开展NaNO3-NaCl-Na2CO3三元体系相图热力学计算,得到三元体系最低共熔点和共熔点下的配比组成;
(2)实验制备:实验配制样品所采用的试剂均为分析纯级别,按照摩尔比例配制,在预测最低共熔点附近多组取点,通过静态熔融法制备混合熔盐样品,按照上述样品制备方法对不同比例进行制备。
(3)熔点及比热容的测量。使用差示扫描量热仪进行熔点和比热容的测量,称量5~10 mg熔盐,置于铝坩埚内,升温程序设定为25~550℃,速率为10 K/min,通氮气作为保护气体,气流速率为50 mL/min,在惰性环境下进行实验。对测试得到的DSC和比热容曲线逐一进行分析,得到不同配比下熔盐的熔点和比热容。
(4)分解温度的测量:使用同步热分析仪测试所配制熔盐的TG曲线,在氧化铝坩埚内放入约10 mg熔盐,采用高纯氮气作保护气,流量为50 mL/min,升温速率为10 K/min。
3 结果与讨论
3.1 NaNO3-NaCl-Na2CO3相图模拟及预测
基于相图计算原理,根据FactSage熔盐数据库中获取的纯组元热力学和各二元系的混合吉布斯自由能等数据,初步预测得到了三元体系NaNO3-NaCl-Na2CO3的相图如图1所示。

图1 NaNO3-NaCl-Na2CO3体系相图Fig.1 phase diagram of NaNO3-NaCl-Na2CO3System
基于纯物质和低组元的热力学参数预测得到三元体系相图,根据计算结果显示的共晶温度为564.2 K(291.2℃),共晶组成NaNO3:NaCl:Na2CO3物质的量比例为0.92:0.064:0.016,该预测结果为三元系共晶盐的配制提供了理论依据。
3.2 最低共熔点和潜热
预测获得的NaNO3-NaCl-Na2CO3三元系的最低共熔点需要通过实验来验证相图预测结果的可靠性。为寻找三元系的最低共熔点,在预测的最低共熔点附近选取多组配比制备熔盐,利用差示扫描量热仪测量三元共晶盐的熔点及潜热,筛选出熔点最低且共晶良好的4组共晶盐配比如表3所示。
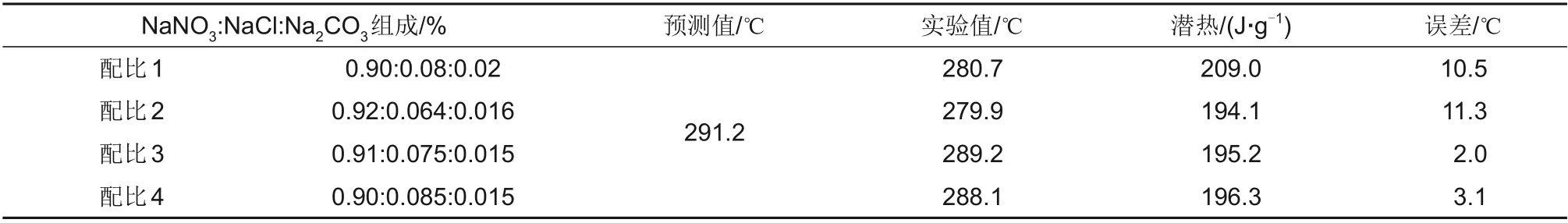
表3 共熔点预测值与实验值Table 3 The predicted and experimental values of eutectic point
对差示扫描量热仪测得的不同配比下的DSC曲线进行数据分析,可以得到各配比下共晶盐熔融峰的起始熔化温度、峰值熔化温度、终止熔化温度和相变潜热等,在多组共晶盐中优选出最低共熔点为配比2。如图2所示为NaNO3-NaCl-Na2CO3三元系最低共熔点配比2的DSC测量曲线。
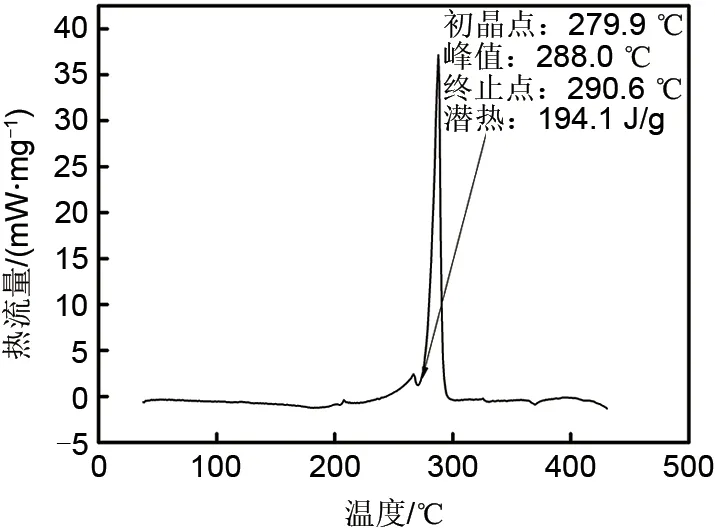
图2 NaNO3-NaCl-Na2CO3最低共熔点DSC测量曲线Fig.2 DSC measurement curve at minimum eutectic point of NaNO3-NaCl-Na2CO3
由DSC测量曲线可知,该配比下在整个测试温度段只产生了一个较大的吸热峰曲线,证明该熔盐样品中的各组分实现良好的共晶,混合物只有一个共熔温度且能够在较小的温度范围内完全熔化,各组元间共晶良好,因此峰值较大。分析结果显示,该样品的熔化起始点温度为279.9℃,熔融峰值点为288.0℃,终止点温度为290.6℃,潜热较大为194.1 J/g。与相图预测结果(291℃)基本一致,吻合较好验证了相图计算的准确性。
由DSC实验数据可知,该配比下的熔盐共晶良好、熔点较低、潜热较大,适合应用在传热和储热系统中,在制备复合材料潜热储热方面也有很大潜力。
3.3 最低共熔点配比下共晶盐的分解温度
采用同步热分析仪对最低共熔点配比下共晶盐的分解温度进行测量,多次测量得到最低共熔点配比2的分解温度结果如图3所示。
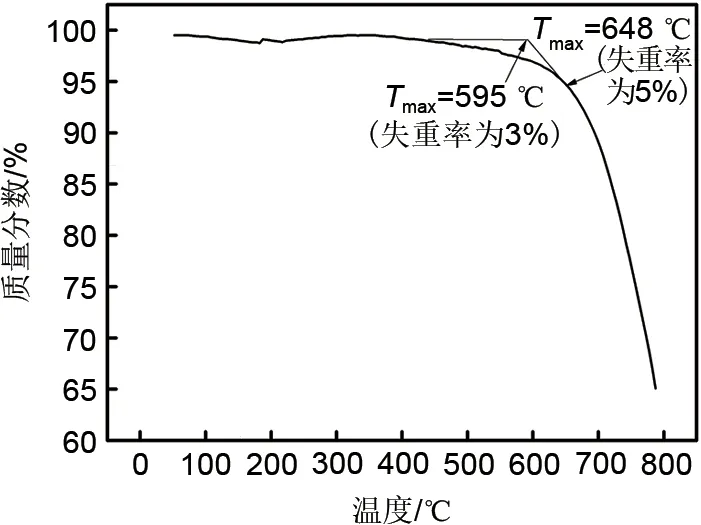
图3 NaNO3-NaCl-Na2CO3最低共熔点热重曲线Fig.3 Thermogravimetric curve at the lowest eutectic point of NaNO3-NaCl-Na2CO3
由图3热重曲线可以看出从室温开始至600℃,由于少部分失水和信号波动,热重曲线有轻微的变化,质量损失在3%时,对应的分解温度为595℃。该配比在648℃(失重率为5%)之后质量迅速变化,产生分解气体,损失质量超过5%开始大量分解。
3.4 最低共熔点配比下共晶盐的比热容
采用差示扫描量热仪对共晶盐在相同温度程序下进行多次测量取平均值,运用分析软件得到最低共熔点配比2的比热容曲线如图4所示。
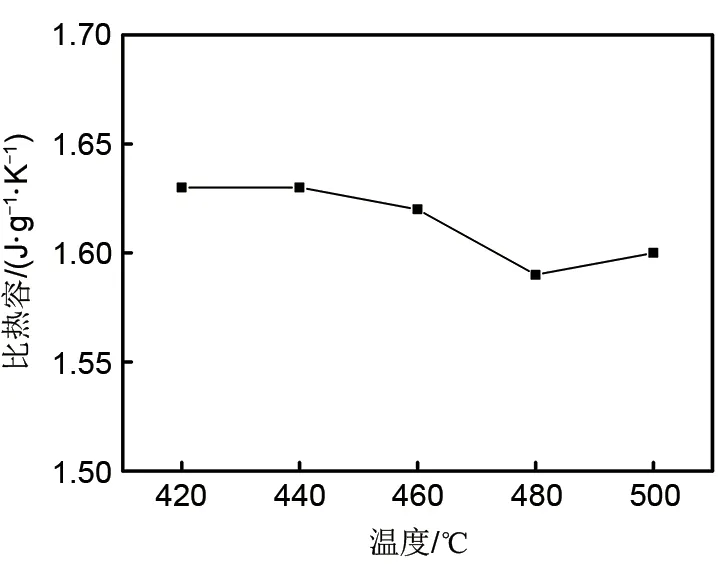
图4 NaNO3-NaCl-Na2CO3最低共熔点比热容图Fig.4 Specific heat at the lowest eutectic point of NaNO3-NaCl-Na2CO3
由液态比热容曲线可知,NaNO3-NaCl-Na2CO3三元系最低共熔点处的比热容在420~480℃时,比热容随温度的升高而呈现减小的趋势,480℃之后随温度的升高比热容增大。根据多组比热容曲线取平均值,测得的最低共熔点处的平均比热容为1.62 J/(g·K),相对于其他文献中已测的多元硝酸盐体系的比热容有不同程度的提高,本文比热容测量值与其他硝酸盐体系比热容测量值的对比如表4所示。
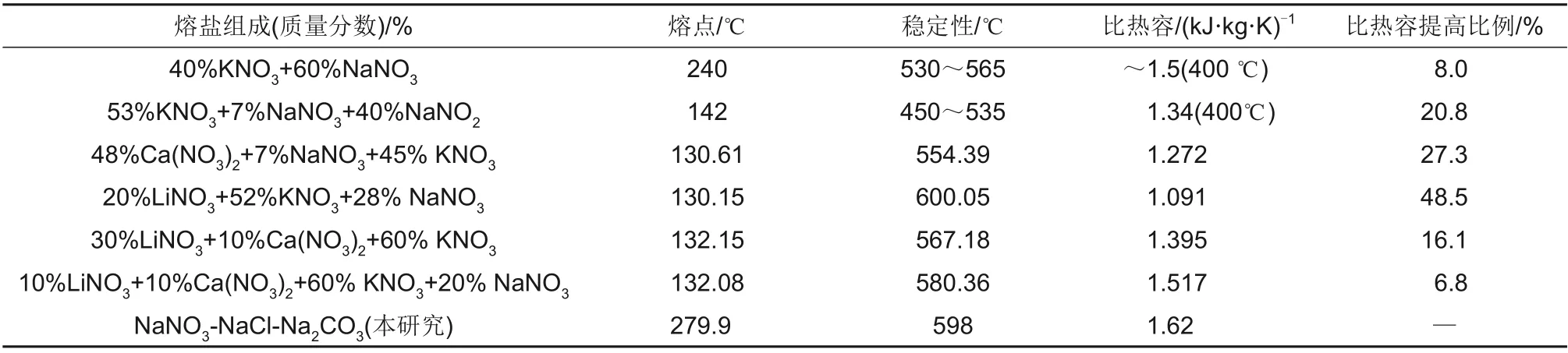
表4 与其他硝酸盐体系比热容对比[13-16]Table 4 Comparison of specific heat with other nitrate systems
常用的Solar Salt的平均比热容为1.50 J/(g·K),NaNO3-NaCl-Na2CO3三元系最低共熔点处测得的平均比热容值相比Solar Salt增加了0.12 J/(g·K),与Hitec相比增加了0.28 J/(g·K),相对于表4中比热最高的四元硝酸盐体系(10%LiNO3-10%Ca(NO3)2-60%KNO3-20%NaNO3)比热容值提高了6.78%,由比热容数据分析可知,NaNO3-NaCl-Na2CO3最低共熔点配比下的共晶盐相比其他的硝酸盐具有较高的比热容。
4 结 论
本文基于相同阳离子的原则,通过相图理论和FactSage软件开展对三元体系NaNO3-NaCl-Na2CO3的最低共熔点的预测和研究,并对该最低共熔点配比进行DSC测试、TG测试和比热容测试,主要结论如下。
(1)借助相图原理指导混合熔盐的配制,通过FactSage软件对NaNO3-NaCl-Na2CO3三元体系进行相图热力学计算得到相图,计算得最低共熔点预测值为291℃,三元体系NaNO3:NaCl:Na2CO3最低共熔点的物质的量比例为0.92:0.064:0.016,预测值为实验提供了理论依据。
(2)通过DSC测试显示最低共熔点配比下共晶盐的熔化起始点温度为279.9℃,熔融峰值点为288.0℃,终止点温度为290.6℃,潜热较大为194.1 J/g。与相图预测结果(291℃)基本一致,吻合较好验证了相图计算的准确性。
(3)对筛选出的最低共熔点配比下共晶盐的其他热物性进行测量,体系分解温度为595℃(质量损失率为3%),648℃之后开始大量分解。该配比下比热容为1.60 J/(g·K)(500℃),平均液态比热容为1.62 J/(g·K),测得的比热容值与Solar Salt[平均比热容为1.50 J/(g·K)]相比增加了0.12 J/(g·K),与Hitec[平均比热容为1.34 J/(g·K)]相比增加了0.28 J/(g·K)。

