几种影响矮种椰子成熟胚愈伤组织诱导的因素研究
李志瑛 穆治华 肖勇 范海阔
摘 要:本文對几个影响矮种椰子成熟胚的愈伤组织诱导及褐化程度的因素进行研究。以海南优良矮种椰子‘文椰2号和‘文椰4号11月龄的成熟胚为材料,研究不同的基因型、凝固剂、激素浓度和接种方式对愈伤组织的诱导率和外植体褐化程度的影响。结果显示:以‘文椰2号成熟胚为材料,愈伤率最高个体为H1;接种至PhytagelTM-P8169凝固剂的愈伤率最高,为71.43%;接种至Gelrite-G1910凝固剂的褐化率最低,为40.00%;接种至添加110 μmol/L 2,4-D的培养基的愈伤率最高,为63%,褐化率最低,为46.67%;剥取胚芽接种的愈伤率最高,为48.72%,其褐化率与完整胚接种的无显著性差异。以‘文椰4号成熟胚为材料,愈伤率最高个体为X1;接种至Agar-A8190凝固剂的愈伤率和褐化率最高,分别为46.15%和30.77%;接种至Gelrite-G1910凝固剂的褐化率最低,为16.67%;接种至添加600 μmol/L 2,4-D的培养基愈伤率最高,为40.00%,但与110 μmol/L 2,4-D无显著性差异;接种至110 μmol/L 2,4-D的褐化率最低,为50.00%;纵切接种获得愈伤率最高,为40.00%;完整胚接种褐化率最低,为33.33%。结果表明:基因型、凝固剂、激素浓度和外植体接种方式对愈伤组织的诱导率均有显著影响。‘文椰2号愈伤组织诱导的最佳2,4-D浓度为110 μmol/L,最佳凝固剂为PhytagelTM-P8169,最佳接种方法为剥取胚芽接种。‘文椰4号愈伤组织诱导的最佳2,4-D浓度为110 μmol/L,最佳凝固剂为Agar-A8190,最佳接种方法为胚纵切接种。
关键词:椰子;愈伤组织;组织培养
Abstract: Tissue culture technique is an efficient way to speed-up coconut multiplication. In this study, the factors limiting callus induction efficiency and the method to control browning rate were studied. Improvement of callus induction efficiency of coconut and the theoretical basis for an optimized condition of induction were presented. The 11-month-old mature embryos of ‘Wenye 2 and ‘Wenye 4, two elite dwarf coconut cultivars, were used as the explant materials. Experiments was conducted to evaluate the influence of genotype, optimum hormone concentration, gelling agent and inoculation method on callus induction and explant browning. When using the embryos from ‘Wenye 2 as the explant, a higher callus induction rate (83.33%) was from H1. The highest number of calluses were observed in the medium with 4 g/L PhytagelTM-P8169 (71.43%) and 110 μmol/L 2,4-D (63.00%) respectively, while rest treatments showed no significant difference. The highest rate of callus induction (48.72%) was observed in the treatment using plumule isolation techniques. As to the browning rate, the lowest were found in the medium containing 3 g/L Gelrite-G1910 (40.00%) and 110 μmol/L 2,4-D (46.67%) and in the plumule isolation treatment (66.67%). When using the embryos from ‘Wenye 4 as the explant, the improved treatments for callus induction of coconut were genetics X1 (66.67%), 6 g/L Agar-A8190 (46.15%), 600 μmol/L 2,4-D (40.00%) and longitudinal cutting (58.33%), but the difference was not significant between 600 μmol/L 2,4-D and 110 μmol/L 2,4-D. As to the browning, the lowest browning rate was showed in the medium containing 3 g/L Gelrite-G1910 (16.67%) and 110 μmol/L 2,4-D (50.00%) and in the induction method of embryo (33.33%). This study explored that genotype of parent plants, the concentration of 2,4-D, gelling agent and condition of induction also had significant effects on the rate of callus induction and ‘Wenye 2 was better as the explant than ‘Wenye 4. For the callus induction of ‘Wenye 2, the suitable hormone concentration, gelling agent and inoculation were 110 μmol/L 2,4-D, PhytagelTM-P8169 and inducing plumule. For ‘Wenye 4, 110 μmol/L 2,4-D, Agar-A8190 and longitudinal embryo cutting techniques were the best for callus induction.
Keywords: coconut; callus; tissue culture
椰子(Cocos nucifera L.)为棕榈科椰子属多年生乔木,是典型的热带木本油料作物和食品作物,也是热带沿海生态林建设和园林绿化的重要植物之一,主要分布在我国海南地区。椰子是海南地理标志性物种,其经济价值高、利用率高,被视为解决热区人民对蛋白质、脂肪能源需要以及增加农民就业机会,帮助农民脱贫致富的重要作物[1]。目前椰子面临着严峻的挑战,如产量不稳定、病虫害胁迫、种苗良莠不齐、树龄老化、自然灾害等问题[2]。而目前椰子市场需求越来越大,现有椰果及椰苗无法满足市场需求[3]。传统椰子育苗采用种果繁殖,繁殖系数低,而椰子的茎干不分枝,导致扦插、嫁接和压条等方法不能应用于椰子无性繁殖。且椰子多为异花授粉,后代性状分离,个体差异大。因此,传统的椰子种苗繁育方式无法持续稳定地提供大量优质种苗[4]。组织培养技术为椰子快繁提供了新的途径。1954年,Cutter等[5]使用椰子水培养椰子胚促使其萌发。此后,随着体胚发生途径技术在其他作物,如烟草、胡萝卜和小麦上的日益成熟,椰子组织培养技术也突飞猛进[6]。1976年,Eeuwens[7]发明椰子专用培养基Y3。1983年,首次利用花药培养获得椰子的胚性愈伤组织[8]。此后,未受精子房、胚芽、成熟胚和未成熟花序等外植体均被用于椰子体胚发生技术研究,且成功获得组培苗[9-11]。其中,椰子胚和胚芽的愈伤诱导效率高于其他外植体。Pérez-Núez[12]经过理论计算得出1个胚芽通过诱导可最终产生98 000个体胚,诱导效率约为体细胞的五万倍。因此,以胚芽为外植体的椰子组培技术将是椰子快繁的有效方法之一。但目前为止,椰子组织培养技术尚未达到有效无性繁殖并商业化推广的目的。本实验通过对椰子成熟胚進行愈伤组织诱导,探讨了基因型、凝固剂种类、激素浓度和接种方法对愈伤组织诱导效果及外植体褐化程度的影响,初步研究成熟胚愈伤组织诱导的条件和方法,以期为椰子组培技术的进一步发展提供一定的参考。
1 材料与方法
1.1 材料
试验椰子品种为矮种椰子新品种‘文椰2号和‘文椰4号,以11月龄椰果的成熟胚为试验材料。椰果取自中国热带农业科学院椰子研究所椰子种质资源圃。
1.2 方法
1.2.1 取样及愈伤组织诱导 选择发育良好、“响水”的11月龄椰果,用刀去除部分果皮后砍开内果皮,倒出椰子水,椰果横向砍开。将胚及其周围的胚乳切割为3 cm×3 cm的小方块后取出编号后带回室内处理。材料至于流水下,使用洗洁精去除表面尘土及污渍。将带有胚的固体胚乳块转移至超净工作台内进行消毒处理。75%酒精浸泡30 s,2.5% NaClO溶液消毒15 min,无菌水冲洗2~3次后剥取胚。取出的胚进行二次消毒。消毒方法为0.5% NaClO溶液浸泡10 min后无菌水冲洗2~3次。消毒完成的胚置于无菌滤纸上晾干表面水分,进行直接接种或处理后接种至相应培养基培养以诱导愈伤组织。培养条件为暗培养,温度27 ℃~28 ℃。
1.2.2 不同基因型对愈伤组织诱导影响 以 ‘文椰2号和‘文椰4号各6棵树的椰果为取胚材料,取胚消毒后,以胚的中轴为准,剖取胚芽后接种至诱导培养基Y3培养基+30 g/L蔗糖+600 μmol/L 2,4-D+2.5 g/L活性炭+3 g/L Gelrite-G1910。
1.2.3 不同凝固剂对愈伤组织诱导影响 将表面干燥的胚置于体式显微镜下观察,以胚中轴为准,剥取胚芽接种至愈伤组织诱导培养基内。以Y3培养基+30 g/L蔗糖+600 μmol/L 2,4-D+2.5 g/L活性炭为基础,分别添加6 g/L Agar-A8190、4 g/L PhytagelTM-P8169和3 g/L Gelrite-G1910作为诱导培养基的凝固剂。
1.2.4 不同激素浓度对愈伤组织诱导影响 以胚为材料,以胚的中轴为准,纵切后剥取胚芽接种至愈伤组织诱导培养基内。以Y3培养基+30 g/L蔗糖+3 g/L Gelrite-G1910+2.5 g/L活性炭为基础,分别添加3 μmol/L(不添加活性炭),110 μmol/L和600 μmol/L的2,4-D作为诱导激素。
1.2.5 不同接种方式对愈伤组织诱导影响 以胚为材料,采用以下3种方式:(1)将灭菌后的整胚吸干表面水分后直接接种;(2)以胚的中轴为准,将胚纵切成两半后切面朝向培养基接种;(3)将胚置于体视显微镜下,以胚的中轴为准,剖取胚芽接种。诱导培养基为Y3培养基+30 g/L蔗糖+600 μmol/L 2,4-D+2.5 g/L活性炭+3 g/L植物凝胶Gelrite-G1910。
1.3 测定内容
接种后90 d观察记录材料生长情况,并统计愈伤组织诱导率、褐化率、组织膨大率和萌发率。
愈伤诱导率=长出愈伤组织的材料数/接种材料数×100%
褐化率=褐化面积>50%的材料数/接种材料数×100%
组织膨大率=出现膨大的材料数/接种材料数× 100%
萌发率=萌发出幼芽的材料数/接种材料数× 100%
1.4 数据分析
愈伤组织诱导率、褐化率、组织膨大率和萌发差异显著性分析采用邓肯氏新复极差检验法,SPSS Statistics 22软件分析。
2 结果与分析
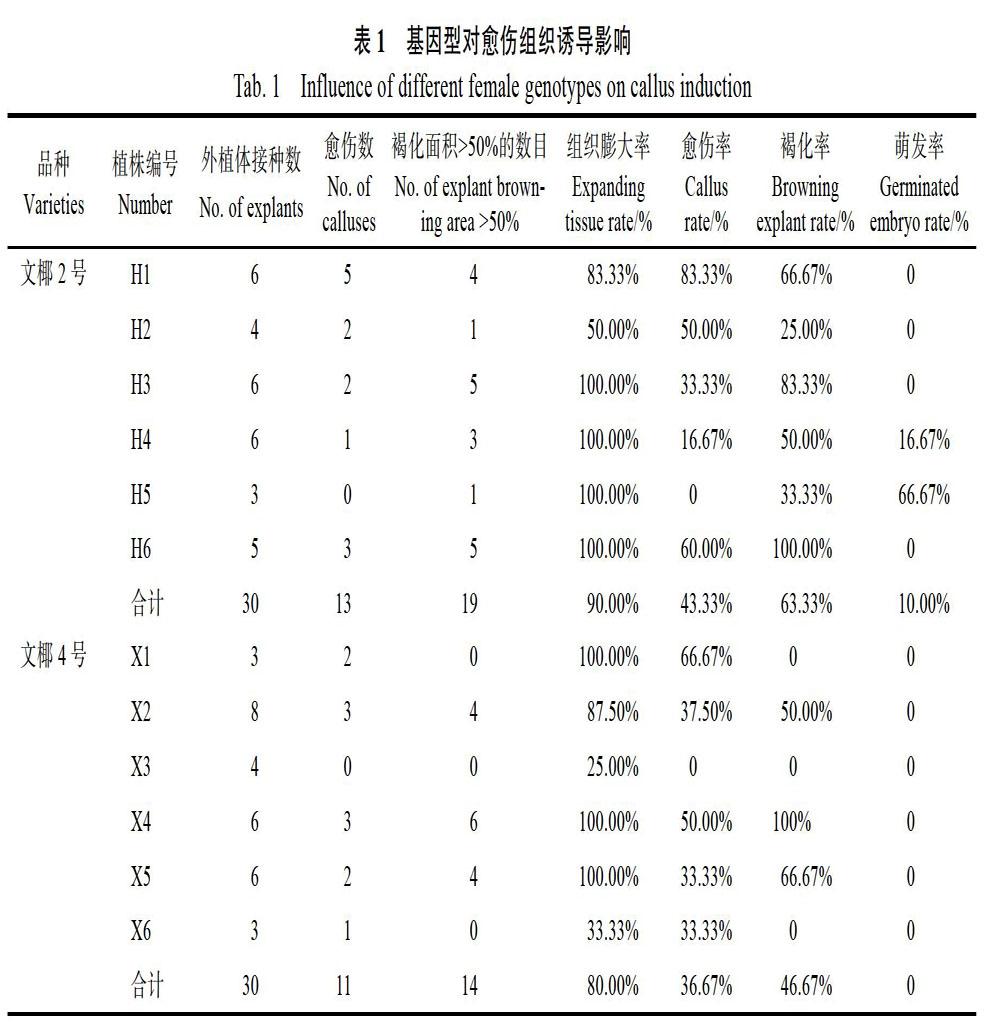
2.1 不同基因型对愈伤组织诱导影响
以取自不同树的成熟胚的胚芽为材料,接种至培养基中,结果如表1所示。‘文椰2号共取胚芽30颗,接种诱导后,组织膨大率为90.00%,愈伤率为43.33%,褐化率为63.33%,萌发率为10.00%。‘文椰4号共取胚芽30颗,接种诱导后,组织膨大率为80.00%,愈伤率为36.67%,褐化率为46.67%,萌发率为0。‘文椰2号6棵树中,H1的愈伤率最高,为83.33%,H2的褐化率最低,为25.00%,H3-H5的组织膨大率最高,均为100.00%,H5萌发率最高,为66.67%。‘文椰4号6棵树中,X1的愈伤率最高,为66.67%,X1、X3和X6的褐化率最低,均为0,X4和X5的组织膨大率最高,均为100.00%。X1-X6的胚芽萌发率均为0。
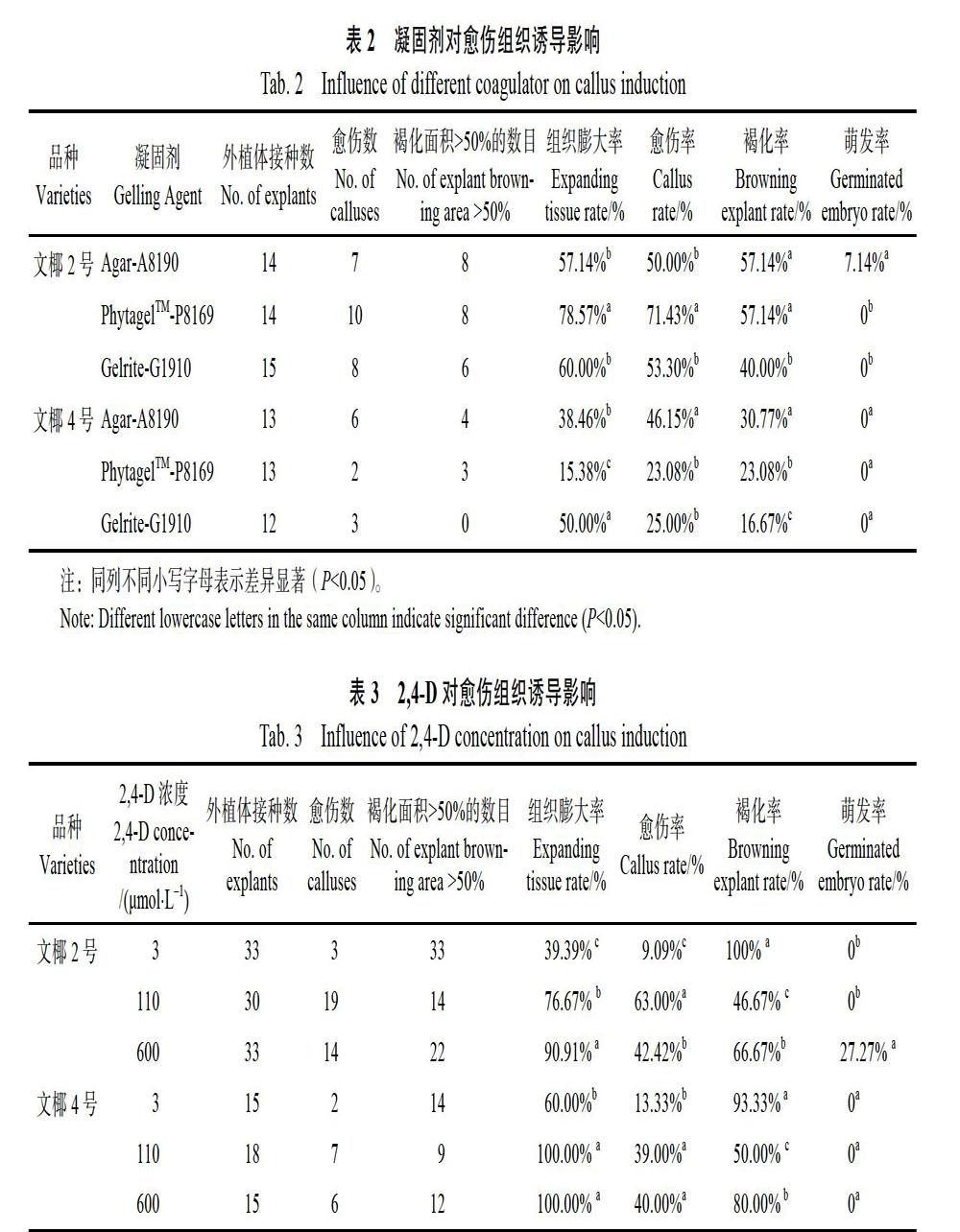
2.2 不同凝固剂对愈伤组织诱导影响
以成熟胚的胚芽为材料,接种至3种不同凝固剂的培养基中,结果如表2所示。‘文椰2号成熟胚的胚芽接种至PhytagelTM-P8169中的胚芽的组织膨大率和愈伤诱导率最高,分别为78.57%和71.43%。接种至Gelrite-G1910中的胚芽褐化率最低,为40.00%。接种至Agar-A8190的胚芽萌发率最高,为7.14%。‘文椰4号成熟胚的胚芽接种至Gelrite-G1910中的胚芽的组织膨大率最高,为50.00%。接种至Agar-A8190中的愈伤率最高,为46.15%。接种至Gelrite-G1910中的胚芽褐化率最低,为16.67%。接种至3种培养基
的胚芽萌发率无差别,均为0。
2.3 不同激素浓度对愈伤组织诱导影响
以成熟胚的胚芽为材料,接种至含有不同浓度2,4-D的培养基中,结果如表3所示。以‘文椰2号为材料,接种至600 μmol/L 2,4-D的胚芽的组织膨大率和萌发率最高,分别为90.91%和27.27%。接种至110 μmol/L 2,4-D的胚芽的愈伤诱导率最高,褐化率最低,分别为63.00%和46.67%。以‘文椰4号为材料,接种至110 μmol/L 2,4-D和600 μmol/L 2,4-D的胚芽的组织膨大率和愈伤率无显著性差异,均显著高于3 μmol/L 2,4-D。接种至110 μmol/L 2,4-D的胚芽的褐化率最低,为50.00%。萌发率在3种不同浓度的培养基上无显著差异,均为0。
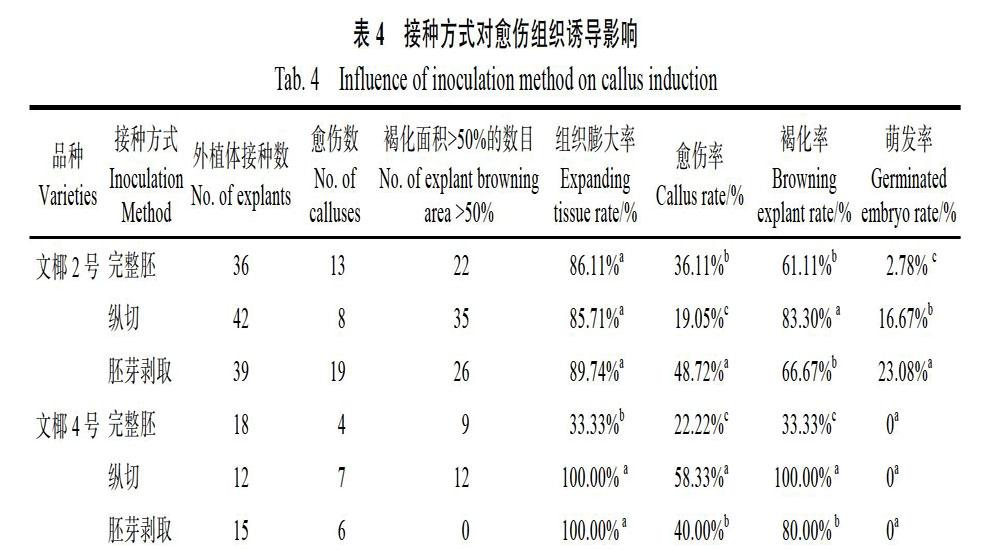
2.4 不同接种方式对愈伤组织诱导影响
以成熟胚为材料,采用不同接种方式接种培养基中,结果如表4所示。以‘文椰2号为材料,3种不同的接种方式得到的组织膨大率无显著性差异,剥取胚芽接种的方式愈伤率最高,为48.72%。以完整胚接种和胚芽剥取接种2种方式接种的褐化率较低,分别为61.11%和66.67%,二者间无显著性差异。以完整胚接种的萌发率最低,为2.78%。以‘文椰4号为材料,纵切和胚芽剥取2种接种方式得到的组织膨大率均为100%。纵切接种的方式愈伤率最高,为58.33%。以完整胚接种的褐化率较低,为33.33%。3种接种方式的萌芽率均为0。
3 讨论
对于椰子愈伤组织诱导的影响因素,目前普遍认为有遗传全能性、外植体种类、培养基成分、诱导条件等[13]。椰子愈伤组织诱导外植体通常包含未成熟花序、未受精子房、花药、顶端生长点、成熟胚及胚芽等。目前认为从胚中剥取胚芽诱导的诱导效率较高,最适用于诱导愈伤组织[14]。本试验选用海南本土栽种的2种优良矮种椰子新品种‘文椰2号和‘文椰4号为取样材料,研究基因型、培养基激素浓度及凝固剂种类和培养方式对愈伤组织诱导及外植体褐化的影响。
3.1 基因型对愈伤组织诱导的影响
前期研究表明取自West African Tall×Malayan Yellow Dwarf[15]、Mexican Malayan Dwarf[10]、Batu Layar Tall[16]、Malayan Green Dwarf[12]、Sri Lanka Tall[17]和Malayan Yellow Dwarf[3]等高种、矮种或杂交种的外植体材料均可诱导出组培苗。对于不同基因型的组织培养结果的差异性在椰子上未见报道。但在其他木本植物中,如紫荆、橡树、北美枫香等[18]以及小麦[19]、玉米[20]等粮食作物中,取样植株的基因型对再生体系的影響均有报道。
本研究以‘文椰2号为诱导材料,组织膨大率、愈伤组织的诱导比例均高于‘文椰4号,同时褐化率和胚的萌发率也高于‘文椰4号。通过对比2个品种的12棵树的诱导结果发现,‘文椰2号中,H1的愈伤率可达83.33%,其他5棵的愈伤率均等于小于50%。‘文椰4号中,X1的愈伤率高于其他5棵树。以上结果表明取样亲本的品种之间和个体基因型对愈伤组织诱导影响显著。‘文椰2号更适用于作为愈伤组织的诱导材料,但因其外植体褐化率和萌发率较高,需要调整培养基成分及激素浓度如提升培养基糖浓度抑制胚的萌发,增加抗褐化剂如硫代硫酸钠、聚乙烯吡咯烷酮(PVP)以降低褐化发生从而提高愈伤诱导率。
3.2 培养基成分对愈伤组织的影响
目前,椰子组织培养普遍以Y3培养基为基础培养基,以高浓度的2,4-D为愈伤组织诱导激素[2]。但是不同凝固剂对椰子组织培养的影响尚未有过报道。凝固剂可直接影响培养基的渗透势,较高浓度的凝固剂可增强培养基的保水性,限制接种材料对于水分的吸收[21]。此外,凝固剂的种类和浓度还可影响培养基中钙、钾、锰等离子的有效含量,进而影响组织培养结果[22]。长期以来植物组织培养中多使用琼脂作为凝固剂,但琼脂通常含有较多杂质,而植物凝胶Phytagel和Gelrite具有通气性好、凝固温度低、杂质含量少、不易发生玻璃化等特点,但Gelrite易发生水化现象[23]。在巴拉圭冬青(Ilex Paraguariensis)的研究中,7种凝固剂的对比结果表明凝固剂的种类对于外植体褐化、愈伤组织诱导、体胚的形成和萌发、再生芽生根等均有显著差异[24]。Zimmerman等[25]的研究表明Gelrite作为凝固剂在棉花愈伤组织诱导上的效果优于琼脂。Manokari等[26]的试验结果表明Phytagel有助于提高香泽兰[Chromolaena odorata (L.) King & H. Rob.]的芽的再生数量和生根数量。‘文椰2号在PhytagelTM- P8169中愈伤率和褐化率最高,‘文椰4号在Agar-A8190中愈伤率和褐化率显著高于其他两种凝固剂。从成本控制和培养效果考虑,Gelrite- G1910的价格高,效果较差,选用PhytagelTM- P8169和Agar-A8190为凝固剂更为适宜。
為诱导椰子胚芽产生愈伤组织,培养基中均添加高浓度的2,4-D,同时为抑制外植体褐化,通常添加活性炭以吸附外植体在诱导过程中产生的有害物质[2]。同时,活性炭对于培养基内的激素具有强烈的吸附作用,实际可被外植体所利用的激素浓度并不确定。Sáenz等[13]通过对未接种外植体的培养基检测发现,使用细胞培养级别的活性炭,培养基内的2,4-D浓度可在1 d后下降至原浓度的1.5%以下,而pH值在8 d内有先上升至6.2后下降至6.12的趋势。本试验发现,不添加活性碳,低浓度的2,4-D并不能提升愈伤组织的诱导效率,反而会导致外植体褐化程度加重。对比愈伤率和褐化率后发现,对于‘文椰2号,2,4-D适宜浓度为110 μmol/L。‘文椰4号在110 μmol/L和600 μmol/L的诱导结果无显著差异。考虑外植体褐化率、后期愈伤组织变异率和成本控制等因素,以上述2种材料的胚芽为外植体时,宜选用的2,4-D浓度为110 μmol/L。
3.3 不同接种方式对愈伤组织诱导影响
椰子愈伤组织诱导过程中,未成熟胚、成熟胚、胚不同部位的切片及成熟胚中的胚芽均被用作为诱导材料[27-28]。后期经验证由胚中心部位取得的切片最适用于组织培养,当以远离胚中轴的组织为材料时,愈伤组织的诱导率会急剧下降[29]。目前,胚切片接种技术已不再使用,取而代之的是直接将胚芽从胚中分离[30]。在其他作物如水稻[31]、小麦[32]和杉木[33]中,以胚为外植体诱导愈伤组织时,最佳的处理方法是不将胚从胚乳中分离,对胚造成伤口后直接接种诱导。林拥军等[34]指出胚或种子自身具有相对稳定的内源激素调节系统,对外界激素具有一定的缓冲调节能力,可使胚正常生长发育形成植株。而愈伤组织的形成就是要打破植物自身的激素平衡促使组织脱分化。结合本试验结果,接种方式对同一椰子品种的成熟胚愈伤组织诱导的差异可能与胚芽及胚的完整性有关,对于不同品种的差异可能与胚的大小或胚的成熟程度有关。在相同接种方式的处理下,‘文椰2号11月龄成熟胚萌发率高于‘文椰4号,表明‘文椰2号的胚内源激素平衡能力可能高于‘文椰4号,且在取样过程中发现11月龄的‘文椰2号胚和胚芽的体积均大于‘文椰4号。因此猜测胚的内源激素平衡能力与胚的成熟度也有一定的关系,需要后期进一步验证。本试验表明‘文椰2号宜选择胚芽剥取接种方式,‘文椰4号宜选择纵切接种的方式。完整胚接种,未造成伤口,因此产生的酚类物质较少,褐化率较低,但同时内部胚芽难以接触到培养基内激素,愈伤率也较低。纵切接种的伤口表面积大,褐化率显著高于其他接种方式,但是纵切接种可将部分胚芽暴露出来,接收外界激素刺激,同时对胚芽造成伤害较小,因此可提升诱导效率。剥取胚芽接种,可使诱导组织对外界的接触面积达到最大,且减少了胚残留组织褐化对愈伤组织诱导的影响,但同时胚芽体积较小,剥取过程较为繁琐,耗时长。具体采用哪种接种方式需要根据胚的大小、胚芽的大小及成熟度来决定。
4 结论
本试验对‘文椰2号和‘文椰4号2个海南本地优良栽培品种进行愈伤组织诱导,明确品种间和品种的个体间,即不同基因型的愈伤组织诱导率存在显著差异。适用于‘文椰2号的愈伤组织诱导的接种方式为胚芽剥取接种,适宜诱导培养基为:Y3+30 g/L蔗糖+110 μmol/L 2,4-D+ 4 g/L PhytagelTM-P8169+2.5 g/L活性炭。适用于‘文椰4号的愈伤组织诱导的接种方式为纵切接种,适宜诱导培养基为:Y3+30 g/L蔗糖+110 μmol/L 2,4-D+6 g/L Agar-A8190+2.5 g/L活性炭。
参考文献
周焕起, 黄丽云, 许小妹, 等. 椰子愈伤组织诱导与防褐变技术研究[J]. 江西农业学报, 2010, 22(3): 62-63, 66.
Nguyen Q T, Bandupriya H D D, López-Villalobos A, et al. Tissue culture and associated biotechnological interventions for the improvement of coconut (Cocos nucifera L.): a review[J]. Planta, 2015, 242(5): 1059-1076.
Rajesh M K, Radha E, Sajini K K, et al. Polyamine-induced somatic embryogenesis and plantlet regeneration in vitro from plumular explants of dwarf cultivars of coconut (Cocos nucifera)[J]. Indian Journal of Agricultural ences, 2014, 84(4): 527.
Litz R E. Biotechnology of fruit and nut crops[M]. Boston: MA CABI, 2020.
Cutter V M J, Wilson K S. Effect of coconut endosperm and other growth stimulants upon the development in vitro of embryos of Cocos nucifera[J]. Botanical Gazette, 1954, 115(3): 234-240.
Nguyen Q T, Bandupriya H D D, López-Villalobos A, et al. Tissue culture and associated biotechnological interventions for the improvement of coconut (Cocos nucifera L.): a review[J]. Planta, 2015, 242(5): 1-18.
Eeuwens C J. Mineral requirements for growth and callus initiation of tissue explants excised from mature coconut palms (Cocos nucifera) and cultured in vitro[J]. Physiologia Plantarum, 1976, 36(1): 23-28.
Thanh-Tuyen N T, De Guzman E V. Formation of pollen embryos in cultured anthers of coconut (Cocos nucifera L.)[J]. Plant Sci Lett, 1983, 29(1): 81-88.
Hornung R. Micropropagation of Cocos nucifera L. from plumular tissue excised from mature zygotic embryos [J]. Plantations, Recherche, Developpement (France), 1995, 201: 38-41.
Chan J L, Saenz L, Talavera C, et al. Regeneration of coconut (Cocos nucifera L.) from plumule explants through somatic embryogenesis[J]. Plant Cell Reports, 1998, 17(6-7): 515-521.
Perera P I P, Hocher V, Verdeil J L, et al. Unfertilized ovary: a novel explant for coconut (Cocos nucifera L.) somatic embryogenesis[J]. Plant Cell Reports, 2007, 26(1): 21-28.
Pérez-Núez M T, Chan J L, Sáenz L, et al. Improved somatic embryogenesis from Cocos nucifera (L.) plumule explants[J]. In Vitro Cellular & Developmental Biology. Plant, 2006, 42(1): 37-43.
Sáenz L, Herrera-Herrera G, Uicab-Ballote F, et al. Influence of form of activated charcoal on embryogenic callus formation in coconut (Cocos nucifera)[J]. Plant Cell Tissue & Organ Culture, 2010, 100(3): 301-308.
Rajesh M, Raha E, Sajini K, et al. Polyamine-induced somatic embryogenesis and plantlet regeneration in vitro from plumular explants of dwarf cultivars of coconut (Cocos nucifera)[J]. Indian Journal of Agricultural ences, 2014, 84(4): 527.
Magnaval C, Noirot M, Verdeil J L, et al. Free amino acid composition of coconut (Cocos nucifera L.) calli under somatic embryogenesis induction conditions[J]. Journal of Plant Physiology, 1995, 146(1-2): 155-161.
Adkins S W, Samosir Y M, Ernawati A, et al. Control of ethylene and use of polyamines can optimise the conditions for somatic embryogenesis in coconut (Cocos nucifera L.) and papaya (Carica papaya L.)[J]. Acta Horticulturae, 1998(461): 459-466.
Perera P I P, Vidhanaarachchi V R M, Gunathilake T R, et al. Effect of plant growth regulators on ovary culture of coconut (Cocos nucifera L.)[J]. Plant Cell Tissue & Organ Culture, 2009, 99(1): 73-81.
Corredoira E, Merkle S A, Martínez M T, et al. Non-zygotic embryogenesis in Hardwood species[J]. Critical Reviews in Plant Sciences, 2019, 38(1): 29-97.
張东武, 刘 辉, 赵惠贤. 小麦成熟胚组织培养再生体系的优化及高再生率基因型的筛选[J]. 麦类作物学报, 2011, 31(5): 847-852.
刘 双, 关淑艳, 孙 苏, 等. 玉米愈伤组织培养体系优化及ICE1基因的遗传转化[J]. 吉林农业大学学报, 2017, 39(5): 518-523.
顾晓川, 徐正伟, 成 镜, 等. 植物凝胶和蔗糖对橡胶树体胚植株再生的影响[J]. 广西植物, 2018, 38(9): 1164- 1171.
Li X Y, Huang F H, Gbur E E. Effect of basal medium, growth regulars and phytagel concentration on initiation of embryogenic cultures from immature zygotic embryos of loblolly pine (Pinus taeda L.)[J]. Plant Cell Rep, 1998, 17(4): 298-301.
张 巧, 汪静儿, 林 君, 等. 不同凝固剂对陆地棉体细胞胚胎发生和植株再生的影响[J]. 棉花学报, 2010, 22(1): 3-9.
Sansberro P A, Rey H Y, Luna C V, et al. Influence of gelling agents on Ilex paraguariensis tissue culture[J]. Acta Horticulturae, 2001(560): 453-456.
Zimmereman T W, Robacker C W. Media and gelling agent effect on cotton callus in initiation from excised seedhypoeo tyles[J]. Plant Cell Tissue Organ Cul, 1988, 15: 269-274.
Manokari M, Kannan N, Priyadarshini S, et al. Effects of growth regulators and gelling agents on in vitro regeneration of Chromolaena odorata (L.) King & H. Rob.[J]. Social ence Electronic Publishing, 2020: 10.2139/ssrn. 3554240.
Adkins S W, Samosir Y, Godwin I D. Control of environmental conditions and the use of polyamines can optimise the conditions for the initiation and proliferation of coconut somatic embryos[J]. Current Advances in Coconut Biotechnology. Springer. 1999, 35: 321-340.
Samosir Y, Godwin I, Adkins S. The use of osmotically active agents and abscisic acid can optimise the maturation of coconut somatic embryos[J]. Current Advances in Coconut Biotechnology. Springer. 1999, 35: 341-354.
Sáenz-Carbonell L, Montero-Cortés M, Pérez-Nu?ez T, et al. Somatic Embryogenesis in Cocos nucifera L. [M]//Víctor M Loyola-Vargas, Neftalí Ochoa-Alejo Somatic Embryogenesis: Fundamental Aspects and Applications. New York: Springer. 2016.
Fernando S, Verdeil J L, Hocher V, et al. Histological analysis of plant regeneration from plumule explants of Cocos nucifera[J]. Plant Cell, Tissue and Organ Culture, 2003, 72(3): 281-283.
沈 娟, 徐利娟, 張启军, 等. 不同接种方式对水稻成熟胚组织培养的影响[J]. 江苏农业科学, 2012, 40(8): 67-69.
左静静, 刘少翔, 闫贵云, 等. 小麦幼胚组织培养研究进展[J]. 中国农学通报, 2010, 26(19): 81-87.
陈 琴, 陈代喜, 劳广杰, 等. 杉木未成熟胚胚性愈伤组织诱导影响因素探析[J]. 广西植物, 2017, 37(5): 587-591.
林拥军, 邹玉兰, 万 骅, 等. 水稻成熟胚组培过程中胚乳影响的研究[J]. 江西农业大学学报, 1996, 18(3): 259- 263.
责任编辑:白 净

