代谢组学在植物逆境生物学中的研究进展
张凤 陈伟
(1. 华中农业大学 作物遗传改良国家重点实验室 国家植物基因研究中心,武汉 430070;2. 华中农业大学植物科学技术学院, 武汉 430070)
随着全球持续而复杂的环境变化,自然界中生物和非生物胁迫频繁爆发。一系列的病毒、真菌以及虫害等生物胁迫以及干旱、盐、极端温度和紫外胁迫等非生物胁迫严重影响了植物的正常生长和发育,尤其是农作物的产量[1-3]。转录组学、蛋白组学以及表型组学等在解析植物体响应和适应逆境胁迫方面具有重要作用[4-5]。然而,这些研究方法提供的数据是有限的,在研究植物响应和适应逆境胁迫方面仍然具有局限性。逆境胁迫下代谢物的变化是其基因与环境因素共同作用的结果,是生物体生理表型与体内生化水平的直接体现。代谢组学的兴起,为研究植物不同组织和逆境胁迫下代谢组重塑提供了可靠的手段[6-8]。作为系统生物学中重要的一门学科,代谢组与基因组、转录组、蛋白组或表型组的整合,尤其是代谢组与基因组整合形成的代谢组-基因组关联分析,为植物代谢组的遗传基础解析和调控机制研究提供了重要的参考依据。本文综述了逆境胁迫下植物代谢组学的研究方法、逆境胁迫下植物代谢组重塑的多样性以及逆境胁迫下植物代谢组的遗传基础研究进展,并展望了应用代谢组学研究植物逆境生物学的应用前景和局限性。
1 逆境胁迫下植物代谢组学的研究方法
代谢组学的概念最早是由英国科学家Nicholson提出的“metabonomics”以及德国科学家Fiehn提出的“metabolomics”而来[9-10]。作为系统生物学的重要组成之一,代谢组学是指在特定物种、特定发育阶段以及特定的器官、组织和细胞中所有低分子量代谢组的定量和定性分析的一门学科[11-12]。与基因组学、转录组学以及蛋白组学不同,代谢组学反映的是细胞在特定条件下确实发生的事件,是生物体内基因与环境因素共同作用的结果,是生物体生理表型与体内生化水平的直接体现[13-14]。在自然界中,一系列环境因子如极端温度、旱、盐、紫外线以及病原菌等在分子、生化以及生理水平上给植物造成了潜在的威胁[15-16]。代谢组作为连接植物体遗传与生理指标的重要基础,通过代谢组学研究逆境胁迫下代谢组的差异为揭示特定胁迫条件下代谢物的差异积累、代谢途径解析以及植物体抵御逆境胁迫的调控机制提供理论基础。目前,代谢组学已经广泛用于研究不同物种、同一物种不同组织以及同一物种同一组织在不同逆境胁迫下代谢物的变化 差异[17-18]。
一般而言,逆境胁迫下植物代谢组学的研究流程包括逆境胁迫与对照条件下植物样品的制备、代谢物的提取、代谢物的检测、数据采集和预处理、逆境胁迫下代谢物的注释以及代谢途径的解析等步骤(图1)。根据研究目的,代谢组学分为非靶向代谢组学、靶向代谢组学和广泛靶向代谢组学[19-21]。非靶向代谢组学是对有机体内代谢物进行全面和无偏向的代谢物分析。非靶向代谢组学由于检测物质的信息较大,具有较为广泛的物质覆盖率。但是,由于缺乏标准品,非靶向代谢组学可能会产生假阳性的信号。同时,非靶向代谢组学不能对物质进行绝对定量以及重复性较差[20]。目前,非靶向植物代谢组学常用检测技术主要有气相色谱和质谱联用(GC-MS)、液相色谱和质谱联用(LC-MS)、毛细管电泳和质谱联用(CE-MS)以及核磁共振(NMR)等。其中,最常用的是NMR、GC-MS以及LC-MS。NMR灵敏性低,样品处理简单,主要用于代谢物结构的分析[22]。GC-MS具有较高的分辨率和较高的灵敏度,样品需要衍生化,主要用于挥发性物质检测。然而,LC-MS具有较高的分辨率和较高的灵敏度,主要用于非挥发性物质的检测[11]。为了降低误差和提高数据分析的准确性,需要对采集的数据进行归一化或标准化的预处理。然后,对预处理的数据进行分析。常用的数据分析方法有主成分分析(princi- pal component analysis,PCA)、聚类分析(hierarchical cluster analysis,HCA)以及偏最小二乘法(partial least square,PLS)[23]。最后,结合相关文献、标准品比对以及代谢组学数据库如MassBank、KEGG、PlantCyc以及PubChem等对植物响应逆境胁迫的代谢物进行注释。
靶向代谢组学主要是通过标准品或同位素内标对代谢物的绝对定性或定量分析,是有机体内特定一类代谢物的研究分析。由于靶向代谢组学关注特定种类的代谢物,可以对数据进行准确定性和绝对定量,具有较好的重复性和灵敏性。而且,数据分析比非靶向代谢组学更简单和直接。但是,靶向代谢组学通量相对较低且需要购买标准品[20]。在使用的方法和数据库应用方面,靶向代谢组学和非靶向代谢组学相似。广泛靶向代谢组学是一种结合了非靶向代谢组检测的广谱性和靶向代谢组检测的准确性,主要通过多反应监测技术(multiple reaction monitoring,MRM)采集数据并建立代谢物数据库来实现对代谢物的精确定性及定量[21]。广泛靶向代谢组学整合了非靶向和靶向代谢组学的优点,具有通量高和定性准确等优点。但是,广泛靶向代谢组学需要自建数据库。在植物体内,由于其生长环境的复杂性和体内代谢物种类的多样性,至今没有发现哪一种检测技术能够满足植物体内所有代谢物的检测。随着组学检测技术的发展,代谢组与基因组、转录组、蛋白组以及表型组整合并结合正向或反向遗传学手段实现了对植物响应逆境胁迫代谢物注释、代谢途径解析以及植物响应和适应逆境胁迫的调控机制揭示(图1)。

图1 逆境胁迫下植物代谢组学的研究流程Fig.1 Research process of plant metabolomics under stresses
2 逆境胁迫下植物代谢组重塑的多样性
在自然界中,植物体内代谢物分为初生代谢物和次生代谢物。初生代谢物如糖类、氨基酸类以及三羧酸循环的中间物质等,主要参与植物的生长发育[24]。由初生代谢物合成的次生代谢物在自然界中大约有20万种,主要分为苯丙烷类(phenylpropanoids)、硫苷类(glucosinolates)、萜类(terpenoids)以及生物碱类(alkaloids)等,主要参与植物的信号传导、植物与环境的互作以及植物防御等[25-26]。就同一物种而言,代谢物积累既有时空积累的特异性,又存在逆境响应的多样性[27-28]。因此,对不同发育阶段代谢图谱的分析可以找到不同发育阶段响应的特异代谢物。同时,对逆境下代谢物积累模式分析可以找到一些抗性生物标记物质。代谢组是植物体表型的生化基础,逆境胁迫条件下代谢组重塑很大程度上反映了植物体对逆境的响应和防 御[29-31]。事实上,在生物逆境和非生物逆境下植物体内代谢组存在大量重塑,展现出多样化的现象。
2.1 生物逆境下植物代谢组重塑的多样性
Parker等发现当大麦(Hordeum vulgare L.)受到稻瘟病(Magnaporthe oryzae)入侵时,体内代谢物发生重排,多胺类(polyamines)、phenylpropanoids以及脂肪酸类(fatty acids)等代谢物含量明显升高[32]。同时,Kumaraswamy等[33]指出植物体受到赤霉病(fusarium head blight,FHB)侵染时,几个与植物防御相关的代谢物如茉莉酸(jasmonic acid,JA)、二氢甘氨酸(dihydro-7-hydroxyglycine)、葡萄糖苷、鼠李糖苷的山奈酚(kaempferol-3-O-glucoside-7-O-rhamnoside)以及甲氧基肉桂酸(4-methoxycinnamic acid)的含量明显增加。进一步,Dixon等[34]对FHB敏感的大麦植株的代谢谱分析表明,大麦中高含量的黄酮类、脂肪酸以及萜类等物质与抗FHB密切相关。Chitarrin等[35]对受到霜霉病(Plasmopara viticola)入侵的抗性葡萄(Vitis vinifera L.)的代谢图谱详细分析表明,抗性葡萄品种中早期积累的代谢物主要是不饱和脂肪酸、氨基酸以及可溶性糖等初生代谢物,中期积累的是一些挥发性的苯甲醛(benzaldehyde),后期积累的主要是黄酮类(flavonols)以及芪类化合物(stilbenes)。
2.2 非生物逆境下植物代谢组重塑的多样性
同时,植物体内初生代谢物和次生代谢物也广泛参与非生物胁迫过程。在多种氨基酸中,脯氨酸(proline)受非逆境胁迫影响最为明显,proline含量的差异与逆境胁迫如干旱、盐、洪涝以及极端温度等直接相关[36-37]。此外,Yadav等[38]指出干旱逆境下,小麦(Triticum aestivum L.)体内天冬氨酸(aspartic acid)含量明显增加。同时,植物次生代谢物如phenylpropanoids、terpenoids以及fatty acids等的含量在干旱逆境下普遍增加[39-40]。此外,植物在响应干旱的不同阶段代谢组重塑模式也存在明显差异。Goufo等[41]发现在豇豆(Vigna unguiculata L. walp.)根中氨基酸、可溶性糖以及原花青素(proanthocyanidin)的积累与干旱胁迫起始阶段的感知密切相关。Khan等[42]对长期干旱条件下鹰嘴豆(Cicer arietinum)叶片代谢图谱分析表明,尿囊素(allantoin)、proline、组氨酸(histidine)、异亮氨酸(isoleucine)以及色氨酸(tryptophan)的含量在干旱条件下明显上升。同时,胆碱(cholinevidine)、苯丙氨酸(phenylalanine)、γ-氨基丁酸(γ-aminobutyric acid)、丙氨酸(alanine)以及aspartic acid含量明显下降。研究表明,一些代谢物如甜菜碱(betaine)、proline、polyamines和多羟基醇(polyhydroxy-alcohols)等与盐胁迫的耐受密切相关[43-44]。Ye等[45]通过对盐胁迫下狗牙草(Cynodond actylon)中代谢物的分析表明,盐胁迫明显提高了氨基酸、可溶性糖、有机酸以及可溶性糖醇等37种代谢物的含量。Yang等[46]对普通野生大豆(Glycine max)及耐盐的野生大豆代谢图谱分析指出,耐盐的野生型大豆通过增强体内氨基酸及有机酸代谢来增强大豆的耐盐性。由色氨酸合成而来的五羟色胺(serotonin)和褪黑素(melatonin)广泛参与植物冷及冻的胁迫过程。Ding等[47]通过外源添加色胺类物质的方式分析冷胁迫对番茄(Solanum lycopersicum)的伤害程度表明,外源施加melatonin通过增强活性氧相关酶活性减缓番茄对冻害的伤害。Fan等[48]指出,在水稻(Oryza sativa L.)幼苗中melatonin通过提高光系统的效率以及抗氧化酶活性来增强植株对冷的耐受性。在紫外和氧化胁迫下,flavonoids的含量普遍上升。Nakabayashi等[49]对过量积累黄酮类物质的拟南芥进行干旱和氧化胁迫处理表明,拟南芥(Arabidopsis thaliana)中过度积累flavonoids增强植株对氧化胁迫及干旱胁迫的耐受性。Tohge等[50]指出拟南芥中黄酮醇苯酰基转移酶(flavonolphenylacyltransferase)促进酰基化类黄酮(phenylacylflavonol)的积累从而增强紫外线胁迫的耐受性。 此外,Ju等[51]对洪涝后葡萄叶片代谢图谱分析表 明,叶片中挥发性物质,尤其是2-己醛(2-hexenal)和3-己醛(3-hexenal)在抵御洪涝具有重要作用。这些研究结果表明,不同物种对同一种逆境胁迫具有相似性。同一物种在不同逆境胁迫下,代谢物的积累模式也具有明显的差异性(表1)。因此,通过对逆境胁迫下代谢组数据挖掘,为注释特定逆境胁迫下植物响应逆境的代谢物和解析相关逆境胁迫的代谢通路提供理论基础。同时,对逆境下植物体内代谢物定量分析可以帮助鉴定植物响应逆境胁迫的生理表型和筛选耐受逆境的植物个体,更好地解析植物响应以及适应逆境的生化遗传基础从而助力农作物稳产。

表1 植物响应逆境胁迫代谢物研究列表Table1 Research list of plant metabolites in response to stresses
3 代谢组学在植物逆境遗传基础的进展
代谢组学作为植物体内代谢组检测的重要手段,揭示了不同物种间,同一物种不同组织以及同一物种同一组织在不同逆境胁迫下代谢物的积累模式,为发现植物特异积累的代谢物以及与逆境胁迫响应的标志代谢物提供参考依据。然而,逆境胁迫下植物体内代谢物重塑是一个复杂的过程,牵涉到一系列基因表达和调控,是DNA、RNA、蛋白质以及代谢物与逆境胁迫共同作用的结果[52]。当植物体受到不同逆境胁迫时,体内响应蛋白(receptors)首先被激活,激活下游的信号蛋白如蛋白激酶(receptor-like kinases,RLKs)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)、转录因子(MYBs、WRKYs以及bZIPs等)以及热激蛋白(heat shock factors,HSFs)等,进而激活代谢途径相关基因如参与类黄酮代谢相关基因茶耳酮合成酶(chalcone synthases,CHSs)、黄酮醇合成酶(flavonol synthases,FLSs)和类黄酮UDP-糖基转移酶(UDPdependent glycosyltransferases,UGTs)以 及 参 与 萜类合成的牻牛儿基焦磷酸合酶(geranyl diphosphate synthases,GPSs)、法 呢 基 焦 磷 酸 合 酶(farnesyl diphosphate synthases,FPSs)、牻牛儿牻牛儿基焦磷 酸 合 酶(geranyl geranyl pyrophosphate synthases,GGPSs)以及萜烯合酶(terpene synthases,TPSs)等表达,促进黄酮类和萜类等物质的积累增强植物体对逆境胁迫的耐受性[53](图2)。因此,在系统生物学中,代谢组学仅仅是系统生物学的一部分,单从代谢组学的角度解析植物体对逆境胁迫的调控机制以及遗传基础是远远不足的。事实上,代谢组学与转录组学的整合广泛应用于多种逆境胁迫下植物的调控机制研究。Wang等[54]通过对水稻幼苗的转录组和代谢组图谱分析表明,在耐寒性水稻品种中特异积累脱落酸(abscisic acid,ABA)介导脂类和脂肪酸代谢过程;Copley等[55]通过代谢组与转录组的整合分析揭示了大豆在响应纹枯病(sheath blight)侵染后的初生代谢的调控机制;Egea等[56]指出,在耐旱野生番茄中氨基酸代谢以及植物激素如乙烯(ethylene)和JA代谢与干旱的耐受密切相关。相似地,代谢组与转录组的整合分析揭示了小麦初生代谢参与赤霉病(fusarium head blight)耐受性[57-58]。同时,代谢组学与蛋白组学的整合在多种逆境胁迫下被研究[59-60]。Kumar等[61]通过代谢组与蛋白组的整合分析表明,鹰嘴豆感染尖孢镰刀菌(fusarium oxysporum)后,碳氮代谢与鹰嘴豆抵抗尖孢镰刀菌密切相关。同时,Chmielewska等[62]对干旱敏感和干旱耐受的大麦品种的蛋白组和代谢组的分析指出,干旱耐受的大麦品种叶片及根中苯丙烷代谢相关的酶的表达以及氨基酸类物质含量的增加参与大麦抵抗干旱。此外,通过基因组学、蛋白组学以及代谢组学的整合,Pandey等[63]确定了草酸是小麦黑穗病的主要致病因子。这些研究结果表明,通过代谢组学与转录组学或/和蛋白组学的整合为逆境胁迫下植物代谢物的鉴定、代谢途径解析以及植物响应逆境胁迫的生化遗传基础解析提供重要参考依据(图1)。
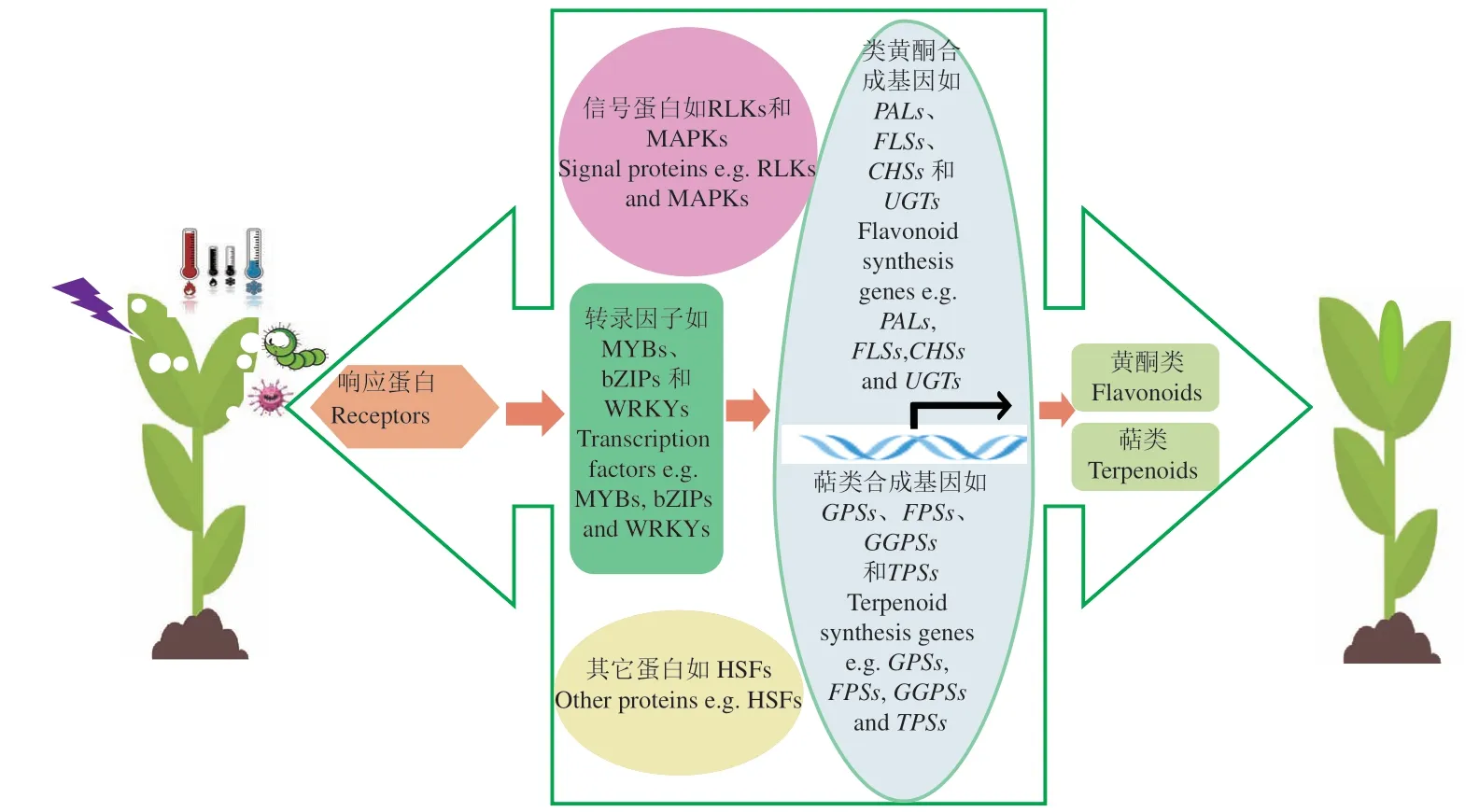
图2 植物次生代谢响应逆境胁迫的调控网络Fig.2 Regulatory networks of plant secondary metabolism in response to stresses
事实上,植物在生长过程中暴露在各种生物和非生物环境因子中,群体中不同个体的性状和表型为研究植物体的性状及表型的调控机制提供可靠参考。正向遗传学的方法如连锁分析已经证明在鉴定性状、数量性状位点(quantitative trait loci,QTL)以及同一群体不相关个体的性状表型中是非常有效的[64]。因此,比较分析世界不同地区的植物种质资源可以为植物体响应以及耐受逆境胁迫的机制研究提供遗传基础。随着基因组测序技术的发展,应运而生的基因组关联分析(GWAS)已经广泛应用于自然群体中不同个体的性状表型的分析[65]。同时,随着代谢组学检测技术的发展和更新,像表型性状的QTL和GWAS一样,代谢组的数量性状位点(metabolic quantitative trait loci,mQTLs)和代谢组-基因组关联分析(metabolic genome-wide association study,mGWAS)在揭示植物代谢物含量变异的遗传基础具有重要作用[66-67]。目前mQTL和mGWAS在拟南芥、番茄、水稻以及玉米(Zea mays)等多个物种中被广泛研究。Lisec等[68]通过369份拟南芥重组自交系(recombination inbred line,RIL)的mQTL分析表明,代谢杂种优势主要由上位性贡献决定的。Schauer等[69]在76份番茄重组自交系中找到了30个mQTLs,解析了部分初生代谢物含量变异的遗传基础。此外,响应逆境胁迫性状的QTL以及mQTLs在几个物种中已经被报道。Templer等[70]对81份大麦种质叶片的干旱及热胁迫下mQTLs分析表明,γ-生育酚(γ-tocopherol)、谷胱甘肽(glutathione)和琥珀酸(succinate)参与大麦中干旱及热胁迫的适应,并鉴定了响应该胁迫的mQTL位点。Yang等[71]通过对玉米抗病相关的数量性状位点qMdr9.02精细图谱分析表明,编码一个咖啡酰辅酶A甲基转移酶(caffeoyl-CoA O-methyltransferase,ZmCCoAOMT2)通过调控木质素代谢参与南方叶枯病和灰斑病的抗性。Hill等[72]对干旱胁迫下小麦剑叶的95个mQTLs分析表明,38个mQTLs与农艺性状密切相关。Chen等[73]通过529份水稻核心种质的五叶期叶片的mGWAS解析了部分次生代谢物的遗传基础;Zhu等[74]通过番茄群体的mGWAS找到了参与番茄风味调控的物质并解析了风味物质调控的机制;Zhang等[75]通过水稻类黄酮含量的mGWAS筛选到一个特异响应UV-B的类黄酮糖基转移酶。这些研究表明,代谢组与基因组的整合在解析植物体内代谢途径以及代谢组的遗传基础提供可靠的参考依据。
然而,植物体内逆境胁迫下mGWAS的研究相对较少。通过对逆境胁迫下mGWAS的定位结果分析,在解析植物响应、耐受逆境胁迫的调控机制以及选育耐受逆境的农作物品种具有重要意义。与正向遗传学相反地,反向遗传学主要关注一个基因的改变一个生化途径,进而探究植物代谢途径[76-77]。通过反向遗传工具如RNA干扰技术(RNA interference,RNAi)和基因敲除(gene knockout)直接检测突变体中特定代谢物的改变从而鉴定潜在基因的功能[78]。同时,随着基因编辑技术CRISPR/CAS9的发展,反向遗传学极大促进并加快了学者对植物代谢相关基因的功能解析[79-80]。因此,运用正向遗传学与反向遗传学结合的方法对植物逆境胁迫下挖掘的新基因进行功能验证是非常快速和高效的。尤其是,运用反向遗传工具验证通过逆境胁迫mGWAS挖掘的候选基因将是既快速而又可靠的手段。在未来,逆境胁迫依然是影响植物生长发育以及农作物产量的重要威胁,代谢组与基因组、转录组、蛋白组以及表型组等其它组学的整合,并结合反向遗传工具将更高效解析植物响应以及适应逆境胁迫的生化遗传基础,从而加快对植物响应以及适应逆境胁迫的调控机制研究,助力农作物的稳产(图1)。
4 结论和展望
代谢组学作为系统生物学的重要组成部分,揭示了不同物种间,同一物种不同组织中以及同一物种同一组织在不同逆境胁迫下代谢图谱的差异。代谢组与基因组、转录组、蛋白组以及表型组等其它组学的整合为植物代谢组的鉴定、代谢途径解析以及植物响应逆境胁迫的生化遗传基础研究提供重要参考依据。同时,代谢组学与其它组学的整合并结合反向遗传工具快速筛选植物与环境互作的抗性基因、选育抗性品种是助力农作物稳产的重要手段。然而,代谢组学在植物逆境胁迫中的研究仍然存在一些挑战。在植物众多代谢物中,已检测和鉴定的代谢物仍然是屈指可数的。目前,对于植物中不同属性的代谢物还没有统一的检测和提取方法。同时,在自然界中,植物遭受的逆境胁迫是多种逆境胁迫共同作用的结果。而且,植物与逆境胁迫的互作是一个复杂的过程,牵涉到逆境信号的感知、信号传导以及植物对逆境的防御等。因此,植物中代谢组检测方法的改进、鉴定技术的提升、多水平组学的整合以及反向遗传工具的开发将为深入研究逆境胁迫下植物代谢组的遗传基础以及解析逆境胁迫的调控机制研究提供有力保障。

