基于核心素养构建元素化合物认知模型教学设计
——以“二氧化硫的性质和应用”为例
张梦烨
(江苏省苏州市东山中学 江苏苏州 215000)
高中化学的重点内容之一就是元素化合物的学习,这部分内容的教学常以讲授为主,学生的学习比较被动,课堂中的学生实验也只是按照已给出的实验方案进行简单的实验操作,学习过程没有达到足够的思维深度,化学核心素养目标无法在教学中很好地体现。构建元素化合物知识的认识模型,是化学知识骨架的构建,对培养学生创新意识和实践能力有重要意义,是落实化学学科核心素养的知识载体。学习好元素化合物,有利于学生构建高中化学知识体系,提高学生类比同化、归纳演绎、信息加工、分析推理等方面的能力,以及培养学生的辩证思维和社会责任[1]。
一、内容分析
二氧化硫的性质和应用是苏教版高中化学必修第一册专题4中第一单元含硫化合物性质中的第一课时,含硫化合物的学习在氯和钠元素的学习之后,所以该阶段,学生还没有建立研究元素化合物学习的认知模型。新版的这节课与旧版相比改动较大,之前以酸雨的形成来引入二氧化硫相关知识的学习,而新版的这节内容中更注重二氧化硫对人类生活的作用。
本节课以生活中常见的“食品添加剂”为背景来激发学生的学习兴趣。学生在本课之前,已经学习了海水中的化合物和氧化还原反应等相关知识,因而不仅在元素化合物的理论知识学习方面有基础,而且有能力操作一些简单的实验和进行探究性实验的学习。
二、教学目标的构建
在知识层面上,基础初中碳及其化合物、高中氯元素和钠元素化合物性质学习的基础和氧化还原反应的理论基础上,需掌握SO2是一种酸性氧化物,具有酸性氧化物的通性,以及SO2的特殊性质——还原性、氧化性和漂白性。
在方法层面上,很多学生对元素化合物知识的学习都是通过死记硬背的方式,缺乏元素化合物性质研究模型的认识。化合物性质的研究一般从两方面进行:一是按元素的组成进行分类,归纳出该类型物质的一般化学性质;二是从核心元素的价态出发,判断其性质以实现不同物质间的转化[2]。学生需要会判断SO2是酸性氧化物,SO2中的S元素的价态为+4价。
在观念层面上,化学基本观念往往隐藏在教材中,以具体知识为载体来挖掘出隐含其中的观念。本节课的教材以生活中SO2的应用为载体来体现SO2的特殊性质。基于以上分析,由此确定教学目标为:
1.基于物质类别、元素价态对二氧化硫的性质作出解释与预测;
2.通过观察和实验探究,归纳二氧化硫的性质;
3.认识食品中适量添加二氧化硫的作用,辩证分析二氧化硫与人类生活、社会发展的关系。
三、设计流程
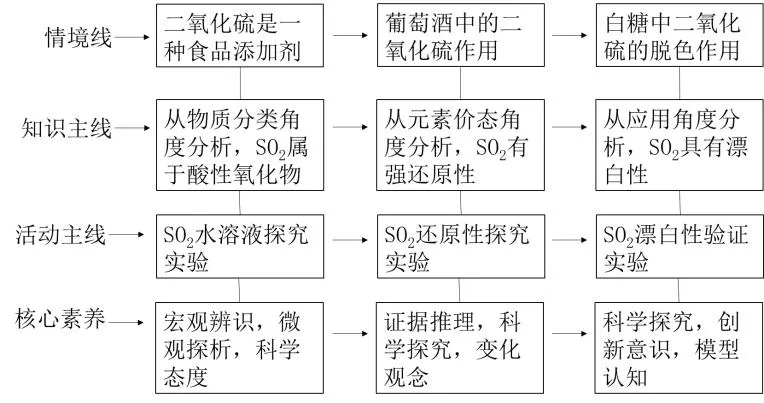
四、教学过程
环节1:情境创设
问题引导:你对食品添加剂有何认识?
视频导入介绍食品添加剂。(引出SO2是一种食品添加剂,打破学生对二氧化硫只是一种空气污染物的认识,引发学生对二氧化硫性质的学习兴趣。)
环节2:SO2是酸性氧化物的学习
师:展示一瓶用塑料瓶装的二氧化硫气体。
生:总结二氧化硫的物理性质。
活动探究1:老师演示二氧化硫溶于水的实验,用针筒抽取10mL水注入塑料瓶中,塑料瓶立刻变瘪了。
师:二氧化硫溶于水是物理变化还是化学变化?
学生实验1:根据提供的药品:SO2水溶液、紫色石蕊试液、PH试纸,学生设计实验验证SO2溶于水是化学变化,即验证二氧化硫的水溶液呈酸性。
实验方案:用针筒抽取1mLSO2水溶液分别挤入装有紫色石蕊试液的小试剂瓶中和PH试纸上。(用针筒与小试剂瓶做实验,一方面避免了二氧化硫产生的刺激性气味,另一方面增强了化学实验的趣味性。)
生:得出结论,SO2的水溶液呈酸性。
(SO2的水溶液呈酸性,让学生联想到SO2是酸性氧化物,用所学的相关知识运用到问题解决中,分析二氧化硫作为酸性氧化物所具有的化学性质,培养系统化的关于元素化合物知识体系的构建。)
师:从物质分类角度分析,SO2属于哪类物质,有何化学性质?
生:归纳SO2作为酸性氧化物具有的通性并写出反应方程式:与水反应;与碱性氧化物反应;与碱反应。
环节3:SO2具有还原性的学习
播放视频:葡萄酒中添加SO2是干嘛的?
(贴合主题,介绍SO2在食品中的作用之一抗氧化作用,引出SO2具有还原性的学习。)
师:从元素价态角度分析,为什么SO2有抗氧化作用?
生:利用化学合价图分析SO2的性质,二氧化硫中S元素价态为+4价,S元素可能具有的价态有:-2、0、+6,则二氧化硫中S元素价态既可以升高也可以降低;说明SO2应该既具有还原性又具有氧化性。
教师补充:从化合价角度分析得到,二氧化硫既具有氧化性又具有还原性,SO2具有强的还原性,而氧化性很弱。那还原性物质都能与哪类物质发生化学反应?
学生实验2:如何用实验证明SO2的还原性?
小组讨论,根据提供的药品:SO2水溶液、BaCl2溶液、H2O2溶液、溴水,设计实验方案,记录实验现象以及结论。
生:1.抽取SO2水溶液1mL加入BaCl2溶液中无明显现象;2.抽取SO2水溶液1mL加入H2O2溶液中无现象;3.抽取SO2水溶液1mL加入溴水中黄色褪去。
分析:二氧化硫水溶液使溴水褪色,即发生化学反应:
SO2+Br2+2H2O===H2SO4+2HBr
师:如何利用现有的溶剂证明此反应是生成了硫酸与溴化氢?
教师补充实验1:在加了SO2水溶液的溴水小瓶子中加入BaCl2溶液,有白色沉淀产生,反应后的溶液中有SO42-则说明SO2被Br2氧化成了SO42-。
教师补充实验2:在加了SO2水溶液的H2O2溶液小瓶子中也加入BaCl2溶液,也有白色沉淀生成,说明SO2被H2O2氧化成了SO42-,SO2+H2O2===H2SO4。
(利用反验证的实验方式,建立了结论与证据之间的逻辑关系,锻炼了学生的证据推理能力,并培养严谨求实的科学态度。)
归纳总结:SO2具有较强的还原性,可被多种氧化剂(如O2、Cl2、Br2、I2、HNO3、KMnO4、H2O2等)氧化。
师:给你们提供的是SO2的水溶液而不是SO2,水溶液中还有亚硫酸,这是否会影响?
(引发学生思考,培养学生科学探究精神,并联系到二氧化硫水溶液的学习。)
师:亚硫酸中的硫化合价也为+4价,也具有还原性,而且在酸性条件下,亚硫酸的还原性增强,所以亚硫酸容易被氧化。
教师补充实验3:打开加了SO2水溶液的BaCl2溶液的小玻璃瓶,晃动一下,溶液变浑浊,由于亚硫酸极易被空气中的氧气氧化成硫酸。
师:作为弱酸,亚硫酸不仅容易被氧化,还不稳定易分解,亚硫酸的分解反应可参照碳酸的分解方程式。
生:学生填写学案,总结关于亚硫酸的性质。(用类比的方式,让学生与之前的所学联系,来构建元素化合物学习的认知模型。)
环节4:SO2具有漂白性的学习
师:引出日常摄入的白糖,从白糖中的SO2过渡到接下来的学习内容。(呼应主题,介绍SO2在食品中的作用之漂白剂,引出SO2具有漂白性的学习,并从介绍二氧化硫漂白性的性质运用上,培养学生的食品安全方面的法律法规意识。)
师:介绍白糖的工艺流程,二氧化硫用于脱色,这说明了二氧化硫具有漂白性。
学生实验3:二氧化硫漂白性的探究
将二氧化硫水溶液注入装有品红溶液的小试剂瓶中,品红溶液褪色。
(实验得出二氧化硫具有漂白性,与之前学的具有漂白性的物质新制氯水相联系,由此对比来得出二氧化硫的漂白性是暂时的,利用对比的形式学习,能让学生的印象更深刻,并能更好地理解漂白性原理的差异。)
师:我们之前学的还有一种具有漂白性的物质是谁?还记得新制氯水滴在PH试纸上是什么现象吗?
生:次氯酸具有漂白性,新制氯水滴在PH试纸上,试纸的中间是白的周围显红色。
师:而二氧化硫水溶液滴在PH试纸上只显红色,而且二氧化硫水溶液加入紫色石蕊试液中后,紫色石蕊试液只是变红了,这就是二氧化硫漂白性的特点,它只能使部分有色物质褪色,我们在刚刚的操作上再加一步,我们加热这液体,看看有什么神奇的现象会发生。
教师补充实验4:取学生实验后的溶液倒入试管中,在试管上套上气球,加热试管,品红溶液又恢复红色。
师:这就是二氧化硫漂白性的特点,只能使部分有色物质褪色而且这个漂白性是暂时的,二氧化硫的漂白原理是与有色物质发生化合反应,生成一种无色物质,而且该无色物质不稳定,在光照或加热条件会分解。利用二氧化硫这样的性质,可以用来漂白纸张、草帽,甚至一些不良商家用二氧化硫来漂白一次性筷子。
学生总结:二氧化硫与次氯酸的漂白原理不同,二氧化硫的漂白是暂时性的,而次氯酸的漂白是永久性的,并且SO2不能使指示剂褪色。
(总结高中涉及的三类漂白原理,让学生把前后关于漂白性的知识进行整合,以增强记忆。)
环节5:SO2的知识点总结
最后以价态—类别二维图来进行本节课的知识点总结。
五、总结与反思
(一)以课程标准为基础制定素养目标是构建元素化合物认知模型的前提
课程标准要求中提出结合真实情景中的应用实例或通过实验探究,了解硫及其重要化合物的主要性质,认识二氧化硫在生产中的应用和对生态环境的影响[3]。依据课程标准,结合学业要求与学生的实际情况,本节课主要突出学习二氧化硫的还原性与漂白性,其他性质则一笔带过,由于本节课涉及内容较多导致容量较大,没有多余的时间进行课堂练习。
(二)体验性的实验是构建元素化合物认知模型的基础
核心素养中提出“科学探究与创新意识”,要求能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验进行实验探究。本节课利用针筒与小玻璃瓶作为实验仪器,在无污染,绿色化学的条件下激发了学生的学习兴趣,利用这样的微型实验方式,从实践层面激励了学生勇于创新的实验精神。
(三)多种教学方式是构建元素化合物认知模型的保障
本节课利用多种教学手段来完成教学目标,如用学生感兴趣的食品添加剂来拉近与学生之间的距离,用趣味性的实验操作来引发学生对本节课的学习兴趣,用师生互动性的探究方式培养学生的实验探究能力,充分发挥了教师的主导作用和学生的能动性。

