尿素氮/肌酐比值对于非ST段抬高急性冠脉综合征患者经皮冠状动脉介入治疗后对比剂肾病的预测价值
张昭 王仁学 毛琳霜 凌维维 吴丹 姜子超 刘康 钱赓
(1.中国人民解放军总医院海南医院心血管内科,海南 三亚 572014; 2.中国人民解放军总医院第一医学中心心血管内科,北京 100853)
随着现代医疗技术的发展,心血管疾病的诊断与治疗越来越多地应用放射技术和介入治疗技术,造影剂使用量增加的同时,对比剂肾病(contrast induced nephropathy,CIN)的发病率也在升高。CIN是急性医源性肾损伤的第3位最常见原因[1],增加了院内死亡率、致残率、住院时间和医疗花费,也可增加患者发生慢性肾功能不全、心血管事件和脑卒中等并发症的风险。CIN的病理生理机制及最佳治疗方案尚未完全研究清楚,因此早期识别高危患者,预防CIN的发生十分重要。水化治疗之所以是CIN预防的关键措施,在于充分水化可使患者血容量稳定,有效增加肾脏灌注,增加尿量并有效减少肾实质缺血的发生。低容量状态是CIN的非常重要的危险因素之一[2],尿素氮/肌酐(blood urea nitrogen/creatinine,BUN/Cr)与人体容量平衡有密切的关系,广泛应用于临床以鉴别肾前性和肾实质性疾病,BUN/Cr比值的升高往往提示患者有效血容量不足。目前对BUN/Cr和CIN的相关性研究较少,因此本研究的目的在于分析BUN/Cr与CIN发生的相关性,探讨术前高BUN/Cr水平对于CIN的预测价值,为临床提供参考。
1 资料与方法
1.1 一般资料
连续选取2014年1月—2016年9月于中国人民解放军总医院心血管内科住院行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的患者。纳入标准:急性冠脉综合征患者(包括不稳定性心绞痛及非ST段抬高心肌梗死),心电图有明确缺血证据(胸前或肢体导联ST段压低>0.1 mV,且有动态变化),年龄18~90岁,择期行PCI,术中采取球囊扩张术或冠状动脉支架植入术,术后第一天及第三天常规复查过血肌酐水平。排除标准:急性ST段抬高心肌梗死;造影剂过敏;术前肾功能衰竭(肾小球滤过率<30 mL/min);罹患恶性肿瘤;急慢性感染;血液透析治疗中;近一周内使用过造影剂。本研究经中国人民解放军总医院伦理委员会审议并批准。
1.2 定义及诊断标准
(1)高血压诊断标准:在未使用抗高血压药的情况下,非同日3次测量诊室血压,收缩压≥140 mm Hg(1 mm Hg=0.133 3 kPa)和/或舒张压≥90 mm Hg;既往有高血压史,目前正在使用抗高血压药,血压虽然低于140/90 mm Hg,仍应诊断为高血压;家庭自测血压≥135/85 mm Hg;动态血压:白天平均值≥135/85 mm Hg,夜间平均值≥120/70 mm Hg或24 h平均值≥130/80 mm Hg。(2)糖尿病诊断标准:多饮、多尿和不明原因的体重减轻,且随机静脉血浆葡萄糖≥11.1 mmol/L,随机血糖浓度为餐后任意时间的血糖浓度;空腹静脉血浆葡萄糖≥7.0 mmol/L,空腹禁止摄入热量8 h以上;患者无明显的糖尿病症状,餐后或空腹随机静脉血浆葡萄糖均未达到标准,用75 g无水葡萄糖的水溶液进行口服糖耐量试验后2 h静脉血浆葡萄糖≥11.1 mmol/L。(3)贫血诊断标准:在海平面地区,成年男性血红蛋白<120 g/L,成年女性血红蛋白<110 g/L。(4)CIN诊断标准:使用造影剂后48~72 h内血肌酐上升超过44 μmol/L(0.5 mg/dL)或较基础值上升>25%,并除外其他肾脏损害因素。(5)低血压的定义:收缩压<90 mm Hg至少1 h或需要使用药物升压或主动脉内球囊反搏支持。(6)高BUN/Cr的定义:BUN(mg)=mmol/L×2.8,Cr(mg)=μmol/L÷88.4,换算成统一单位(mg)后,高BUN/Cr定义为BUN/Cr>20,高BUN/Cr提示患者可能存在肾前性功能障碍。
1.3 方法
1.3.1 资料收集
收集所有研究对象的一般资料,包括性别、年龄、身高、体重指数(BMI)和既往病史包括糖尿病史、高血压病史等;以及患者术前的抽血检测结果:血常规、心肌酶、血糖、肝肾功能和血脂水平。收集术前心电图和心脏彩超的基本资料等。冠状动脉造影结果分析:冠状动脉造影结果由2个相互独立的不参与本研究的心脏介入医师完成,在造影过程中造影剂的使用剂量根据术中的具体情况记录。
1.3.2 Mehran评分计算
评分方法为:低血压、行主动脉内球囊反搏和充血性心力衰竭(心衰)各计5分,年龄>75岁计4分,贫血和糖尿病各计3分,每用100 mL造影剂计1分,血清肌酐>133 μmol/L(1.5 mg/dL)计4分或肾小球滤过率估算值(eGFR):40~60 mL/(min·1.73 m2)计2分,20~40 mL/(min·1.73 m2)计4分,<20 mL/(min·1.73 m2)计6分。计算8个变量的总分,根据总分分为低危(≤5分)、中危(6~10分)、高危(11~15分)和极高危(≥16分)[3]。
1.3.3 统计学方法

2 结果
2.1 一般情况基线
所有入组急性冠脉综合征患者一共1 163例,其中男863例,女性300例,最大89岁,最小18岁,平均(61.52±11.46)岁,其中非ST段抬高心肌梗死患者共281例(24.2%),不稳定型心绞痛患者共882例(75.8%)。入组患者中高血压患者773例,糖尿病患者共562例。冠状动脉造影结果发现三支病变患者共355例(30.5%)。根据术后监测的血肌酐结果分析,CIN患者共102例(8.77%)。
2.2 CIN组与非CIN组基本临床资料的比较
两组临床资料比较,年龄、男性、身高、体重、BMI、造影剂使用量、贫血、高血压、糖尿病、术前肌酐以及尿素氮无显著差异,差异无统计学意义(P>0.05)。CIN组与非CIN组相比较,低血压及高脂血症的患者比例明显升高,CIN组心脏射血分数明显下降,心衰患者的比例明显升高(P<0.05),CIN组患者中BUN/Cr>20的比例明显高于非CIN组(50.00% vs 34.68%,P=0.002),结果见表1。

表1 CIN组与非CIN组基本临床资料的比较
2.3 影响冠心病患者PCI术后发生CIN的独立危险因素
将体重、年龄、高脂血症、糖尿病、造影剂使用剂量、高BUN/Cr、贫血、是否存在心衰、低血压和血肌酐>177 μmol/L(2 mg/dL)等纳入多因素回归分析模型。多因素logistic回归分析显示,高BUN/Cr(OR=2.018,95%CI1.241~3.284,P=0.005)是发生CIN的独立危险因素。此外心衰(OR=2.652,95%CI1.548~4.544,P<0.001)、血肌酐>177 μmol/L(OR=3.897,95%CI1.021~14.876,P=0.047)和高脂血症(OR=2.652,95%CI1.572~4.471,P<0.001)也是发生CIN的独立危险因素。结果见表2。
2.4 ROC曲线分析高BUN/Cr对患者CIN发生的预测价值
通过ROC曲线分析Mehran评分预测CIN的曲线下面积(AUC)为0.612(95%CI0.583~0.640,P<0.001),高BUN/Cr替换贫血纳入评分模型预测CIN的AUC为0.635(95%CI0.607~0.663,P<0.001)(图1)。经Z检验,Z=1.455,P=0.145 7,其AUC并无统计学差异(P>0.05),见图1。
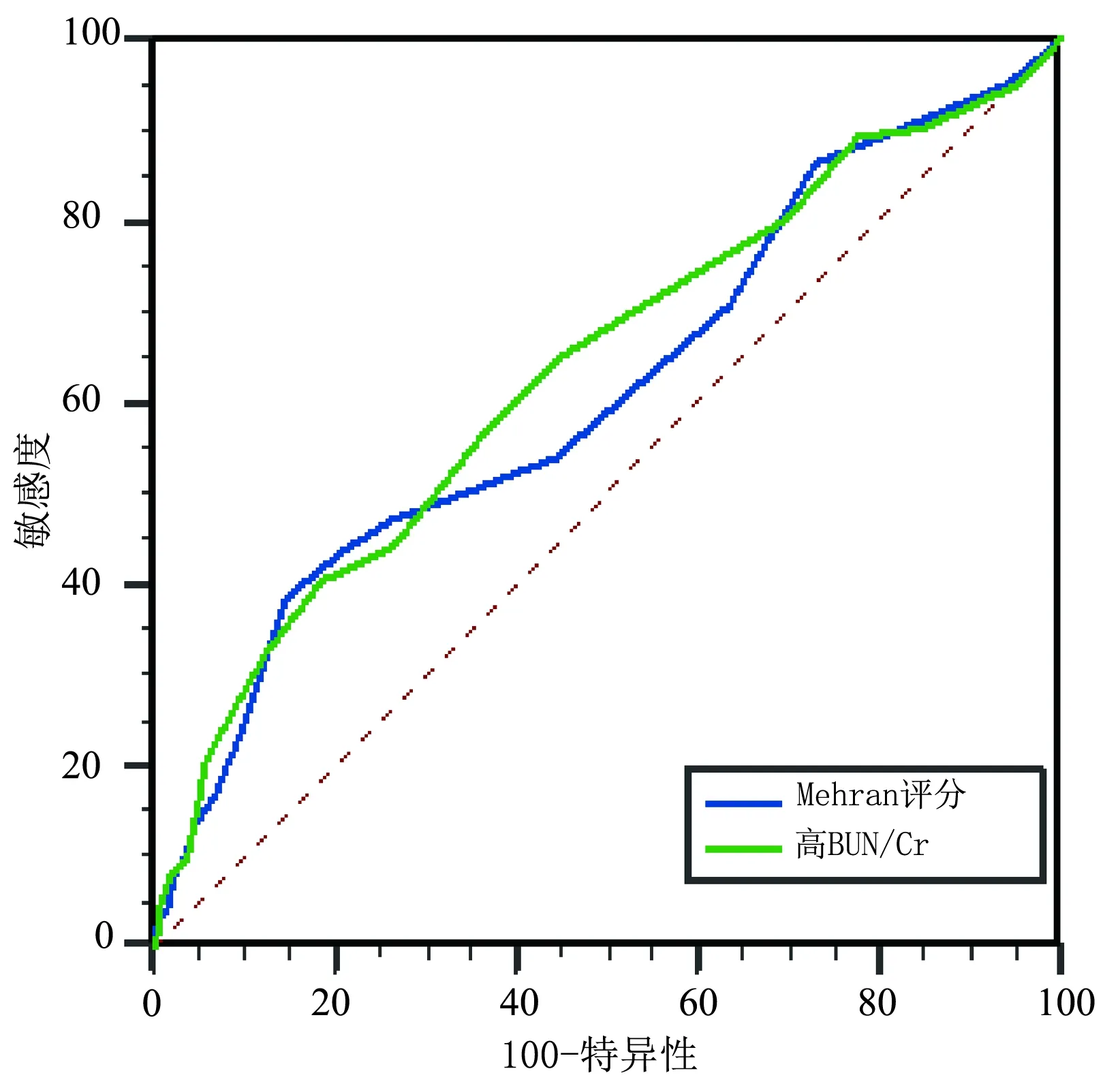
图1 高BUN/Cr和Mehran评分对CIN预测价值的ROC曲线图
3 讨论
CIN是指患者应用造影剂后新发生的、未发现其他原因的急性肾损伤,在造影剂使用后48~72 h内,血肌酐水平上升超过44 μmol/L(0.5 mg/dL)或基础值上升>25%,多数患者血肌酐在2周内逐渐恢复至基线值,少数患者可遗留肾功能损害,需进行血液透析治疗[4]。与CIN有关的最常见的操作是冠状动脉血管造影术和/或血管成形术以及计算机断层扫描[5]。本研究中1 163例患者中有102例发生CIN,发生率为8.77%。CIN的病理生理机制可能是由于造影剂对肾小管的直接毒性作用,肾内血管收缩导致的肾实质缺血以及肾小管梗阻等[6]。目前尚无CIN的完美治疗方案,因此掌握其发生的高危因素,尽早采取预防措施是十分必要的。目前临床上预防CIN的措施有水化疗法,使用N-乙酰半胱氨酸、他汀类药物、低渗及等渗造影剂等[7-8]。

表2 CIN的单因素和多因素回归分析结果
CIN的危险因素分为内源性和外源性,既往研究显示,低血容量是CIN的一个重要的外源性独立危险因素[9],术前容量不足的患者行PCI术后发生CIN的风险明显升高。其可能的机制为:肾脏血流灌注减少,肾素-血管紧张素-醛固酮系统以及交感神经系统被激活,肾血管收缩,造成肾脏进行性缺血,而持续的肾实质缺血会导致氧自由基和活性氧的生成,损伤肾小管上皮细胞[10],上皮细胞坏死脱落形成管型,造成肾小管堵塞,肾小球滤过率下降,造影剂排泄减慢,在肾小管内停留的时间延长,对肾小管细胞的直接毒性作用增强;此外肾血管收缩还会促进平滑肌增生,发生肾间质的纤维化,导致肾功能减退[11]。目前水化疗法是临床上广泛使用的预防措施,经济、高效、易推广、无创指导下的个体化水化预防策略还在探索研究中,通过充分水化扩张容量,纠正血流动力学紊乱,增加肾脏血流灌注,改善肾髓质组织缺血状态,减轻造影剂对肾组织的直接损伤。此外,还可抑制肾素-血管紧张素系统活化,减少抗利尿激素的产生,增加尿量促进造影剂排泄,缩短肾小管上皮细胞暴露于造影剂的时间[12]。针对患者个体情况实行个体化水化预防方案能有效降低CIN发生率,如术前测量左室舒张末压引导水化,中心静脉压指导给药和生物阻抗引导水化等[10]。
贫血、低血压、酸中毒和BUN/Cr≥20等指标可有效地提示机体处于血容量不足的状态,目前已有研究证实贫血和低血压是CIN发生的危险因素[13],但对于BUN/Cr与CIN的相关性研究较少,因此本研究探讨BUN/Cr对CIN的早期预测价值。BUN/Cr已被广泛应用于临床医学,其标本容易获得,检测简单易行,对肾前性和肾实质性疾病有很高的鉴别价值,当血容量不足时,肾小管对尿素的吸收率增加,尿素排泄率下降的程度与肾小球滤过率下降的程度不平行,最终导致BUN/Cr的升高[14]。本研究以BUN/Cr≥20作为节点,将患者分为高BUN/Cr组和对照组,发现高BUN/Cr组发生CIN的比例明显高于对照组,而CIN组患者高BUN/Cr比例明显高于非CIN组;单因素及多因素logistic回归分析显示,高BUN/Cr是PCI术后发生CIN的独立危险因素,其对CIN的预测价值优于传统贫血指标。对术前高BUN/Cr的患者,应针对其可能存在的低容量状态,积极给予水化和其他稳定容量的治疗措施,有效预防CIN的发生。
本研究也发现心衰、高脂血症为CIN的独立危险因素。心脏与肾脏的功能有着紧密的联系,心衰患者心脏输出量减少,肾脏由于灌注不足发生缺血性损伤,同时体循环瘀血也会导致肾静脉瘀血而加重肾损伤[11],在造影剂的协同作用下,进一步发展为CIN。高脂血症是血脂代谢紊乱引起血浆中某一类或某几类脂蛋白水平升高的代谢性疾病。有研究证明高脂血症可引起肾间质损伤[15],高胆固醇血症会导致肾血流动力学改变,其均增加了PCI术后发生CIN的风险。
目前临床上用于评估患者行PCI术后发生CIN风险的有Mehran评分,根据Mehran评分,1 163例患者中CIN低危、中危、高危和极高危分别为752、324、78和9例,发病率在低危、中危、高危和极高危组中分别为6.78%、10.49%、17.95%、和33.33%,发病率随着危险程度的升高而随之升高。将高BUN/Cr替换贫血指标纳入评分系统中时,1 163例患者中CIN低危、中危、高危和极高危分别为626、414、109和14例,发病率在低危、中危、高危和极高危组分别为5.75%、9.42%、20.18%和35.71%,发病率也随着危险程度的升高而随之升高。ROC曲线分析显示,高BUN/Cr代入CIN评分系统后,改良的Mehran评分系统对CIN的预测价值高于原本Mehran评分系统,但考虑到Mehran风险评分是基于大量病例的,所以高BUN/Cr的预测价值还需进一步研究。
本研究的局限性有:(1)研究为单中心回顾性临床研究,因此研究的病例可能存在人群限制,需更大的样本量来检验高BUN/Cr对CIN的预测价值;(2)进行多因素logistic回归分析时仍有可能存在其他混杂因素;(3)本研究只研究了患者住院期间的高BUN/Cr,并未观察该指标是否对患者的远期预后仍有预测价值。
综上所述,本研究结果初步证明高BUN/Cr患者PCI术后发生CIN的风险更高,高BUN/Cr可作为早期识别CIN高危患者的一项指标。

