PGC-1α在肺癌中的研究进展
金铭 陈金亮 张冬梅 陈建荣南通大学第二附属医院呼吸与危重症医学科 600;南通大学第二附属医院临床实验中心 600
肺癌是世界上发病率和病死率最高的恶性肿瘤,是一个重大的公共卫生问题,每年有新病例120万和死亡病例159万。在组织学上,可以区分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC是最常见的肺癌恶性形式,占全世界肺癌病例的80%~90%[1]。尽管肺癌在早期发现和标准治疗方面取得了进展,但由于发现晚、转移早,大约10%的肺癌患者在确诊后能有5年的生存率,其仍是世界上癌症相关死亡的首要原因[2]。基于肿瘤中存在的基因改变,新的靶向治疗开始出现,研究重点逐步放到肿瘤细胞代谢的关键途径上。近年来,过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptorγcoactivator 1α,PGC-1α)在肺癌中的研究越来越广泛。研究显示,PGC-1α与肺癌密切相关,在肺癌细胞的增殖、迁移、凋亡及化学耐药中均发挥调节作用,研究PGC-1α在肺癌中的作用将有助于寻找新的治疗靶点。
1 PGC-1α的基本特性
PGC-1α基因位于人类4号染色体上,含有798个氨基酸残基,并能与核受体过氧化物酶体增殖激活受体γ(peroxisome proliferators-activated receptorγ,PPARγ)共同作用的蛋白质分子[2]。PGC-1α的N-末端通过几个LXXLL基序与多种转录因子相互作用,而PGC-1α的C-末端则与TRAP/DIP/Mediator复合物相互作用。此外,PGC-1α还具有一个富含丝氨酸/精氨酸的结构域和RNA结合基序,在m RNA剪接中发挥重要作用[3]。
PGC-1α是多种核受体和转录因子的共激活因子,主要在氧化组织中高度表达,如棕色脂肪组织、心脏、肝脏、肾脏、骨骼肌和中枢神经系统等[4]。PGC-1α在棕色脂肪组织中诱导适应性产热,在肝脏中诱导糖异生,在肌肉中诱导纤维类型转换,在心脏中诱导脂肪酸氧化[5]。PGC-1α的表达和活性受多种转录因子调控,以维持其在不同代谢需求下的时间和组织特异性功能。PGC-1α蛋白通过与核受体PPARγ、细胞核呼吸因子1(nuclear respiratory factor 1,NRF-1)、细胞核呼吸因子2(nuclear respiratory factor 2,NRF-2)、糖皮质激素受体、甲状腺激素受体、雌激素相关受体α(estrogen related receptorα,ERRα)及血管内皮生长因子等多种转录因子共同作用调节靶基因的表达,以发挥其生物学效应(图1)[6]。PPARγ以其在脂肪生成,产热和有丝分裂发生中的作用而闻名,而NRF-1、NRF-2和ERRα对于线粒体的生成、抗氧化防御和对代谢应激的快速反应具有重要意义。此外,PGC-1α的活性受磷酸化、去乙酰化、乙酰化、甲基化和泛素化等多种翻译后修饰的调节[7],这些修饰是影响PGC-1α转录活性和稳定性的主要因素。例如,AMP活化蛋白激酶AMPK和P38等应激感受器可以促进PGC-1α活性,而AKT磷酸化则抑制其活性[8-9];沉默信息调节因子2同源物1(silent information regulator 2 homolog 1,SIRT1)通过赖氨酸残基和赖氨酸乙酰转移酶乙酰化激活PGC-1α,并使PGC-1α失活;蛋白精氨酸甲基转移酶1将C末端的精氨酸残基甲基化后可使PGC-1α激活[10]。
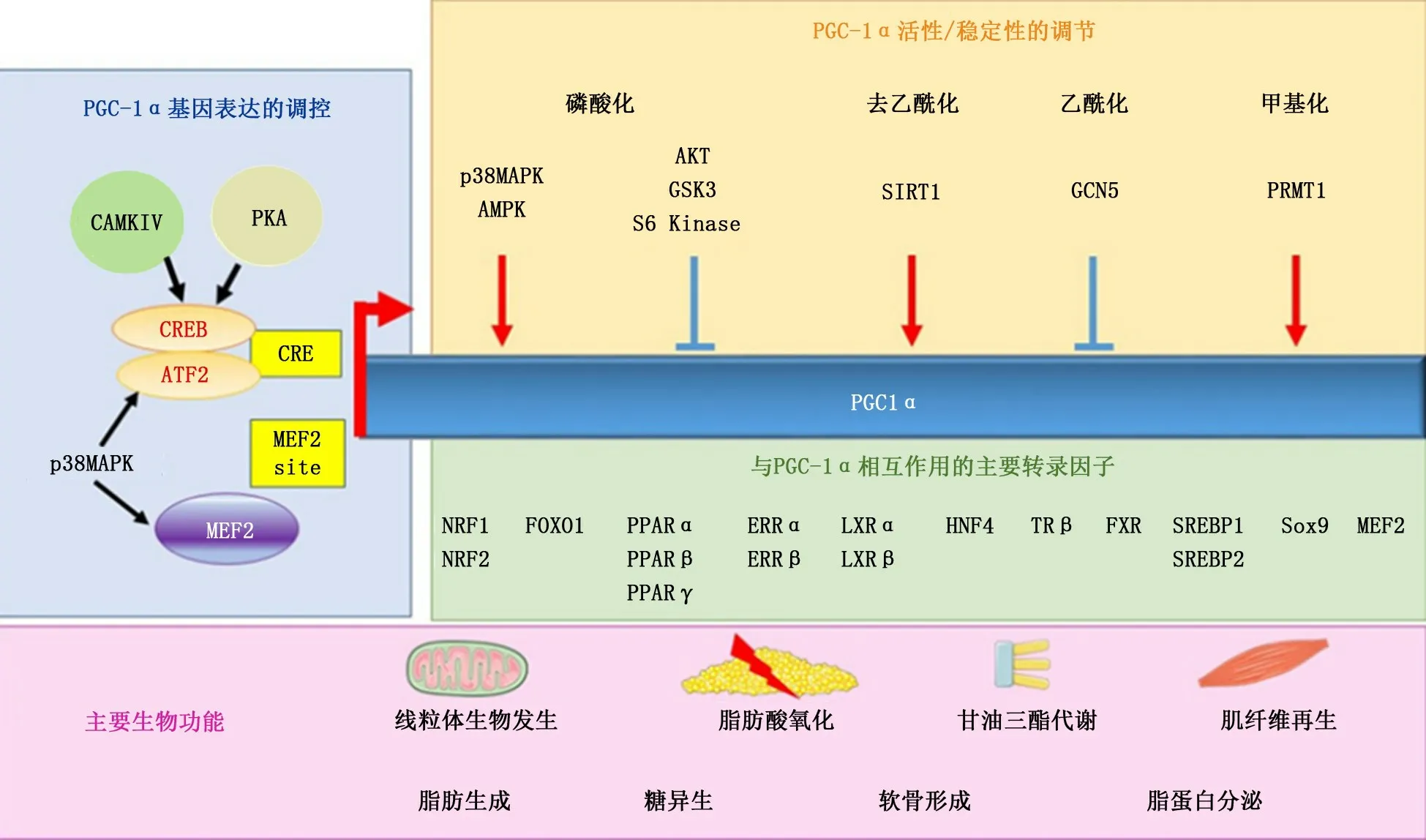
图1 PGC-1α的调控机制[6]
2 PGC-1α与肿瘤
PGC-1α是线粒体生物发生和能量代谢的主要调控因子,包括对氧化磷酸化、脂肪酸的合成、脂质代谢和活性氧(reactive oxygen species,ROS)水平的调节[11]。众所周知,PGC-1α与糖尿病、肥胖、肌肉、肝脏脂肪变性、神经退行性变和心血管疾病等密切相关,其可在细胞处于恶劣条件下维持代谢的平衡,在预防慢性疾病方面发挥着保护作用[12]。除了参与机体多种生理和病理的进程外,PGC-1α还可以通过多种途径参与调节肿瘤发生发展的进程。首先,PGC-1α共同促进抗氧化基因的表达,保护癌细胞免受作为电子传递链的ROS的影响[13]。其次,PGC-1α能够调节血管内皮生长因子的表达[14]。另外其在促进葡萄糖和脂肪酸分解代谢的同时,还能促进糖异和脂肪生成,是癌症发生的重要参与因素[15]。
最初,PGC-1α被认为是一种通过促进线粒体氧化和有氧糖酵解发挥作用的潜在抑癌因子,但随着研究的深入,越来越多的证据表明PGC-1α还可作为促癌因子。例如,研究人员通过PGC-1α敲除实验观察到细胞生长受到抑制,PGC-1α通过激活前列腺癌细胞中的雄激素受体,从而改变癌细胞的代谢,导致线粒体生物合成增加以及葡萄糖和脂肪酸氧化,促进癌细胞生长[16]。此外,在砷诱导的皮肤癌患者的肿瘤样本中PGC-1α表达增加,这可能与促进癌细胞增殖和增强线粒体生物生成有关[17]。Bhala等[18]研究表明,PGC-1α通过诱导脂肪生成酶(乙酰辅酶A羧化酶和脂肪酸合成酶)在转基因PGC-1α小鼠中促进癌症发生和肿瘤生长,PGC-1α基因敲除小鼠可降低化学诱导的肝癌和结肠癌的发生,提示PGC-1α可能刺激肿瘤的发生。PGC-1α是肿瘤发生过程中的新兴蛋白,其在肿瘤中的作用仍存在争议。
3 PGC-1α与肺癌
肺癌是全球癌症相关死亡的最主要原因,其病死率为所有恶性肿瘤的最高者。多项研究报道,肺癌是由细胞增殖和程序性细胞死亡之间的失衡引发的,这两者都依赖于能量代谢的适当调节,这种依赖性导致了线粒体功能障碍与癌症相关的分子机制之间具有一定联系。例如ROS的高生成、葡萄糖代谢的改变和肺癌细胞凋亡功能的改变等,以上因素都与PGC-1α的功能有关。在肺癌中,PGC-1α的表达和活性增加与肺癌细胞的代谢密切相关,可以促进肿瘤细胞的生长、侵袭、远端扩散和化疗耐药,PGC-1α在肺癌中起着至关重要的作用。
3.1 PGC-1α介导肺癌的增殖和迁移 癌细胞可以通过PGC-1α增强氧化磷酸化、线粒体生物合成和耗氧速率,促进线粒体呼吸以增加ATP的产生,为癌细胞提供快速增殖的能 量 需 求[19]。Han等[20]证 实 了PPARβ/σ可 以 上 调PGC-1α的表达,进一步研究发现,PGC-1α使肿瘤抑制因子AMPK失活,同时刺激PI3K/AKT诱导NSCLC的增殖和生存反应。Taguchi等[21]研究发现野生型P53肺癌中的PGC-1α的表达水平显著高于突变型P53肺癌,在H1944肺腺癌细胞中,通过PGC-1α敲除实验观察到肺癌细胞的增殖受到抑制,提示PGC-1α可能成为P53野生型肺癌的潜在治疗靶点。突变型P53蛋白通常具有促肿瘤功能,可以与促肿瘤转录因子结合并增强其活性,提高肿瘤细胞的存活率和迁移能力[22]。Basu等[23]研究发现,在肺癌细胞中使用siRNA敲低PGC-1α后,癌细胞的增殖受到了抑制,并通过Boyden小室进行侵袭实验,结果显示肺癌细胞的侵袭能力受到抑制,证实了突变型P53通过结合和调节PGC-1α的能力来促进肺癌细胞的迁移和转移。
众所周知,转化生长因子-β(transcriptional growth factorβ,TGF-β)是一种多效性生长因子,与细胞的增殖、衰老、凋亡和分化等过程密切相关,其在肿瘤细胞的侵袭和迁移中发挥着关键作用[24],Sohn等[25]研究发现,在肺癌细胞中,TGF-β可诱导降低肿瘤细胞PGC-1α及其靶基因的表达,如转录因子NRF-2、ERR-α和PPAR-γ等调节线粒体生物发生。研究报道,上皮-间质转化(epithelial mesenchymal transition,EMT)是通过延长基于微管的突起和抑制细胞增殖来促进肿瘤细胞向间质基质的浸润,越来越多的证据表明EMT在肿瘤的进展、伤口愈合、侵袭和组织纤维化以及胚胎的发生中具有重要作用,而PGC-1α是EMT发挥作用的关键调节因素[26]。PGC-1α可以通过EMT在NSCLC中发挥关键作用。张佳欣[27]研究发现,在肺癌细胞中,TGF-β1通过下调SIRT 1及PGC-lα的表达使线粒体合成受阻,线粒体功能障碍,从而促进EMT的发生,导致肿瘤细胞进一步发生迁移。
3.2 PGC-1α与肺癌细胞的凋亡 线粒体在能量的动态平衡中起核心作用,是细胞死亡级联反应的控制点,PGC-1α作为线粒体功能的关键调节因子在细胞生存中发挥重要作用,其可通过多种机制防止细胞凋亡[28]。研究发现,ROS的产生可以通过诱导抗氧化酶的机制介导细胞的凋亡或对治疗产生抵抗力,而PGC-1α可以通过诱导超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的表达参与ROS的解毒,PGC-1α诱导这些抗氧化酶的能力对于保护ROS诱导的细胞损伤和细胞死亡密切相关[29]。众所周知,肿瘤抑制因子P53通过诱导DNA修复、细胞周期调节、氧化应激反应和丝裂原活化蛋白激酶信号相关基因的表达,从而激活抗凋亡通路[30]。近期研究发现,PGC-1α在调节P53介导的肺癌细胞的凋亡中起关键作用。在代谢应激条件下,PGC-1α能够与P53形成复合物共同激活细胞周期抑制因子的转录,同时促进线粒体生物合成相关基因的表达。此外,在PGC-1α敲除的细胞中氧化应激会导致P53诱导的凋亡产生,该反应通过促进P53的前期抑制和代谢靶的优先反式激活来增强P53的细胞周期阻滞和代谢功能[31]。另一方面,PGC-1α表达的增加可以通过维持氧化磷酸化和糖酵解之间的平衡来防止P53诱导的细胞凋亡[32]。
研究发现,SIRT1/PGC-1α/NRF-2信号转导通路与细胞的氧化和炎症应激有关,在肺癌细胞中,下调SIRT1/PGC-1α/NRF-2轴可以诱导CHOP和DR5的表达,进而增强癌细胞对TRAIL诱导的肿瘤细胞的凋亡。细胞色素C氧化酶(cytochrome coxidase,COX)是线粒体呼吸链中的一种复合体,COX7A1为其中一种亚型,据报道,Mishra等[33]发现COX7A1基因在肺癌患者中的表达高度下调,与非小细胞肺癌之间存在密切联系。Zhao等[34]进一步的结果表明,COX7A1过表达可通过下调PGC-1α和上调NOX2来阻断自噬通量,抑制NSCLC细胞的增殖和集落形成能力,以促进癌细胞凋亡。
3.3 PGC-1α与肺癌的化学耐药 线粒体功能障碍与肿瘤的发生发展有关,包括干扰癌细胞能量代谢、活性氧的产生以及诱导细胞应激反应等。多项研究报道,在肺癌、肝癌、卵巢癌等癌细胞中,发现线粒体功能障碍与化疗药物的抗药性有关,PGC-1α通过与特定的核转录因子(NRF-1、NRF-2和ERRα)相互作用进而影响线粒体呼吸、活性氧防御系统和脂肪酸代谢来对抗癌细胞死亡[35]。PGC-1α在营养剥夺、氧化损伤和化疗的刺激下被激活,促进了肿瘤细胞的生物合成,并诱导了癌细胞对化疗药物的耐药性。紫杉醇作为一线化疗药物之一被广泛用于非小细胞肺癌、乳腺癌和卵巢癌等肿瘤的治疗。已知紫杉醇耐药的分子机制与多药耐药蛋白的过度表达、β-微管蛋白亚型的改变和凋亡途径的调控等密切相关[36]。在最新的研究中,Zhou等[37]研究结果显示PGC-1α在紫杉醇耐药肺癌细胞中的表达显著上调,同时,NRF-1、NRF-2、ERRα和PPARα均上调,在肺癌细胞中PGC-1α及其下游基因的表达随着紫杉醇慢性毒性的增加而增加,在这种情况下,线粒体生物发生途径受到刺激,以损害和维持紫杉醇耐药癌细胞中的线粒体。由上可知,PGC-1α与特定的核转录因子结合对线粒体融合、分裂和生物学功能产生影响,而这些变化可以导致肿瘤细胞发生紫杉醇耐药。
Cruz-Bermúdez等[38]研究发现,通过转染siRNA敲低PGC-1α或使用氧化磷酸化抑制剂(二甲双胍和鱼藤酮)降低PGC-1α的表达,可使顺铂的作用增强。而增加PGC-1α的表达水平,肺癌细胞的顺铂敏感性降低,可以减少CDDP诱导的凋亡反应,PGC-1α的表达、癌细胞内线粒体质量与顺铂诱导的肺癌细胞凋亡有关。线粒体质量的增加和氧化磷酸化功能增加是肺癌对顺铂治疗耐药的复发机制,重要的是,顺铂耐药的NSCLC细胞可以通过抑制PGC-1α或线粒体抑制剂进行靶向治疗。此外,有趣的是,Hirpara等[39]研究发现,NSCLC细胞对吉非替尼的耐药性与PGC-1α与TFAM表达上调、超复合体Ⅰ和Ⅱ的形成、耗氧速率以及线粒体质量的增加有关。值得注意的是,某些耐药癌细胞对PGC-1α相关的代谢活动具有依赖性,抑制PGC-1α的表达可以使这些细胞对治疗重新敏感,改善肺癌患者的预后,这意味着PGC-1α在肺癌的分子分类和治疗中可以作为一个有希望的靶点。
3.4 PGC-1α与肺癌的代谢重编程 新陈代谢的失调是癌细胞的重要标志。在肿瘤发生的过程中,癌细胞的能量代谢发生变化,即使在氧气存在的情况下,癌细胞也会通过糖酵解快速氧化葡萄糖以产生所需的ATP,从而损害氧化磷酸化,这种从线粒体代谢到糖酵解代谢的代谢转换,即所谓的Warburg效应[40]。在营养耗竭或压力大的微环境中为癌细胞提供了生长和存活的能力,这种代谢变化称为代谢重编程。为了适应缺氧、营养匮乏、ROS增加或p H改变,三羧酸循环和线粒体呼吸相协调,这些代谢适应对凋亡具有抵抗力,是维持细胞快速增殖、迁移和侵袭所必需的[14,41]。PGC-1α作为细胞代谢的主要调节因子,在肿瘤的代谢重编程中发挥重要作用。研究表明,当肿瘤中的营养和氧气供应发生变化时,癌细胞依赖糖酵解或氧化磷酸化,这些变异将改变癌细胞的能量状态。近年研究报道,PGC-1α不仅可作为共激活因子发挥作用,其自身也受癌基因和转录因子的调控,PGC-1α和这些转录因子可以形成信号 轴。例 如,PML/PGC-1α/PPARα、MITF/PGC-1α和PGC-1α/ERRα,它们在调节特定癌症类型的代谢适应方面发挥重要作用[5]。在肿瘤细胞中,PGC-1α与其相互作用的信号通路(AMPK、MTORC1)、转录因子(HIF-1α)以及蛋白质的表达(葡萄糖转运体)受到干扰,以调节新陈代谢,改变了癌细胞的能量状态[6]。
受体相互作用蛋白1(receptor-interacting protein 1,RIP1)是一种丝氨酸/苏氨酸激酶,具有细胞增殖、存活和死亡的功能。Chen等[32]研究发现,RIP1/PGC-1α的信号转导通路在维持肺癌细胞的代谢稳态中发挥着重要作用,RIP1的丢失会导致PGC-1α表达下调,损害线粒体氧化磷酸化,使糖酵解加速。然而,过度的糖酵解降低了细胞的NAD+的表达水平,导致自发性DNA损伤和P53介导的癌细胞增殖受到抑制。因此,RIP1维持的糖酵解对肺癌细胞能量的稳态和DNA完整性至关重要,干预RIP1介导的糖酵解途径可用于肺癌的治疗。Cruz等[38]研究发现,不同侵袭性的肺癌细胞株可表现出不同的代谢水平,在肺癌细胞中,PGC-1α的表达水平与GAPDH/MT-CO1比值呈负相关,研究证实了肺癌细胞糖代谢的途径发生了改变,除此之外,还发现依赖氧化磷酸化的肺癌细胞对新陈代谢靶向药物更加敏感。因此PGC-1α可以用来预测肺癌患者对糖代谢靶向治疗的反应。
4 展望
PGC-1α是线粒体生物发生和能量消耗的主要调节因子,PGC-1α作为一种核受体和其他转录因子的共激活因子,其在适应性代谢反应中发挥核心作用。此篇综述主要从参与肺癌的增殖迁移、细胞凋亡、化学耐药及代谢重编程等四个机制方面介绍了PGC-1α。肺癌是全球癌症相关死亡的最高者,且与PGC-1α的关系十分密切,PGC-1α可能具有作为潜在的肺癌早期诊断、治疗、转移和预后标志物的重要作用。但是PGC-1α在肺癌中的调控作用及影响肿瘤细胞的生长、迁移、侵袭的分子机制仍不明确,对于PGC-1α的研究有助于进一步阐明肺癌的发生发展机制,并可能为肺癌的诊断及治疗方法提供新的靶点。
利益冲突所有作者均声明不存在利益冲突

