急性前壁心肌梗死伴慢性肾脏病患者急诊经皮冠状动脉介入术中完全血运重建一例报道
刘东升,刘娜,李彬
多支血管病变(multi-vessel disease,MVD)是目前急性心肌梗死患者诊疗中常见的问题,有研究表明其发生率高达30%~50%[1]。而目前对非梗死相关血管(non-infarct related artery,non-IRA)的处理策略尚无统一意见,其大致分为3种[2]:(1)本次住院仅处理梗死相关血管(infarct related artery,IRA),即仅罪犯血管血运重建(culprit-only revascularization,COR);(2)急诊经皮冠状动脉介入术(percutaneous coronary intervention,PCI)仅处理IRA,择期处理non-IRA,即分步血运重建(staged revascularization,SR);(3)急诊PCI同时处理IRA和non-IRA,即完全血运重建(complete revascularization,CR)。对于伴有MVD的急性心肌梗死患者采用何种手术策略才能使其获益最大?目前指南中尚无明确的要求,尤其是当患者合并肾功能不全等其他与手术操作相矛盾的疾病时,该问题更值得探讨。笔者报道1例急性前壁心肌梗死伴慢性肾脏病患者的诊疗经过,以期为该类患者的临床诊治提供依据。
本文主要内容:
急性心肌梗死合并多支血管病变是临床常见的问题,急诊手术策略的选择尤为重要。目前,仅罪犯血管血运重建与分步血运重建是常见的手术策略,但在特殊情况下完全血运重建策略也是可以采用的,如术中患者病情稳定,非罪犯血管供血面积大且病变严重,近期二次心肌梗死的风险高,且非罪犯血管处理过程简单等;但当患者同时合并肾功能不全时,多支血管经皮冠状动脉介入术(PCI)增加了造影剂用量,成为选择完全血运重建策略的不利因素。本文报告了1例急性前壁心肌梗死伴慢性肾脏病患者,旨在探讨在患者同时存在多种疾病时如何选择手术策略才能增加其获益。
1 病例简介
患者,男,55岁,主因“胸痛6 h”于2019-03-23就诊于沧州市人民医院。患者于入院前6 h活动后出现胸痛,位于心前区,放射至左上肢,伴大汗、恶心、呕吐,症状持续不缓解,就诊于当地医院,诊断为急性心肌梗死,给予阿司匹林肠溶片及硫酸氢氯吡格雷各300 mg口服后转诊至本院。既往高血压病史10余年,最高血压达200/110 mm Hg(1 mm Hg=0.133 kPa),口服硝苯地平缓释片Ⅱ,自诉血压控制在150/90 mm Hg左右;慢性肾炎病史20年;吸烟史30年,平均吸烟20支/d;饮酒史20年,平均饮酒50 g/d。查体:血压125/70 mm Hg,心率62次/min,呼吸频率18次/min,心肺无明显阳性体征。心电图示:窦性心律,心率62次/min,V2~V5导联ST段轻度抬高,见图1A。入院即刻床旁快速检验结果示:肌红蛋白(myoglobin,MYO)>500.0 μg/L(参考范围0~100.0 μg/L),肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)13.05 μg/L(参考范围 0~5.00 μg/L),肌钙蛋白 I(troponin I,TnI)0.26 μg/L(参考范围 0~0.50 μg/L),D-二聚体(D-dimer,D-D)888.52 μg/L(参考范围0~500.00 μg/L)。心脏超声检查示:左心室前壁室壁运动及收缩幅度减低,因床旁超声的局限性导致未估测出左心室射血分数。初步诊断:冠状动脉粥样硬化性心脏病,急性前壁心肌梗死,Killip分级I级,高血压3级(极高危),慢性肾炎。
入院后即刻完善准备行急诊冠状动脉造影,显示右优势型冠状动脉,前降支自中段第一对角支发出后100%闭塞,见图2A;中间动脉近段局限性狭窄50%,右冠状动脉较粗大,第二转折稍远处局限性狭窄95%,见图2B。立即开通罪犯血管,经右侧桡动脉入路,使用6F EBU3.5指引导管将BMW导丝顺利通过闭塞段,常规预扩张后植入3 mm×18 mm支架一枚,并给予后扩张,即刻效果理想,见图2C。此时患者一般状况良好,生命体征平稳,无任何不适症状,考虑手术操作简单,右冠状动脉血管粗大且病变重,故一并处理,保留导丝并更换6 F JR4指引导管,仍使用BMW导丝并常规预扩张,顺利植入4 mm×14 mm支架一枚,并给予后扩张,即刻效果理想,见图2D;处理右冠状动脉共使用3 min,造影剂10 ml,顺利结束手术,术后给予水化治疗及强化抗栓治疗。术后即刻实验室检查结果示:MYO 157.8 μg/L,肌酸激酶(creatine kinase,CK)717 U/L(参考范围50~310 U/L),CK-MB 67.00 U/L(参考范围0~25.00 U/L),超敏肌钙蛋白I(high sensitivity troponin I,hs-TnI)9 390.0 ng/L(参考范围 0~34.2 ng/L),血肌酐(serum creatinine,Scr)129.0 μmol/L(参考范围62.0~106.0 μmol/L),血尿素氮(blood urea nitrogen,BUN)6.90 mmol/L(参考范围3.10~8.00 mmol/L),血尿酸(serum uric acid,SUA)354.8 μmol/L(参考范围208.0~428.0 μmol/L),胱抑素C(Cystatin C,Cys C)1.10 mg/L(参考范围0.59~1.03 mg/L)。入院12 h后实验室检查结果示:MYO 267.9 μg/L,CK 2 511 U/L,CK-MB 218.00 U/L,hs-TnI>50 000 ng/L(注:术前与术后的实验室检查标准不同)。术后心电图可见V2~V5导联病理性Q波形成,T波倒置,见图1B。入院36 h后复查肾功能示:Scr 168.0 μmol/L,BUN 7.27 mmol/L,SUA 342.0 μmol/L。鉴于患者肾功能有恶化趋势,请肾内科会诊后进一步检查示:Scr 161.5 μmol/L,BUN 7.10 mmol/L,SUA 360.0 μmol/L,补体C3 1.5 g/L(参考范围0.8~1.6 g/L),补体C4 0.37 g/L(参考范围0.15~0.45 g/L),免疫球蛋白A(immunoglobulin A,IgA)2.045 g/L(参考范围0.700~3.300 g/L),免疫球蛋白M(immunoglobulin M,IgM)0.451 g/L(参考范围0.500~2.200 g/L),免疫球蛋白G(immunoglobulin G,IgG)7.271 g/L(参考范围6.000~16.000 g/L),24 h尿蛋白7.58 g(参考范围0~0.15 g),24 h尿量3 400 ml。会诊后考虑为慢性肾小球肾炎,慢性肾脏病,计算其估算肾小球滤过率(estimated glomerular filtration rate,eGFR)为 53.326 ml•min-1•(1.73 m2)-1,属于慢性肾脏病3期,建议避免肾毒性药物,未予以特殊处理。此后患者肾功能未进一步恶化,术后恢复良好,于2019-04-01顺利出院。
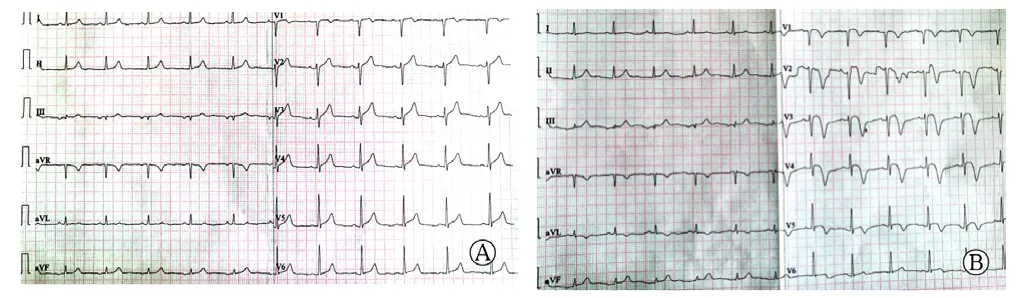
图1 患者PCI前与PCI后心电图Figure 1 ECG before and after PCI of patient

图2 患者冠状动脉造影及PCI图像Figure 2 Coronary angiography and PCI image of patient
1周后患者再次出现胸闷,于当地医院查血钾为7.10 mmol/L(参考范围3.50~5.50 mmol/L),于2019-04-08以“慢性肾衰竭,冠心病,高钾血症”收入沧州市人民医院肾内科。入院实验室检查示:Scr 230.7 μmol/L,BUN 19.15 mmol/L,SUA 536.0 μmol/L,血钾4.77 mmol/L,血磷1.87 mmol/L(参考范围0.85~1.51 mmol/L),血镁1.06 mmol/L(参考范围0.75~1.02 mmol/L),24 h尿蛋白2.30 g,24 h尿量1 900 ml。诊断为慢性肾脏病3期,肾病综合征,冠状动脉粥样硬化性心脏病,经皮冠状动脉介入术(percutaneous coronary intervention,PCI)后,高血压3级(极高危)。给予保肾排毒、抗血小板、稳定斑块等药物治疗,2019-04-11患者自动出院。4周后门诊复查示:Scr 155.8 μmol/L,BUN 7.10 mmol/L,SUA 346.2 μmol/L,血钾4.82 mmol/L,血磷1.26 mmol/L,血镁1.38 mmol/L。各项指标均明显好转,现继续随访中。
2 讨论
在急性心肌梗死患者中,MVD的发生率很高,相应的手术策略主要分为COR、SR及CR三类。为确定以上3种策略的优劣,各国学者进行了大量的临床试验,所得结论也各不相同。其中早期的指南明确指出,对于合并MVD的ST段抬高型心肌梗死(ST-elevation myocardial infarction,STEMI)患者,除非并发心源性休克或持续的缺血症状,否则建议仅处理IRA[3-4]。然而,随着以PRAMI研究[5]为代表的一大批试验结果的公布,CR处理策略的优势体现出来,其主要不良心血管事件(major adverse cardiovascular events,MACE)的发生率明显低于COR组,另外,在相似的研究结果中,无论是12个月死亡率、再发心肌梗死发生率、心力衰竭发生率还是缺血驱动的血运重建发生率均明显低于COR组[6-7]。这一研究结果也促成了指南的修改,2015年美国STEMI指南[8]提出对于合并MVD的STEMI患者,在血流动力学稳定的情况下,可考虑同期或择期处理non-IRA,2017年欧洲心脏病学会(European Society of Cardiology,ESC)在STEMI管理指南[9]中提出对于STEMI患者,推荐在出院前对non-IRA行常规血运重建。
然而CR处理策略也存在一定的问题,同期干预non-IRA将不可避免地延长手术时间,增加造影剂用量及延长射线暴露时间,同时急性心肌梗死急性期血管炎性反应较重,可能影响临床医师对non-IRA病变程度的准确判断,也有报道显示该策略可能增加急性、亚急性血栓形成的风险[10-11]。其中增加造影剂用量带来的造影剂肾病(contrast-induced nephropathy,CIN)风险是本文患者面临的主要问题。造影剂诱导的急性肾损伤(contrast induced acute kidney injury,CIAKI)是指造影剂暴露48 h内Scr较基础值增加26.5 μmol/L或升高至基线值的1.5倍以上[12],本文患者术后36 h Scr较入院时即增加39.0 μmol/L,符合CI-AKI的定义。临床上引起CIN的危险因素较多,包括年龄>70岁、慢性肾脏病患者的eGFR降低、不明原因的肾衰竭、较差的心功能(Killip分级Ⅲ级~Ⅳ级)、心肌梗死后、糖尿病、低血容量、贫血及使用造影剂等[13-15]。对于本文患者来说,基础肾脏病是其肾功能恶化的主要原因,欧洲泌尿生殖影像协会(European Society of Urogenital Radiation,ESUR)下属的对比剂安全委员会在 CIN 指南[16]中提出了 eGFR 45 ml•min-1•(1.73 m2)-1是静脉内注射造影剂诱发CIN的阈值,而本文患者的eGFR为 53.326 ml•min-1•(1.73 m2)-1,属于慢性肾脏病 3 期,说明其基础肾功能不良是诱发CIN的重要原因,只是鉴于患者入院时急性心肌梗死的状态,开通其闭塞的血管为首要完成的任务,短时间内无法对肾功能进行详细评价。此外,心肌梗死后状态及造影剂用量是患者发生CIN的次要因素,术中一并处理non-IRA势必增加造影剂用量,可能对术后肾功能恶化起到一定的促进作用。
总之,目前对于急性前壁心肌梗死患者急诊PCI中MVD的治疗策略选择尚无统一可遵循的标准,需要针对患者的具体情况制定个体化的治疗方案。对于本文患者,术者选择CR策略的依据有:(1)患者术中血流动力学稳定;(2)右冠状动脉虽为non-IRA,但血管粗大、狭窄严重、病变不稳定,短期内有再发心肌梗死的可能;(3)右冠状动脉病变简单,处理过程中所需时间、造影剂用量及射线曝光量较少;(4)之前IRA的处理过程顺利。然而,不适宜选择CR的因素为该患者同时患有慢性肾脏病,因为急诊PCI前无法充分、细致地评估其肾功能情况,故对该问题有所忽略。总之,CR策略对于缩短患者住院时间、降低手术费用、预防二次心肌梗死风险及多次血管穿刺并发症等方面均是有益的,但该策略是否是造成患者术后肾功能恶化的主要原因则有待商榷。因此,在急诊PCI中,对于MVD及其他伴随疾病的患者,要充分权衡利弊,谨慎选择,为患者制定最佳治疗策略。
作者贡献:刘东升负责资料收集与整理,撰写论文并对文章整体负责,进行质量控制及审校;刘娜、李彬负责文献收集及整理。
本文无利益冲突。

