空气中过氧化钠制备反应现象及实验条件的探究
叶永谦 叶燕珠 张贤金 严业安
摘要:针对钠在空气中加热制备过氧化钠实验中出现的若干现象的不同解释,以及对氧气浓度、反应温度等实验条件控制存在明显分歧的问题,通过质疑、实验方案设计及探究,发现提高氧气浓度、持续加热有利于过氧化钠淡黄色固体的生成;钠块置于铝箔上隔着石棉网加热,可制得淡黄色过氧化钠固体,并可有效防止熔融过氧化钠的腐蚀作用。基于实验,推断钠在石棉网上加热后出现的黑色固体可能与纤维素的不完全燃烧以及熔融过氧化钠的腐蚀作用有关。
关键词:钠; 过氧化钠; 实验条件; 反应现象; 实验探究
文章编号:1005-6629(2021)08-0094-04
中图分类号:G633.8
文献标识码:B
1 问题的提出
钠在空气中加热制备淡黄色过氧化钠固体是研究钠的重要性质的实验,由于实验过程中存在较多异常现象,对该实验条件的深入研究具有重要启示作用[1]。刘怀乐老师认为,把反应中出现的异常现象归结为煤油没擦干净、空气中有二氧化碳、温度不够高、氧气不足等原因是不正确的,实验中只要在钠燃烧一开始就限制空气的进入量、进而限制反应温度过度上升即可制备出淡黄色的过氧化钠[2]。江智勇等老师认为,反应过程中产生的黑色物质与煤油有关[3]。吴先强老师认为,温度是决定该反应产物成分的重要影响因素,要想得到较多的过氧化钠,反应过程中必须迅速升温[4]。本文以制备过氧化钠淡黄色固体为方向,对以上存在明显分歧的现象解释和反应条件进行探究,目的在于为该反应在中学课堂的演示寻找更加优化的实验条件。
2 对若干现象的质疑与探究
传统教材中,钠在空气中燃烧实验一般是放在石棉网上加热进行,即便是2020年7月出版的苏教版普通高中教科书《化学(第一册)》也是采用该法。然而,采用该法加热后在石棉网上能观察到的现象是仅出现少许淡黄色固体,反而有大量的黑色物质和白色物质出现。将钠放在崭新的石棉网上加热,现象也是如此。那么,为什么会出现大量的黑色和白色的固体?
2.1 对石棉网上黑色物质的质疑与探究
关于钠在石棉网上燃烧后出现黑色物质的解释,董军老师认为与钠和空气中的二氧化碳反应生成了黑色的单质碳有关[5];刘怀乐老师认为空气中二氧化碳含量极少且燃烧温度足够高,生成单质碳的说法难以令人信服,黑色物质是不同温度条件下生成的过氧化钠本身[6]。为了验证刘怀乐老师的解释,笔者将石棉网上的固体用蒸馏水浸泡,发现黑色物质无法溶解,说明不是过氧化钠;朱明斌等老师也通过实验证明石棉网上的黑色物质不是过氧化钠[7]。那么,黑色物质到底是什么?为什么会产生黑色物质?
人教版、鲁科版普通高中教科书《化学(第一册)》中钠的燃烧实验是在坩埚中进行的,通过实验对比,发现钠在石棉网上加热一段时间后出现瞬间起火剧烈燃烧的现象,而在坩埚中加热却无该现象。通过认真观察钠在石棉网上的燃烧过程,可以发现石棉网上黑色物质是在剧烈燃烧后才出现的。
钠在坩埚中不剧烈燃烧而在石棉网上能瞬间剧烈燃烧,推测后者可能有氧气瞬间生成,而氧气应该是剧烈燃烧前生成的过氧化钠与石棉网中的某种物质反应生成的。方洪川老师认为,如今的石棉网是由经石棉水浸泡后晾干的棉布及铁丝网构成,棉布是干扰钠在空气中燃烧的主要原因[8]。因此可以推测,棉布(纤维素)与钠接触的部分由于钠的熔化温度不断升高而燃烧起来,生成的二氧化碳、水蒸气等产物与过氧化钠继续反应放出氧气,导致出现瞬间剧烈燃烧的现象。由于石棉的阻隔及接触面积有限,纤维素无法完全燃烧,石棉网上出现黑色物质与纤维素不完全燃烧生成的碳单质有关。
有了推测、假设之后,还要寻找有说服力的证据。关于过氧化钠与水、与二氧化碳的反应生成氧气的验证,“滴水生火、吹气生火”是常见的演示实验。具体做法是:用棉花包住过氧化钠,再滴入几滴水或者使用吸管吹气,使棉花燃烧起来。而棉布的主要成分也是纤维素,以上实验可以作为寻找证据的重要方向。经过实驗,发现无论是“滴水生火”还是“吹气生火”实验,均出现瞬间剧烈燃烧的现象,且燃烧过后有黑色物质生成。
通过以上实验设计,找到了钠在石棉网上瞬间剧烈燃烧及出现黑色物质的证据,证明剧烈燃烧与石棉网中的纤维素与过氧化钠反应生成的氧气有关,黑色物质与纤维素不完全燃烧生成的单质碳有关。
2.2 对石棉网上白色物质的推断
关于钠在石棉网上燃烧后出现白色固体的解释,张婉佳老师等认为是过氧化钠与空气中的水蒸气、二氧化碳等生成了白色的氢氧化钠、碳酸钠[9];江智勇等老师认为是钠在常温或加热过程中生成的氧化钠[10]。通过以上实验,可以推测白色物质主要是石棉网中的纤维素燃烧生成的水蒸气、二氧化碳等与过氧化钠反应生成的氢氧化钠、碳酸钠等粉末。
3 对实验条件的质疑与探究
关于钠在空气中制备淡黄色固体实验条件中的氧气浓度和反应温度问题,朱心奇老师认为低温、氧气量不足时生成的是白色的氧化钠,制备过氧化钠必须较高的温度和氧气浓度[11];刘怀乐老师认为降低反应温度、限制空气的流量是实验成功的关键[12]。针对以上存在明显分歧的反应条件,必须通过实验进行探究。
3.1 关于氧气浓度的探究
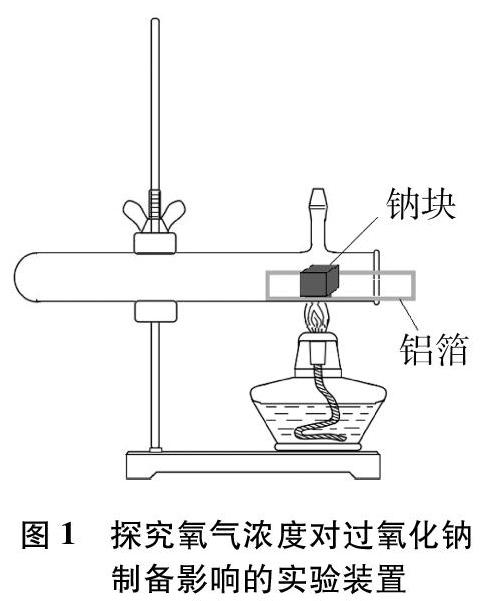
为了探究氧气浓度对产物的影响,将黄豆大的钠块放在具支试管的支管口下方进行加热,为防止生成的过氧化钠对玻璃试管的腐蚀[13],使用铝箔将钠块与试管隔开(如图1所示)。
图1装置中使用具支试管而不用普通试管,目的在于利用向上的支管口设计出有效的空气对流环境(烟囱效应)。反应开始后热空气向上排出,冷空气不断从试管口进入补充氧气,从而创设出试管口到支管部分为氧气充足的环境,而管中钠块左侧为氧气缺乏的环境。加热一段时间后,钠块燃烧起来,生成的白烟伴随着热空气从支管口排出,空气不断进入补充使钠块继续燃烧直至最后熄灭。冷却后取出铝箔,可以明显观察到氧气充足的管口部分生成了淡黄色的固体,而氧气缺乏的部分生成的是白色的固体。由此可以判断,氧气浓度高更有利于过氧化钠的生成。由于过氧化钠可以与过量的钠反应生成白色的氧化钠[14],提高氧气浓度可以确保钠完全燃烧,防止过量的钠与过氧化钠反应。
3.2 關于反应温度的探究
人教版普通高中教科书《化学(第一册)》中,钠的燃烧实验在坩埚中进行,并明确要求钠熔化后立即撤掉酒精灯,目的在于控制反应的温度。如果不撤掉酒精灯而是继续加热,会出现怎样的结果?笔者通过对照实验,发现撤掉酒精灯得到的固体颜色较浅,而持续加热得到的固体呈现明显的淡黄色,说明保持较高温度更有利于淡黄色固体的生成。由于温度低钠与氧气主要生成氧化钠[15],因此通过持续加热提高反应温度,可以确保钠燃烧转化为过氧化钠淡黄色固体。
4 钠在空气中加热制备淡黄色固体的再改进
根据以上对异常现象和实验条件的质疑和探究,可以归纳出钠在空气中加热制备呈明显淡黄色固体过氧化钠的实验注意事项:一是为了防止石棉网中的纤维素与过氧化钠反应,实验中不能让钠与石棉网直接接触;二是为了防止过量的钠与过氧化钠反应生成白色的氧化钠,实验应该在氧气充足的环境中进行;三是为了防止温度不够高导致生成氧化钠,实验应该在较高温度下持续加热进行。基于以上注意事项,将钠放在坩埚中持续加热似乎是最佳选择。但作为演示实验,该方案还存在可改进之处:一是过氧化钠会腐蚀坩埚,北京师范大学等三所高校无机化学教研室编写的《无机化学》(下册,第四版)明确指出,过氧化钠具有强碱性,熔融时不宜采用瓷质器皿或石英器皿[16],实验结束后腐蚀生成的黑色物质粘在坩埚底部且无法清洗,导致该坩埚无法继续使用。由于熔融的过氧化钠具有超强的熔矿能力[17],熔融的过氧化钠的腐蚀作用也是石棉网在钠燃烧过后出现黑色物质的原因之一;二是坩埚中空气无法对流,燃烧过程中产生的二氧化碳等沉积在其底部与钠反应生成单质碳[18],导致产物中有黑色物质生成;三是实验在坩埚中进行,钠的变化包括燃烧都在坩埚底部进行,不利于学生实验现象的观察。将钠放在蒸发皿中加热,也存在上述类似问题(如有少量黑色物质)。
基于以上问题,经过反复试探,在苏教版教材实验方案上做简单改进,可获得理想的实验效果。使用铝箔紧贴在石棉网上,切取长5mm、宽5mm、高2mm的金属钠四块,紧密排列在铝箔上加热。钠块燃烧熄灭后继续加热,即可得到呈明显淡黄色的固体,且无黑色物质出现。实验中钠块处理成扁平状,目的在于增大其在铝箔上的受热面积;选用小块的钠,目的在于让其在短时间内迅速升温。选用铝箔而不用其他金属,在于铝箔表面有致密且熔点高的氧化层保护膜,可以防止过氧化钠的腐蚀;且铝箔可以紧贴在石棉网表面,有利于迅速升温。实验结束后,教师可用镊子夹着铝箔走近学生展示生成的固体,让学生能清晰地观察到其颜色和状态。
仔细观察实验录像中钠在铝箔上加热的变化过程,发现加热初期钠块表面变成白色,证明温度低时主要生成氧化钠;继续加热,四块钠熔成一个银白色小球;之后,小球表面被白色薄膜覆盖;薄膜边沿出现淡黄色固体。淡黄色固体先在边沿出现的原因在于边沿的钠层更薄,温度升高更快,再次证明温度高有利于淡黄色固体的生成。燃烧从边沿开始,然后整块钠燃烧,但并未出现瞬间剧烈燃烧的现象,而钠在石棉网上直接加热有瞬间剧烈燃烧的现象,说明后者确实与纤维素有关。铝箔上火焰熄灭后,固体先后变为黑色、巧克力色、橙黄色,继续加热后出现淡黄色。
关于过氧化钠的颜色,人教版、苏教版、鲁科版等中学教材均描述为淡黄色,大学教材《无机化学》[19]及《化学词典》[20]也有同样表述;李俊生等老师认为通常过氧化钠呈现淡黄色是由杂质超氧化钠引起的,纯净的过氧化钠粉末是白色的[21];朱心奇老师也持有类似的观点[22]。本文的质疑与探究主要是基于中学教材关于过氧化钠颜色表述为淡黄色的观点展开的,也是建立在实验真实现象的基础上进行的,目的在于为中学课堂演示实验服务,为钠在空气中加热能明显观察到淡黄色固体提供更加优化的实验条件。《普通高中化学课程标准》(2017年版、2020年修订)关于化学学科核心素养的水平划分中,“证据推理与模型认知”素养的水平1要求学生“能从物质及其变化的事实中提取证据,对有关化学问题提出假设,能依据证据证明或证伪该假设”[23]。上述关于钠在空气中加热制备淡黄色固体存在的异常现象和实验条件的质疑和探究,就是基于钠在燃烧中变化的实验事实,针对不同解释存在的分歧设计实验寻找证据,最终做出对应判断,并有效运用判断结果,使用简单方法成功改进教材中的实验方案。探究的初衷在于发现真相、为相关观点提供实验事实和证据。通过质疑、探究和实验方案的再改进,在成功制得淡黄色过氧化钠固体的同时,也有利于培养学生的证据推理能力和批判质疑精神。
参考文献:
[1][21]李俊生,张笑宇,胡志刚. 对过氧化钠颜色的研究[J]. 化学教学,2012,(12):70~74.
[2][6][12]刘怀乐. 钠在空气中燃烧制过氧化钠的再实践和再认识[J]. 化学教育,2009,(3):67~69.
[3][10][14]江智勇,汪斌权. 钠在空气中燃烧实验的再探究[J]. 化学教学,2016,(2):48~50.
[4]吴先强. 钠燃烧生成过氧化钠的最佳实验条件探究[J]. 化学教学,2009,(4):11~12.
[5]董军. 钠在空气中燃烧实验的探究[J]. 化学教学,2012,(1):47~48.
[7]朱明斌,杨茵. 钠燃烧异常现象探究[J]. 化学教学,2008,(10):7~9.
[8][18]方洪川. “钠在空气中燃烧”实验的探究与改进[J]. 实验教学与仪器,2019,(5):31~33.
[9]张婉佳,黄伟. 制备过氧化钠演示实验的探究[J]. 化学教育,2008,(6):55,71.
[11][15][22]朱心奇. 过氧化钠是呈白色还是淡黄色[J]. 化学教育,2009,(2):69~70.
[13][16][19]北京师范大学,华中师范大学,南京师范大学无机化学教研室. 无机化学(下册)[M]. 北京:高等教育出版社,2003:655.
[17]郑大中,李小英,郑若锋,王惠萍. 过氧化钠超强熔矿能力的新认识[J]. 四川地质学报,2010,(4):488~492,499.
[20]周公度. 化学辞典[M]. 北京:化学工业出版社,2004:271.
[23]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版、2020年修订)[S]. 北京:人民教育出版社,2020.

