铁片电镀锌实验的再探究
周萍 肖中荣
摘要:梳理已有的电镀锌实验的改进方案,通过理论分析与实验探究,获得较理想的实验条件:选择ZnSO4-NH4Cl-CH3COONa电镀液、溶液pH为6、电镀电压为0.76V、电极间的距离为5cm,电镀可以得到银白色、较致密的镀锌层。增加锌镀层的酸性腐蚀和中性腐蚀实验证明,镀锌层具有显著减缓铁腐蚀的作用。
关键词:铁片电镀锌; 电镀液; 白铁皮; 实验探究; 铁腐蚀
文章编号:1005-6629(2021)08-0075-04
中图分类号:G633.8
文献标识码:B
1 引言
镀锌铁皮俗称白铁皮,是表面镀覆锌的白色低碳钢薄板,具有不易生锈和耐腐蚀的优点,镀锌铁皮在生产、生活中的用途广泛,用于制作各种容器等。
电镀是应用电解原理在某些金属表面镀上一薄层金属或者合金的过程。电镀实验可以让学生理解电能向化学能的转化、掌握电解原理和电解装置、体验电镀原理在工业生产中的应用价值。人教版《化学反应原理》安排了铁上镀铜的学生实验[1],苏教版《实验化学》安排了铁上镀锌的学生实验[2]。铁上镀锌实验具有如下教学价值:一是基于实验本体价值培养学生的实验操作能力。学生操作电镀锌实验需要选择电极材料、配制电解液、组装实验装置、控制变量探究适切的实验条件等,电镀锌实验可以提高学生的操作与心智技能;二是基于学科认知价值帮助学生深刻理解离子在溶液中的放电规律。很多学生对离子放电存在不少迷思概念,认为金属活动性顺序表中Zn位于H前,所以H+先于Zn2+放电。学生通过观察电镀锌的实验现象后,理解影响离子放电的因素有很多(如pH、电压、离子浓度等),控制实验条件可以使Zn2+先于H+放电;三是基于学科社会价值帮助学生理解电解原理及其在工业中的广泛应用。铁上镀锌可以减缓铁的腐蚀延长白铁皮的使用寿命。
为了达成上述教学功能,本文希望电镀锌实验的理想现象如下:镀锌层是银白色(与生活中所用白铁皮的颜色相近)的、致密的镀锌层具有减缓铁腐蚀的作用。
2 文献简要评述
2.1 苏教版《实验化学》的实验方案求证
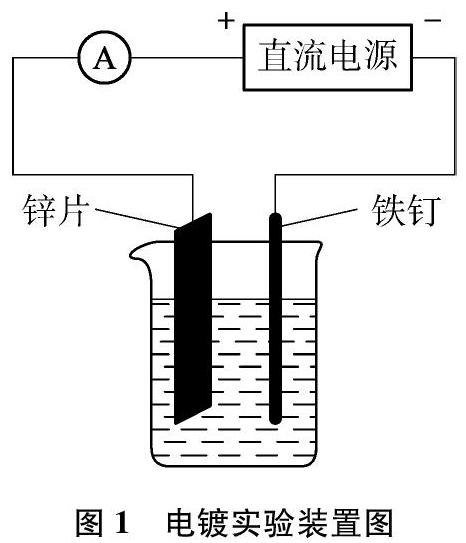
用50mL蒸馏水溶解3.5g ZnCl2、 12.5g KCl、 1.5g硼酸,调节pH为5~6,此时c(Zn2+)=0.51mol/L。以烧杯为电镀槽、锌片作阳极、铁钉作阴极,用6V直流电源电解。装置如图1所示[3]。
根据上述实验方案操作,5s后铁钉表面即产生气泡,摇动铁钉,疏松的镀层锌散落于溶液中。
教材提供的方案没有得到理想的实验结果,学生不明白锌层为什么不能镀在铁钉上,异常的现象削弱了实验的教学价值。
2.2 其他代表性实验方案求证
已有文献[4,5]介绍常见电镀液是不同浓度的ZnSO4·7H2O、 NH4Cl与CH3COONa的混合物,电镀电压设定在2~6V之间,电镀时间控制在1~5min,有的方案还添加了表面活性剂改善锌的吸附效果。由于实验材料、电压、电流、电极间的距离均会影响电镀效果,本文在求证和探究时均使用下列相同仪器、用品和实验操作。
仪器:高中学生电源(J04003-I),导线,电解槽,秒表,800目细砂纸,分析天平
用品:锌片,铁片,ZnSO4·7H2O,NH4Cl,CH3COONa,盐酸,NaOH溶液,稀硫酸,铁氰化钾,饱和食盐水,酚酞
平滑的金属表面对可见光反射率较高,多于70%以上呈现银白色光泽。若镀件凹凸不平或电流控制不当,镀锌层会显黑色[6];电镀选择表面积较大的光滑镀件和低电流,可以获得银白色锌镀层。本文将铁钉改为1cm×5cm铁片(电镀时插入溶液部分为1cm×3.6cm)。铁片处理:先用精细800目细砂纸反复打磨,保证表面光滑,再置于1mol/L热NaOH溶液数分钟,完全除去表面油污,用清水洗净后放入6mol/L盐酸,1min后取出用蒸馏水冲洗干净,备用。选取锌片为1.2cm×6cm(电镀时插入溶液部分为1.2cm×4cm),两电极间的距离为5cm。
根据林悦[7]的实验方案:称量4g ZnSO4·7H2O、 1g NH4Cl、 1g CH3COONa配制200mL电镀液,此时c(Zn2+)=0.07mol/L、 c(NH+4)=0.078mol/L,c(Zn2+)∶c(NH+4)≈1∶1。选择2V直流电源,接通电源测得电流为0.06A,阴极表面逐渐析出银白色物质,同时产生气泡,慢慢增多,30s后表面开始变灰黑,锌层结构粗糙。1min后停止电镀,用蒸馏水清洗镀件,表层灰黑色疏松的锌层脱落,露出灰白色镀层。
林悦[8]控制电压为2V,电镀初期观察到锌离子在铁片表面得到电子慢慢析出,形成银白色的镀层。随后有气泡产生,说明氢离子在阴极得电子产生氢气,析出锌层开始变灰黑,散落,没有得到理想的实验效果。
根据任跃红[9]的实验方案:称量10g ZnSO4·7H2O、 46g NH4Cl、 6g CH3COONa配制成200mL溶液,此时c(Zn2+)=0.17mol/L,c(NH+4)=4.3mol/L,c(Zn2+)∶c(NH+4)≈1∶25。选择2V直流电源,接通电源测得电流为0.40A,阴极表面逐渐出现银白色,迅速产生气泡并很快增多,20s后表面开始变灰黑,晶粒粗糙,1min后停止电镀。用蒸馏水冲洗镀件,表层灰黑色疏松的锌层脱落,露出银白色光亮镀层,吹干后称量、计算镀层质量约为0.002g。
任跃红[10]提供的实验方案获得实验现象和文献[11]基本相同,不能获得致密的镀锌层。还发现此时若延长电镀时间或增大电镀电压均无法增加镀层。
综上所述,具有代表性的以上两種实验方案[12,13]提供的电镀锌实验方案不理想,故也没证明镀锌层能减缓铁腐蚀的作用。
3 铁片电镀锌实验再探究
本文以为,电镀时若氢离子和锌离子同时在阴极得电子,产生的氢气不利于锌原子在阴极做有序堆积,很难形成致密的银白色锌镀层。故获取理想实验现象的关键条件是要控制锌离子在阴极慢慢析出而氢离子不析出。基于高中学生认知能力和高中实验条件,本文从电镀电压和c(Zn2+)两方面进行分析。
3.1 理论分析
3.1.1 电镀电压的控制方法
锌的标准电极电势Eθ为-0.736V,氢标准电极电势Eθ为0.00V,在电流密度为1A/m2时,氢在锌上面的析氢电势是0.716V,高中实验室常用的酸性镀液pH约在5~6左右,Zn2+的析出电压:EZn2+/Zn=EθZn2+/Zn-(0.0592/2)lg1/c(Zn2+)=-0.736V-(0.0592/2)lg1/c(Zn2+),氢气的析出电压:EH+/H2=EθH+/H2-(0.0592/2)lg1/c(H+)2=0.00-(0.0592/2)lg1/c(H+)2,代入c(Zn2+)可计算EZn2+/Zn,代入c(H+)可计算EH+/H2。理论上可通过计算和控制电极电势,当锌沉积的电极电势大于析氢电极电势时,析出锌而氢气不能析出,但实际电解的电流密度、c(Zn2+)、溶液pH等均会影响锌和氢气的析出电势[14]。本文通过检索文献采取的电压范围,在实验中调节电压,将电压控制在金属锌缓慢析出但没有氢气析出,从而得到理想的电压。
3.1.2 c(Zn2+)的控制方法
锌位于第4周期第ⅡB族,可以与多种配体形成稳定的配合物。NH3相对Cl-是较强的配体,锌氨配离子[Zn(NH3)4]2+的累积稳定常数约为1.2×109,因此溶液中c(Zn2+)很小,从而保证阴极慢慢析出锌,锌氨配离子在阴极还原过程为:[Zn(NH3)4]2+[Zn(NH3)2]2++2NH3,[Zn(NH3)2]2++2e-Zn+2NH3。工业电镀锌的电镀液体系是ZnSO4-NH4Cl-CH3COONa:醋酸钠与氯化铵发生双水解生成氨,NH3和Zn2+生成[Zn(NH3)4]2+;醋酸钠还可以调节溶液pH至弱酸性,防止pH过小析出氢气影响锌镀层。多数文献采取的电镀液配方与工业电镀锌的配方相似,只是各组分的含量有所不同。本文通过文献调研和实验求证,基于理想的实验效果和节省原料的角度,探究合理的原料配比。
3.2 实验探究
以下实验探究均在室温下进行,测得电镀液的温度为25℃,所用实验仪器、用品同前文。
3.2.1 探究合适的电镀电压
实验选用文献[15]的配方,采用物理实验室无极调节电压的学生电源。先将电压调节至1.5V,测得两电极间电阻大约为80欧姆;在电路中连接一个10欧姆的滑动变阻器(先设定为0);打开电源,观察阴极镀件现象:镀件逐渐变灰黑,产生大量气泡,旋转调节电压的旋钮将电压调小,同时用滑动变阻器微调电流,直至镀件表面几乎不产生气泡。此时电镀电压为0.56V、电镀电流为0.08A。
控制只析出金属锌不析出氢气的电压在0.56V左右。
3.2.2 探究合适的c(Zn2+)
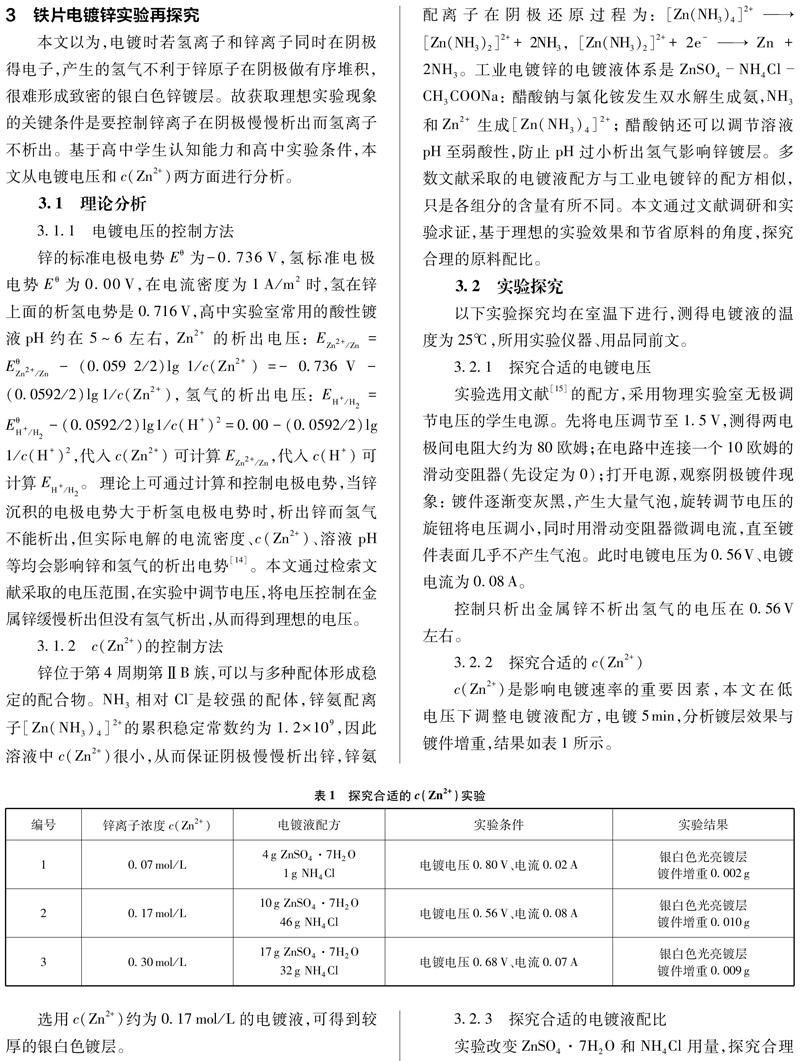
c(Zn2+)是影响电镀速率的重要因素,本文在低电压下调整电镀液配方,电镀5min,分析镀层效果与镀件增重,结果如表1所示。
选用c(Zn2+)约为0.17mol/L的电镀液,可得到较厚的银白色镀层。
3.2.3 探究合适的电镀液配比
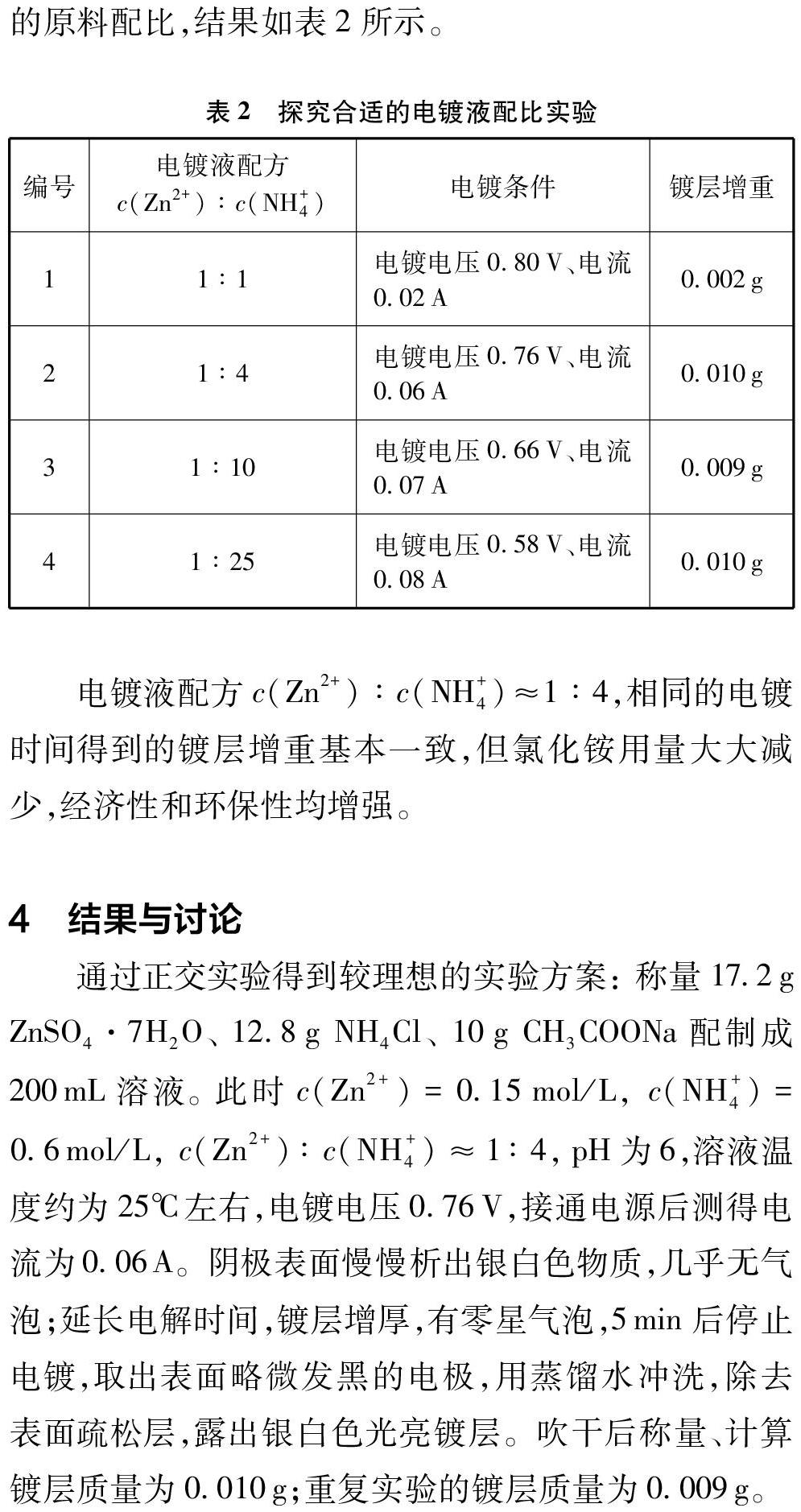
实验改变ZnSO4·7H2O和NH4Cl用量,探究合理的原料配比,结果如表2所示。
电镀液配方c(Zn2+)∶c(NH+4)≈1∶4,相同的电镀时间得到的镀层增重基本一致,但氯化铵用量大大减少,经济性和环保性均增强。
4 结果与讨论
通过正交实验得到较理想的实验方案:称量17.2g ZnSO4·7H2O、 12.8g NH4Cl、 10g CH3COONa配制成200mL溶液。此时c(Zn2+)=0.15mol/L,c(NH+4)=0.6mol/L,c(Zn2+)∶c(NH+4)≈1∶4,pH为6,溶液温度约为25℃左右,电镀电压0.76V,接通电源后测得电流为0.06A。阴极表面慢慢析出银白色物质,几乎无气泡;延长电解时间,镀层增厚,有零星气泡,5min后停止电镀,取出表面略微发黑的电极,用蒸馏水冲洗,除去表面疏松层,露出银白色光亮镀层。吹干后称量、计算镀层质量为0.010g;重复实验的镀层质量为0.009g。
本文还发现,若在上述实验过程中加入洗洁精或硫脲,并没有增加镀锌层厚度,这和文献[16]的结论不同。
检验锌镀层防腐蚀效果有以下两种方法。
方法1:取两支试管分别加入3mL 3mol/L的稀硫酸以及两滴铁氰化钾溶液,将小片镀锌铁皮和普通铁片分别放入两支试管,镀锌铁皮与硫酸发生剧烈反应并产生大量气体,但溶液颜色没有变化;普通铁片与硫酸缓慢反应产生少量气泡,溶液中慢慢产生普鲁士蓝沉淀。
镀锌铁皮中锌为负极、铁为正极,与酸反应产生氢气的速率比普通铁皮与酸的反应速率快,反应初期没有生成Fe2+,说明在酸环境下锌镀层对铁有显著的保护作用。
方法2:向镀锌铁皮和普通铁片分別滴3滴饱和食盐水和1滴酚酞,数分钟后镀锌铁皮表面溶液几乎无色,普通铁片表面溶液明显变红。久置空气中,镀了锌的铁皮部位依旧为银白色,没有镀锌的铁皮部位生锈严重。
镀锌铁皮置于空气中,锌为负极、铁为正极,基本不发生吸氧腐蚀,说明在自然状态下锌镀层对铁皮具有较好的防腐作用。
5 结语
电镀锌实验是高中阶段的学生实验,本文基于文献调研和实验求证,获得了合适的电镀锌实验条件:称取17.2g ZnSO4·7H2O、 12.8g NH4Cl、 10g CH3COONa配制200mL溶液,溶液pH为6,温度为25℃;控制电镀电压为0.76V、电极间的距离为5cm、镀件铁片1cm×5cm(电镀时插入溶液部分为1cm×3.6cm),镀层锌片为1.2cm×6cm(电镀插入溶液部分为1.2cm×4cm),电镀5min得到0.010g左右的银白色致密锌镀层,实验的重现性好。增加的锌镀层的酸性腐蚀和中性腐蚀实验证明,镀锌层具有显著的减缓铁腐蚀的作用。改进的实验方案用料少、电镀时间短、现象明显,便于教师演示实验和学生分组实验,能充分体现电镀锌实验的多重教学功能。
参考文献:
[1]人民教育出版社,课程教材研究所. 普通高中化学选择性必修教秘书·化学反应原理[M]. 北京:人民教育出版社,2020:118.
[2][3]王祖浩主编. 普通高中课程标准实验教科书·化学1[M]. 南京:凤凰出版传媒集团,2012:64.
[4][5][7][8][11][12]林悦等. 电镀教学演示实验的改进[J]. 闽南师范大学学报,2019,(6):110~114.
[6]张民芳. 电镀锌的演示实验中镀件表面为什么不呈银白色光亮[J]. 河南教育学院学报,1999,(9):55~56.
[9][10][13][15]任跃红. 中学化学实验研究[M]. 北京:中国石化出版社,2011:196~200.
[14]印永嘉. 物理化学简明教程[M]. 北京:高等教育出版社,1992:342~344.
[16]范艳花. “铜片镀锌”最佳实验条件的分析和研究[J]. 实验与创新思维,2007,(2):5~7.

