烟秆炭基肥对薏苡土壤有机碳组分及微生物群落结构和丰度的影响*
胡 坤, 张红雪, 郭力铭, 吴凤英, 周碧青, 邢世和, 毛艳玲
(1.福建农林大学资源与环境学院 福州 350002; 2.土壤生态系统健康与调控福建省高校重点实验室 福州 350002;3.自然生物资源保育利用福建省高校工程研究中心 福州 350002)
薏苡(Coix lacryma-jobiL.)是一年生或多年生禾本科C4植物, 广泛种植于我国南部省份, 其各种营养成分十分丰富, 可药食两用, 具有利水、健脾、除痹、清热排脓的功效, 被誉为禾本科植物之王[1]。近年来,由于长期连作、化肥使用不合理等, 导致土壤性质退化严重、养分供应不平衡、土壤肥力和生产力下降, 严重影响了优质薏米生产的可持续发展[2]。因此,薏苡种植土壤改良十分必要。目前, 常用的改良方法有使用化学改良剂、种植绿肥、增施有机肥等,但其存在改良时间长, 可能造成二次污染等问题[3]。因此寻找一种价格低廉且效果显著的绿色改良材料至关重要。大量研究表明, 生物炭在农业土壤改良中的效果良好[3-4]。
生物炭是农林废弃物生物质材料(秸秆、杂草、粪便等)在无氧或缺氧条件下通过高温裂解得到的一种富碳固体产物, 其含碳量极高, 施入土壤中能提高土壤中有机质含量, 进而提升肥力, 并且由于其本身多孔隙的结构和巨大比表面积可为微生物提供适宜生活环境, 提高土壤酶活性和微生物量[5-6]。但是生物炭主要来源于农业废弃物, 其本身养分有限, 单独施用并不能满足作物生长的需要[7], 生物炭基肥是以生物炭为载体, 定向添加其他类型氮磷钾肥料制备而成, 可以弥补生物炭速效养分不足、消耗量大等问题[8]。多项研究发现生物炭基肥能够增加土壤有机碳含量, 改善土壤理化性质, 提升土壤酶活性及微生物群落和功能多样性。高梦雨等[9]研究了施用炭基肥和生物炭对棕壤有机碳组分的影响, 结果发现施用多年炭基肥和生物炭能显著提高土壤总有机碳及各组分含量, 提升效果显著优于投入等量碳素或等量氮磷钾养分。常栋等[10]通过对植烟地土壤添加炭基肥发现, 炭基肥增强土壤微生物对碳源的利用程度, 对土壤脲酶、蔗糖酶和多酚氧化酶活性具有一定的提升作用。Ibrahim等[11]研究发现, 施用烟秆炭基肥, 能显著增加土壤氮循环酶活性和土壤细菌分类群(变形菌、放线菌等)丰度, 改善土壤微生物群落结构等。
土壤有机碳(SOC)是衡量土壤质量的重要指标,在调节土壤理化性质, 改善土壤生态环境, 影响作物产量等方面具有重要作用[12]。土壤有机碳可进一步分为活性有机碳和惰性有机碳, 活性有机碳组分在土壤中易矿化分解, 转化、循环周期短, 能更敏感地反映土壤有机碳的动态变化, 直接反映当前土壤肥力状况。因此土壤有机碳及活性碳组分作为土壤质量评价的重要指标, 其含量变化可有效表征生物炭基肥对土壤改良的效果[13-14]。福建省烟草(Nicotiana tabacumL.)种植量大, 秸秆资源丰富, 烟秆作为一种农业废弃物, 其本身含碳量高, 占比达40%, 成本低,污染小, 开发成生物炭的潜力很大[15]。利用烟秆制备烟秆炭基肥, 进行烟秆炭基肥对薏苡种植土壤改良效果的研究不仅对薏苡土壤养分调控、科学种植意义重大, 而且可实现对烟秆的高效处理和资源化利用。目前, 将烟草秸秆作为制备生物炭基肥原料的研究较少, 尽管生物炭基肥改良土壤的效果已在多种作物上证实, 但缺乏生物炭基肥在薏苡上的应用研究, 因此本研究以福建省浦城县薏苡种植土壤为研究对象, 施用烟秆炭基肥, 通过研究土壤有机碳组分、酶活性和微生物群落结构、丰度变化特征, 以期为薏苡土壤改良和烟秆废弃物资源化利用提供理论依据。
1 材料与方法
1.1 试验区概况
试验地位于福建省南平市浦城县(27°48′33.76″N,118°32′58.41″E), 海拔249 m, 属典型中亚热带季风湿润气候区。年平均气温17.4 ℃, 年降雨量1700 mm左右, 年日照时数1900 h, 全年无霜期254 d, 四季分明, 雨热同期, 土壤类型为黄红壤。
1.2 试验材料
土壤: 试验前采集农田表层土壤(0~20 cm), 风干, 研磨, 分别过1 mm和0.149 mm筛, 用于分析土壤pH、全碳、全氮、全磷、全钾、碱解氮、有效磷、速效钾等化学性质, 结果如表1所示。

表1 供试材料基本化学性质Table 1 Basic chemical properties of the test materials
化肥: 尿素(N46%)、过磷酸钙(P2O512%)、氯化钾(K2O 50%), 购自市场。
烟秆炭基肥: 选用福建省三明市尤溪县的‘翠碧一号’烤烟, 经烘干、粉碎后, 通过便携式生物炭化机(淮安华电环保机械制造有限公司), 在高温(500 ℃)无氧环境下裂解2 h, 制得烟秆生物炭, 其基本化学性质如表1所示。烟秆炭基肥由生物炭、尿素、过磷酸钙和氯化钾按照质量比20∶15∶39∶26经平磨式挤压造粒机混合制成, 各养分比例为N∶P2O5∶K2O=4.6∶7.2∶5。
薏苡: 供试品种为‘浦薏6号’, 由浦城县农业科学研究所选育, 其品性优良, 种性稳定, 纯度较高, 适于试验研究。
1.3 试验设计
试验设置4个施肥处理方式: 1) CK: 空白对照,不施肥; 2) F: 常规施化肥, 尿素100 kg∙hm−2、过磷酸钙600 kg∙hm−2、氯化钾100 kg∙hm−2; 3) LBF: 施低量烟秆炭基肥, 生物炭基肥施用量为800 kg∙hm−2;4) HBF: 施高量烟秆炭基肥, 生物炭基肥施用量为1600 kg∙hm−2。其中LBF处理与F处理保持等量氮磷钾养分量, 每个处理3次重复, 随机区组排列, 每个小区面积为12 m2(6 m×2 m)。每个小区种植40株薏苡, 株行距为50 cm×40 cm。基肥在起垄前均匀施于土壤表层, 翻耕使得肥料与土壤混合均匀, 其他水分及病虫害等大田管理按照常规进行。薏苡于6月19日移栽, 12月15日收获。
1.4 样品采集与预处理
在薏苡收获期, 每个小区采用“S”形取样法取0~20 cm表层土壤, 挑去土壤中的杂草和石屑, 混匀样品, 四分法取样, 一部分鲜样用于微生物和酶活性测定, 剩下自然风干, 过1 mm和0.149 mm土筛用于土壤pH和碳组分测定。
1.5 测试项目和方法
土壤pH和碳组分: 土壤pH采用电位法测定, 水与土壤的比例为2.5∶1; 土壤有机碳(SOC)含量采用全自动微量碳氮元素分析仪(德国ELEMENTAR)测定; 可溶性有机碳(DOC)含量按照1∶10土液比进行浸提, 离心过滤后用TOC分析仪(日本岛津SHIMADZU)测定; 颗粒有机碳(POC)含量通过5 g∙L−1六偏磷酸钠分散, 冲洗烘干、研磨后用全自动微量碳氮元素分析仪测定; 易氧化有机碳(EOC)含量采用333 mmol∙L−1高锰酸钾氧化法测定; 微生物量碳(MBC)含量采用K2SO4浸提、氯仿熏蒸法测定。
土壤酶活性: 土壤淀粉酶活性测定采用3,5-二硝基水杨酸比色法, 其活性以24 h后1 g土壤麦芽糖的毫克数表示; 土壤蔗糖酶活性测定采用3,5-二硝基水杨酸比色法, 其活性以24 h后1 g土壤葡萄糖的毫克数表示; 土壤脱氢酶活性测定采用氯化三苯基四氮唑(TTC)还原法, 其活性以24 h后1 g土壤三苯基甲月替(TPF)的微克数表示; 土壤过氧化氢酶活性测定采用高锰酸钾滴定法, 其活性以1 g土壤消耗0.1 mol∙L−1KMnO4的体积(mL)表示。结果表示均转化为干土重。
土壤微生物量: 选取不同处理下薏苡收获期土壤进行细菌丰度及多样性的测定。16S rDNA PCR产物高通量测序由北京奥维森基因科技有限公司完成。细菌16SrDNA V3-V4 扩增引物为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′- GG ACTACNNGGGTATCTAAT-3′)。PCR反应体系为12.5 μL 2×Taq PCR MasterMix, 3 μL BSA (2 ng∙μL−1),2 Primer (5 μmol∙L−1), 2 μL模 板DNA, 和5.5 μL ddH2O。具体步骤为: 先从样本中提取DNA, 用带有barcode的特异引物扩增到16S rDNA的V3-V4区,在95 ℃预变性5 min, 95 ℃变性45 s, 55 ℃退火50 s, 72 ℃延伸45 s, 进行32个循环, 再在72 ℃延伸10 min, 最后通过Illumina MiSeq平台进行Pairedend测序, 下机数据经过QIIME (v1.8.0)软件过滤、拼接、去除嵌合体, 完成序列分析。
1.6 数据处理
采用Microsoft Excel 2018整理数据, 用SPSS 20.0软件对土壤有机碳组分、酶活性数据进行单因素方差分析和SNK法进行显著性检验(P<0.05), 运用Origin 2018绘制土壤细菌PCA分析图和群落丰度箱型图, 采用Stamp对土壤细菌属进行差异分析,利用LEfSe分析软件对土壤细菌进行LEfSe分析, 利用Canoco 4.5对土壤pH、碳组分含量、酶活性及土壤细菌群落相对丰度做冗余(RDA)分析。
2 结果与分析
2.1 土壤pH、有机碳及其组分含量变化
由表2可知, 与CK处理相比, 施用烟秆炭基肥LBF和HBF处理土壤pH显著增加10.14%和10.51%(P<0.05), 而F处理pH降低2.54% (P<0.05)。施用炭基肥显著提高土壤有机碳(SOC)含量(P<0.05), HBF处理土壤SOC含量最高, 为12.54 g∙kg−1, 较其他处理增加11.47%~24.65%; CK与F处理间无显著差异。不同施肥处理可溶性有机碳(DOC)含量较CK处理增加24.49%~44.81%, 施用炭基肥处理的DOC含量高于常规施化肥处理(P<0.05)。施用炭基肥显著增加土壤颗粒有机碳(POC)含量, 与F处理相比, HBF和LBF处理POC含量增加36.89%和24.78% (P<0.05),HBF与LBF处理间差异也达显著水平(P<0.05)。施用炭基肥, 土壤易氧化有机碳(EOC)含量也呈增加趋势, 在HBF处理下增幅达最大, 相较CK、F和LBF处理分别增加0.67 g∙kg−1(P<0.05)、0.29 g∙kg−1(P<0.05)和0.23 g∙kg−1(P<0.05), F与LBF处理间无显著差异。施用炭基肥, 土壤微生物量碳(MBC)含量显著增加(P<0.05), 相比CK处理平均增加107.98%,相比F处理平均增加58.57%; 但CK与F处理间无显著差异。
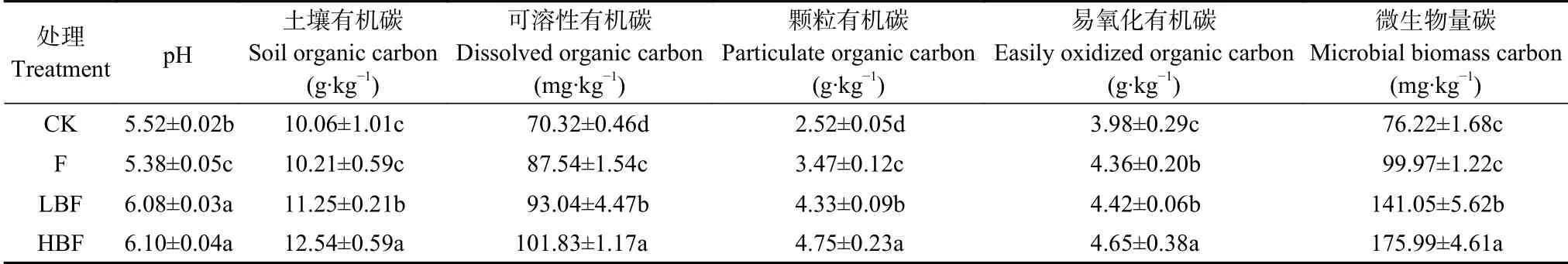
表2 不同处理下土壤pH和有机碳组分变化Table 2 Changes of soil pH and organic carbon fractions under different treatments
2.2 土壤酶活性变化
对不同施肥处理下各种土壤酶活性进行分析,得到结果如表3。施用烟秆炭基肥, 土壤淀粉酶活性升高, HBF处理土壤淀粉酶活性最高, 相比CK、F和LBF处理提高1.12倍、0.57倍和0.20倍, 各处理间均达到显著水平(P<0.05)。土壤蔗糖酶活性有一定提升, 但各处理之间差异不显著(P>0.05)。土壤脱氢酶和过氧化氢酶活性变化趋势为HBF>LBF>F>CK, 且随着炭基肥施用量的增加而升高; HBF处理土壤酶活性达最高, 相比CK和F处理, 脱氢酶活性分别提高94.80%和69.43% (P<0.05), 过氧化氢酶活性分别提高54.93%、37.50% (P<0.05)。

表3 不同处理下土壤酶活性变化Table 3 Changes in soil enzymes activities under different treatments
2.3 土壤细菌群落α、β多样性变化
土壤细菌群落Chao1指数、Shannon指数分别用于反映土壤样品中微生物群落的丰富度和多样性, 数值越大, 表明群落丰富度、多样性越高。不同处理土壤细菌Chao1指数和Shannon指数如图1所示。施用烟秆炭基肥, 土壤细菌Chao1指数升高, 在HBF处理下达最大, 为4470.16, 相比CK和F处理增加了17.29%和10.32%, 相比LBF处理也有一定提升。施用炭基肥提高土壤细菌Shannon指数, HBF处理数值最大, 为10.11, 相比CK、F和LBF处理分别提高0.65、0.46和0.17个单位。这表明施用烟秆炭基肥提高土壤微生物群落丰富度和多样性, 且随施用量的增加效果越明显。
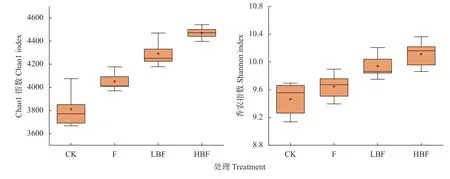
图1 不同处理土壤细菌α多样性Fig.1 Alpha diversity of soil bacteria under different treatments
图2为不同处理细菌群落分布主成分分析图。从图中可以看出, 前两个轴(PC1, PC2)共同解释了24.3%的变异, 第1主成分轴贡献率为12.5%, 各处理间有明显的空间分异, CK和LBF处理主要位于PC1轴的正端, F和HBF处理位于PC1轴的负端,CK和F处理样品间差异性较大, LBF和HBF处理样品间差异性较小, CK与F、LBF处理间距离相对较近, 而与HBF处理距离较远。说明与CK处理相比, HBF处理对细菌群落组成的影响大于F和LBF处理。
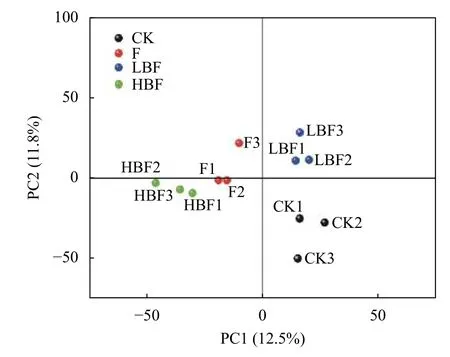
图2 不同处理土壤细菌群落分布PCA分析图Fig.2 PCA analysis of soil bacterial community distribution under different treatments
2.4 土壤细菌群落结构差异性变化
测定不同处理土壤细菌, 其门水平上的10种土壤优势菌群分布如表4。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、螺旋体菌门(Saccharibacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)和硝化螺旋菌门(Nitrospirae)是优势菌门, 占比超过95%。施用炭基肥后放线菌门和拟杆菌门等比例明显提高, 在HBF处理下达最大, 比CK处理分别增加26.46%和32.86%, 比F处理分别增加10.94%和30.23%。而变形菌门和绿弯菌门等比例呈下降趋势。
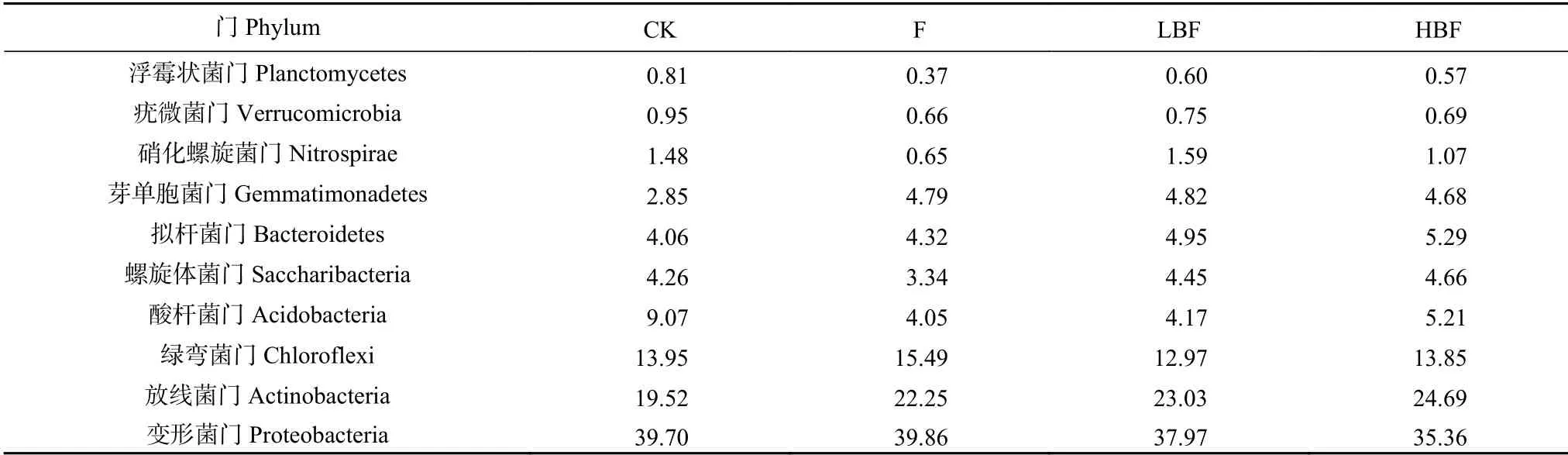
表4 不同处理土壤细菌门水平的菌群分布百分比Table 4 Percentage distribution of soil bacteria at the phyla level under different treatments %
通过对土壤细菌属水平进行STAMP分析, 可以揭示炭基肥施用下的显著差异物种(图3)。与CK处理相比, LBF处理物种组成与CK相似, 仅有芽单胞菌属(Gemmatimonas)相对丰度显著升高(P<0.05),Candidatus−Koribacter、Jatrophihabitans2个属相对丰度显著降低(P<0.05); HBF处理中Jatrophihabitans、热酸菌属(Acidothermus)、芽单胞菌属、丛生放线菌属(Actinospica)、德沃斯氏菌属(Devosia)等5个属相对丰度显著升高(P<0.05), 而Candidatus_Koribacter、生丝微菌属(Hyphomicrobium)、厌氧粘细菌属(Anaeromyxobacter)、短根瘤菌属(Bradyrhizobium)、Haliangium、泉发菌属(Crenothrix)等6个属相对丰度显著降低(P<0.05)。与F处理相比, LBF处理中短根瘤菌属、硝化螺旋菌属(Nitrospira)、布氏杆菌属(Bryobacter)、Haliangium等4个属相对丰度显著升高(P<0.05), 而酸土单胞菌属(Aciditerrimonas)、类诺卡氏属(Nocardioides)、泉发菌属、马杜拉放线菌属(Actinomadura)等4个属相对丰度显著降低(P<0.05);HBF处理中布氏杆菌属、丛生放线菌属、Haliangium、硝化螺旋菌属等4个属相对丰度显著升高(P<0.05), 而酸土单胞菌属、泉发菌属、金色马赛菌(Massilia)等3个属相对丰度显著降低(P<0.05)。
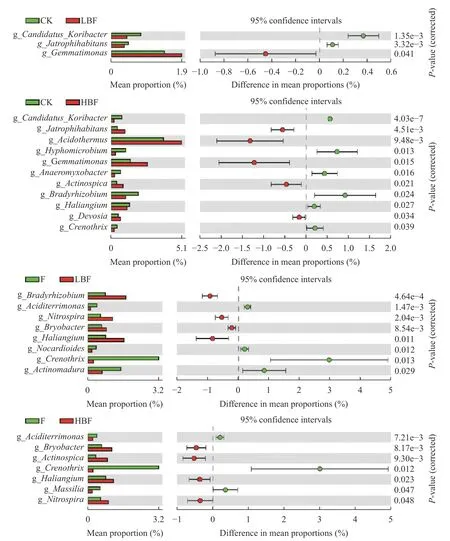
图3 基于STAMP分析的不同处理土壤显著差异的细菌属Fig.3 Soil bacterial genera with significant differences among different treatments based on STAMP analysis
基于分类信息的LEfSe分析的进化分支图(图4)可以更好地体现不同施肥处理间存在的差异物种。由内至外辐射的圆圈代表了由门至属的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类, 小圆圈直径大小与相对丰度大小呈正比。图中无显著差异的物种统一着色为黄色, 差异物种跟随分组进行着色, 4种颜色分别代表不同处理中起到重要作用的优势微生物类群。由图中可以看出,不同处理在不同分类水平差异物种不同, CK处理总计有2个门、5个纲、5个目、8个科为显著差异物种, F处理有0个门、3个纲、2个目、5个科为显著差异物种, LBF处理有2个门、2个纲、1个目、3个科为显著差异物种, HBF处理有1个门、2个纲、5个目、5个科为显著差异物种。在细菌门类水平上, CK处理中酸酐菌门(Acidobacteria)和浮霉状菌门(Planctomycetes)为具有显著差异的物种, 其相对丰度高于其他土壤菌门, F处理无显著差异物种,LBF处理中变形菌门和硝化螺旋菌门(Nitrospirae)为显著差异物种, HBF处理中拟杆菌门显著高于其他菌门。

图4 基于分类信息的LEfSe分析的不同处理土壤细菌进化分支图Fig.4 Evolutionary branch diagram of LEfSe analysis of soil bacteria based on classification information
2.5 土壤pH、碳组分、酶活性、土壤细菌群落相关性分析
对土壤pH、碳组分与酶活性及细菌门分类水平上10种优势物种丰度进行冗余(RDA)分析, 如图5所示, 空心箭头代表土壤pH及碳组分含量, 箭头越长代表影响越显著。从图可见土壤pH、土壤有机碳(SOC)、颗粒有机碳(POC)、微生物量碳(MBC)为主要影响因子, 而可溶性有机碳(DOC)、易氧化有机碳(EOC)对土壤酶和细菌的影响相对较小。实心箭头代表土壤4种酶活性和在门分类水平上10种土壤优势细菌群落的相对丰度, 影响因子与细菌种群夹角越接近0°代表两者呈正相关越显著, 夹角越接近180°代表两者呈负相关越显著。由图5可以看出,土壤pH、土壤碳组分与酶活性及细菌群落之间具有显著的相关关系(P<0.05), 其中土壤碳组分含量与土壤酶活性呈正相关关系, 土壤pH、SOC、POC、DOC和MBC含量与土壤各种酶活性呈显著正相关关系, 而与变形菌门呈显著负相关。土壤EOC含量与螺旋体菌门、放线菌门和芽单胞菌门等呈显著正相关(P<0.05), 与疣微菌门(Verrucomicrobia)和酸杆菌门等呈显著负相关关系(P<0.05)。

图5 土壤pH、碳组分与酶活性及细菌门水平相对丰度相关分析Fig.5 Correlation analysis among soil pH, carbon components, enzymes activities and relative abundances of bacterial phyla
3 讨论
3.1 烟秆炭基肥对土壤pH和有机碳组分的影响
本研究结果表明, 土壤pH、有机碳组分因肥料种类、施用量的不同而有所差异, 施用烟秆炭基肥,显著提高土壤pH和SOC含量, 增加土壤DOC、POC、MBC等活性有机碳组分含量, 且都随施用量的增加而升高。其中, MBC的提升效果最明显, 与常规施化肥处理相比平均增加58.57%, 与对照处理相比平均增加107.98%, 这与前人的研究相似。陈懿等[16]研究表明施用炭基肥可明显提升土壤pH和其他养分含量, 同时生物炭对肥料养分具有吸持效应, 进而提升土壤肥力。宋大利等[17]和Demisie等[18]研究发现生物炭和肥料配施增加土壤有机碳及其组分含量, 改善土壤质量。分析其原因, 可能是生物炭本身呈碱性, 含有大量的K+、Ca2+、Mg2+等盐基离子, 施入土壤后, 它能交换中和土壤中的H+和Al3+, 从而降低土壤酸度, 提高土壤pH[19]。生物炭本身含碳量高, 全碳含量达645.2 g·kg–1, 远高于土壤平均值, 配合化肥施入土壤增加土壤SOC和POC含量, 增加土壤碳库储量, 改善土壤生产力。MBC含量提升显著的原因是生物炭具有多孔隙结构及巨大的比表面积, 能有效吸附肥料中的速效养分, 同时为微生物生长活动提供了良好的栖息地, 促进了土壤中微生物群落的生长, MBC含量得到提高[20]。DOC含量受季节、温度、湿度、pH等多种因素影响, 因此可能是烟秆炭基肥改善土壤pH、湿度等影响微生物活性, 进而影响DOC含量的变化, 其具体机理还有待进一步研究。
3.2 烟秆炭基肥对土壤酶活性的影响
土壤酶是土壤中生物催化剂, 其活性高低是土壤有机质分解与矿化以及土壤碳、氮、磷等元素循环的主要限制因素, 可有效反映土壤养分状况及肥力水平[21]。
本研究中施用烟秆炭基肥后, 土壤淀粉酶、脱氢酶、过氧化氢酶活性提高, 相比常规施化肥分别提高31.42%~57.14%、45.55%~69.43%和5.00%~37.50%, 高量炭基肥处理提高作用高于低量炭基肥处理, 而炭基肥对土壤蔗糖酶活性的影响不显著。周玉祥等[22]研究发现土壤淀粉酶、脱氢酶和过氧化氢酶活性均随秸秆生物炭施用量的增加有不同程度提高。陈心想等[23]研究认为生物炭可以显著提高土壤过氧化氢酶活性, 但在短期内对蔗糖酶无显著影响, 这些都与本研究结果一致。淀粉酶与土壤C循环有关, 施用烟秆炭基肥, 提高了土壤中活性有机碳组分含量, 进而提高土壤淀粉酶活性。脱氢酶与过氧化氢酶都是微生物生长代谢中重要的氧化还原酶,其活性可以反映土壤微生物数量及相应的活性, 施用炭基肥改善土壤环境和细菌菌落组成结构, 提高土壤细菌数量, 进而提升土壤脱氢酶和过氧化氢酶活性。蔗糖酶促进糖类水解, 一般用来表征土壤熟化程度和肥力水平, 施用炭基肥后对蔗糖酶活性没有显著影响, 原因在于生物炭对酶活性的影响具有可变性, 这可能还与生物炭的种类、自身理化性质、施用量、土壤类型等因素有关[24]。
3.3 烟秆炭基肥对土壤细菌群落结构和丰度的影响
施用生物炭基肥会影响土壤生物化学环境, 进而直接影响微生物群落物种的丰富度及多样性[25]。本研究表明, 施用烟秆炭基肥, 土壤细菌群落Chao1指数和Shannon指数明显提高, 土壤细菌群落丰富度和多样性提高。这与陈懿等[26]的研究结果一致。一方面, 生物炭巨大的比表面积和丰富的孔隙结构可以为微生物的栖息和繁殖提供良好的环境; 另一方面, 炭基肥以生物炭与肥料按配比制得, 含有丰富的C、N、P和K等营养成分, 能够直接为微生物生长提供所需的养分[27]。
同时, 有研究发现, 施用生物炭和生物炭基肥会对土壤细菌群落结构有影响, 施用生物炭后, 90%以上细菌为变形菌门、放线菌门、绿弯菌门、酸杆菌门、螺旋体菌门、拟杆菌门和芽单胞菌门[28]。不同细菌类别对生物炭基肥的响应不同, 本研究中, 施用烟秆炭基肥, 放线菌门、拟杆菌门细菌丰度上升, 这与Nielsen等[29]的研究一致。放线菌适宜在偏碱环境下生存, 而炭基肥中的生物炭pH为碱性, 施入土壤有利于放线菌的生长。拟杆菌门细菌具有纤维素降解能力, 对于土壤中碳元素的循环具有积极意义,而炭基肥的施入正好补充了C循环过程中有机物质的损失。施用烟秆炭基肥, 土壤变形菌门、绿弯菌门细菌丰度呈下降趋势。而徐民民等[30]研究发现施用生物炭会提高小麦(Triticum aestivumL.)根际绿弯菌门丰度, 对变形菌门无影响。这与本研究结果存在差异, 原因可能是与宿主植物和土壤性质的不同有关。变形菌是土壤中最丰富的细菌类群, 对土壤酸碱度敏感, 与土壤pH呈负相关[31], 生物炭基肥施入提高土壤pH, 进而降低变形菌门相对丰度。研究表明绿弯菌门是一种贫瘠营养型细菌, 在光合作用中提供能量, 它们所产生的初级生产力对异养菌具有非常重要的作用, 但生长速度慢[32]。施用炭基肥处理中绿弯菌门丰度降低, 可能与土壤细菌中其他显著提高的细菌门类与绿弯菌产生较强的竞争作用有关。
在属水平上, 与常规施化肥相比, 施用烟秆炭基肥, 硝化螺旋菌属、布氏杆菌属、Haliangium等3个属相对丰度显著升高(图3), 硝化螺旋菌属驱动硝化过程, 在土壤氮循环中发挥重要作用[33], 布氏杆菌属能够分解有机物, 促进碳循环[34]。研究发现, 施用生物炭基肥, 会增加土壤有机碳组分和硝态氮和铵态氮含量, 补充碳氮循环过程中所消耗有机物质, 进而提高相应菌属丰度[35]。酸土单胞菌属、泉发菌属等2个属相对丰度显著降低, 酸土单胞菌属适宜在酸性环境下生存, 生物炭为碱性, 施入会影响酸土单胞菌属的生存, 降低其丰度; 泉发菌属为好氧甲烷氧化菌,能够氧化土壤中的甲烷, 但其在土壤中作用机制还不清楚, 有待进一步研究[36]。
3.4 各处理间土壤pH、有机碳组分、酶活性、细菌门丰度之间关系分析
土壤pH表征土壤酸碱性, 影响土壤中多种微生物活动进程。土壤有机碳组分参与土壤C循环, 直接影响微生物生长环境, 土壤酶来源于土壤微生物及动植物残体, 而土壤细菌在土壤微生物中数量最多、分布最广。周之栋等[37]指出, 土壤酶活性是土壤微生物过程的反映, 酶活性越高, 土壤细菌越活跃,丰富度越高, 同时土壤功能细菌能分解有机物, 释放养分, 促进土壤碳循环, 而土壤碳循环产物与养分又反过来能供细菌生长所需, 因此土壤pH、碳组分与酶活性和细菌丰度有一定的直接或间接联系。本研究冗余结果显示, 土壤pH、土壤SOC、POC和MBC等是影响土壤细菌群落丰度变化的主导因子, 原因在于一方面绝大部分细菌对土壤酸碱度极其敏感;另一方面土壤SOC会影响土壤碳库储量, 土壤POC和MBC等活性有机碳组分促进土壤碳循环, 改善土壤生产力, 进而促进细菌繁殖生长, 增加细菌群落丰度。施用烟秆炭基肥, 一方面降低土壤酸度, 提高土壤SOC含量, 进而直接影响淀粉酶分解含碳有机化合物、促进蔗糖转化酶增加土壤中易溶营养物质,显著提高脱氢酶和过氧化氢酶等微生物代表性酶活性; 另一方面烟秆炭基肥可以增加土壤DOC、EOC和MBC等活性有机碳含量, 使土壤碳循环速度加快,增加土壤养分含量, 进而促进土壤放线菌菌丝体产生各种胞外水解酶, 降解土壤中的各种不溶性有机物质以获得细胞代谢所需的各种营养, 故土壤有机碳组分含量与各种酶活性及放线菌门呈正相关关系。但土壤pH、碳组分、酶活性和土壤细菌之间的关系不显著, 可能原因是土壤细菌种类繁多且作用效果有差异, 故其还有待进一步探究[38]。
4 结论
1)烟秆炭基肥增加了土壤pH和有机碳组分含量, 有效抑制土壤酸化, 影响土壤碳库储量, 提升土壤肥力。
2)烟秆炭基肥显著提升了土壤淀粉酶、脱氢酶和过氧化氢酶活性, 提高了土壤细菌丰度及多样性,影响了土壤细菌群落组成结构。
3)通过RDA分析, 土壤pH、SOC、POC、DOC和MBC含量与土壤各种酶活性均呈显著正相关关系, 而与变形菌门呈显著负相关。
综合分析表明, 烟秆炭基肥对土壤pH、碳组分、酶活性和微生物具有积极影响, 对薏苡种植土壤改良、肥力提升具有重要意义。

