pH 值对共沉淀反应制备LiNi0.8Co0.1Mn0.1O2 的影响
赵永男 ,石常鹏 ,吴 平 ,高海燕
(1.天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387;2.天津工业大学 材料科学与工程学院,天津300387;3.灌云天骄科技有限公司,江苏 连云港 222200)
适用于下一代锂离子电池电动汽车(EV)和固定式储能设备的阴极材料需要更高的能量密度、更长的循环寿命和更高的电池安全性,这些都是确保锂离子电池商业成功的关键因素[1]。由于这个原因,富Ni层状结构(LiNi1-2xCoxMnxO2,x < 0.2)被认为是用于 EV系统的最有前途的阴极材料之一,其中镍基氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)是锂离子二次电池系统高能量密度的最佳候选者。然而,制约其大规模生产的因素还有很多,例如锂镍混排、界面副反应、储存环境苛刻等[2]。针对以上问题,目前有多种方式对LiNi0.8Co0.1Mn0.1O2(简称NCM811)进行改性[3-4]。一是杂原子掺杂改性,抑制Li/Ni 的阳离子混排,有助于减少首次不可逆容量,同时提高材料的结构稳定性,Zhang等[5]通过 Cr 离子的掺杂,Kimura 等[6]通过 Mo 离子的掺杂,都提高了NCM811 电极的循环稳定性能;二是表面包覆,降低活性物质溶解到电解液中或者与电解液发生副反应,同时改善材料的表面性能,电池充放电循环时的产热量也相应减少,常用的包覆材料为金属氧化物、氟化物和金属磷酸盐类[7-8];三是合成富镍的梯度材料,Sun 等[9]运用共沉淀法合成了梯度材料NCM811,材料中心核存在缝隙,材料外表面形成一层致密外壳,内核缝隙的存在减小了Li 离子扩散路径,有利于材料容量的发挥;以及使材料单晶化,Kim[10]研究了NCM811 在含有大量的NaCl 或KCl 助熔剂中的烧结情况,助熔剂NaCl(熔点801 ℃)和KCl(熔点770 ℃)在高温下熔化形成液态助熔剂,材料的一次颗粒在液态助熔剂中能较好地分散且单独生长,显著减少了材料一次颗粒的团聚。
以上都是提高NCM811 稳定性及安全性能的有效方法,但是要达到高能量密度的要求,材料本身的合格才是至关重要的。在NCM811 前驱体的合成中,影响其性能的条件非常多,比如pH 值、温度、氨水浓度、搅拌速率、滴加速率等[11-12],其中pH 值的影响最为关键。若要提高纯相NCM811 的比容量,找到适配的pH 值非常重要。本文用简单的共沉淀法制备了NCM811,在合成前驱体的过程中设置了不同的pH 值为变量,探究了pH 值的变化对材料形貌、粒径、元素分布含量及振实密度的影响。
1 实验部分
1.1 实验药品
实验中使用的主要原料、试剂的规格及生产厂家如表1 所示。

表1 实验所用原料Table 1 Experimental materials
1.2 材料制备
将硫酸镍(NiSO4·6H2O)、硫酸钴(CoSO2·7H2O)、硫酸锰(MnSO4·H2O)组成的水溶液(Ni ∶Co ∶Mn=8 ∶1 ∶1)缓慢倒入恒温水浴锅中的四口瓶,瓶中已放好氨水的底液,把水浴锅的温度设置在55 ℃,为了让反应不接触空气,持续往四口瓶通入氮气,并开启搅拌。30 min 后,将4 mol/L 的NaOH 溶液作为沉淀剂用蠕动泵缓慢滴入四口瓶中。NaOH 水溶液以0.5 mL/min 的流速泵入四口瓶中。控制蠕动泵,将pH 值分别维持在10.5、11、11.5、12、12.5,每 2 h 检查一次 pH 值、流速和沉淀物形态。持续反应8 h 后关闭搅拌,在55 ℃下恒温陈化一段时间。用去离子水洗涤至pH 值小于7.5,之后放于烘箱中在120 ℃下干燥5 h。将干燥后的材料放入研钵中捣碎研磨,然后过120 目筛,得到Ni0.8Co0.1Mn0.1(OH)2前驱体,将前驱体粉末与LiOH·H2O(化学计量比为1 ∶1.05)放入球磨机中充分混合,后置于氧气气氛下的管式炉中,先在500 ℃下煅烧5 h,然后在 750 °C 下烧结 10 h 得到 LiNi0.8Co0.1Mn0.1O2。本文将 pH 值 = 10.5、11、11.5、12、12.5 合成出来的三元正极材料LiNi0.8Co0.1Mn0.1O2分别命名为 L1、L2、L3、L4、L5。
1.3 材料表征
D8 ADVANCE 型 X 射线衍射仪(XRD,德国Bruker 公司,Cu-Kα 射线,λ =0.154 06 nm),扫描角度2θ 的范围为 10°~ 70°,扫描速率为 10°/min;扫描电镜表征使用的是日本日立公司的Hitachi S-4800 型冷场发射电子显微镜(加速电压为10 kV)。
1.4 电池的组装与电化学性能测试
将合成的活性材料、乙炔黑和聚偏二氟乙烯(PVDF)在玛瑙研钵中混合研磨(质量比为 8 ∶1 ∶1),并添加适量的有机溶剂(N-甲基-2 吡咯烷酮)。在研磨形成均匀的糊状混合物之后,将其涂覆在铝箔上并在120 ℃下真空干燥12 h。把干燥的电极片用压片机压成圆形作为正极,用裁片机将电极片裁剪为直径12 mm 的圆形电极片。称量电极片质量计算得出活性物质质量便于进行电化学性能的测试。
使用锂金属片作为负极,1 mol/L 的LiPF6溶液、碳酸亚乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸亚乙基甲酯(EMC)(体积比为 1 ∶1 ∶1)作为电解质,Celgard2400聚丙烯多孔膜作为隔膜。在充满高纯氩气的干燥手套箱组装成纽扣电池,水氧质量分数均严格控制在0.1×10-6以下,按照正极壳、正极材料、隔膜、锂片、垫片、弹片、负极壳的顺序组装成扣式电池。后置于室温24 h 后进行电化学性能测试。
2 结果与讨论
2.1 材料结构测试结果分析
图1 为L1-L5 的XRD 衍射图,标准pdf 编号为00-056-0147。

图1 不同pH 值制备的NCM811 XRD 图谱Fig.1 XRD patterns of NCM811 prepared at different pH values
由图1 可见,5 个样品均具有六方晶系α-NaFeO2结构和无杂质的衍射峰。由于Li+和Ni2+的半径相近,高镍材料容易发生Ni2+占据Li+空间3 b 位和Li+占据Ni2+空间3 a 位,形成锂镍混排。特别是当材料脱锂时,随着Li+不断脱出,材料中形成较多的Li 空位,此时,Ni2+逐渐迁移至Li+位,使材料中Li+传导性差的NiO 相增多,并且锂层中镍的存在将阻碍Li+的扩散,增大材料的内阻,加速材料性能的衰退,材料的循环性能变差[13]。I(003)/I(104)峰强比值可用来衡量阳离子混排程度,一般认为,当I(003)/I(104)>1.2 时,阳离子混排度较低,有助于改善材料的循环性能。5 个样品的I(003)/I(104)比值都较低,分别为 0.87、0.88、0.97、0.79、1.12,说明 pH 值对锂镍混排程度没有明显影响。L3 的XRD 图谱中显示出明显得(006)/(102)与(108)/(110)劈裂峰,说明L3 具更完美的层状结构,有利于大量锂离子快速脱嵌[14],有助于发挥NCM811 的高比容量特性。
2.2 材料形貌组成测试结果分析
图2 为 NCM811 样品 L1—L5 的 SEM 图。

图2 不同pH 值制备的NCM811 SEM 图Fig.2 SEM images of NCM811 prepared at different pH values
由图2 可见,pH 值的变化对产物的形貌有显著影响。L2 为破碎的球形颗粒,L3 为较致密的完整球形形貌,L1、L4 和L5 是呈现不规则的颗粒聚集体。致密的球形形貌有利于材料和电解液充分接触,还有利于材料在导电基体上紧密填充[15]。随着pH 值的升高,材料的一次粒子的粒径随之增大,聚集颗粒松散堆积,在电化学过程中,材料容易破裂剥落[16]。图2 还可表明,L3 的一次晶粒的晶体发育完全,结晶度较高,晶粒与晶粒之间存在较多的间隙与褶皱,因此表面积更大。大的表面积能够让活性物质与电解液充分接触,提高材料的比容量。L3 材料EDX 面扫图如图3 所示,各元素含量列于表2。样品中Ni、Co、Mn 元素分布非常均匀,Ni ∶Co ∶Mn 的比例非常接近于 8 ∶1 ∶1。

表2 L3 的EDX 的各元素百分含量Tab.2 EDX elemental proportion of L3

图3 L3 的 EDX 面扫图(Ni、Co、Mn)Fig.3 L3 EDX surface scan(Ni、Co、Mn)
ICP 测试结果见表3。
由表 3 可知,与 EDX 面扫结果一致,L3 中 Ni ∶Co ∶Mn 的比例十分接近 8 ∶1 ∶1,而其他 4 个样品中 Ni ∶Co ∶Mn 比值均偏离 8 ∶1 ∶1。pH 值会影响不同元素的沉淀率,pH 值为 11.5 左右是 3 种元素的共沉淀点,pH 值偏离11.5,部分元素难以完全沉淀,导致产物化学组成的偏离。表4 中列出了各样品的粒径范围。

表3 L1—L5 的ICP 检测得出的各元素含量Tab.3 ICP elemental proportion of L1—L5
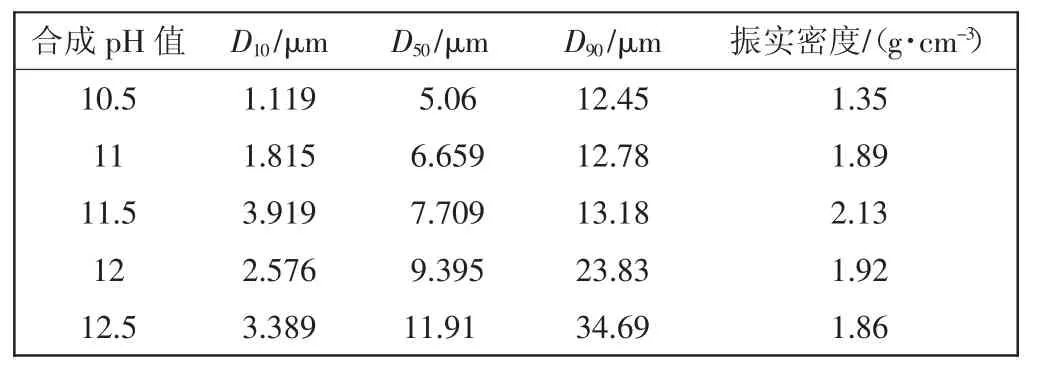
表4 L1—L5 的粒径分布和振实密度Tab.4 Particle size distribution and tab densities of L1—L5
由表4 可知,随着前驱体溶液pH 值得增大,产物的粒径也随之增大,粒径的大小与反应过程中pH 值呈正相关关系。振实密度随着pH 值的增大先逐渐增大,在pH=11.5 时,振实密度达到最大值2.13 g/cm3,而后继续增大pH 值,振实密度又逐渐减小。振实密度与材料的体积比容量密切相关,振实密度越大,材料的体积比容量越高[17]。
2.3 材料电化学性能测试结果分析
图4 所示为L1—L5 首次充放电曲线。由图4 可知,电压范围为2.7 ~4.5 V,电流密度为0.2 C。L1—L5的首次放电比容量分别是 172.6、197.5、222.8、181.4、180.6 mA·h/g,而它们首次放电效率并无明显差异。L3呈现的高比容量与其结构形貌有关,良好的层状结构有利于锂离子的充分脱嵌,致密光滑的球形形貌确保活性物质和电解液充分接触,电化学反应更充分。高振实密度使单位面积上的活性物质量增大,也有助于比容量的提高[19]。

图4 L1—L5 的首圈充放电性能曲线Fig.4 Charge and discharge performance curves of L1—L5 for the first turn
图5 为L1—L5 在0.2 C 的充放电循环曲线。
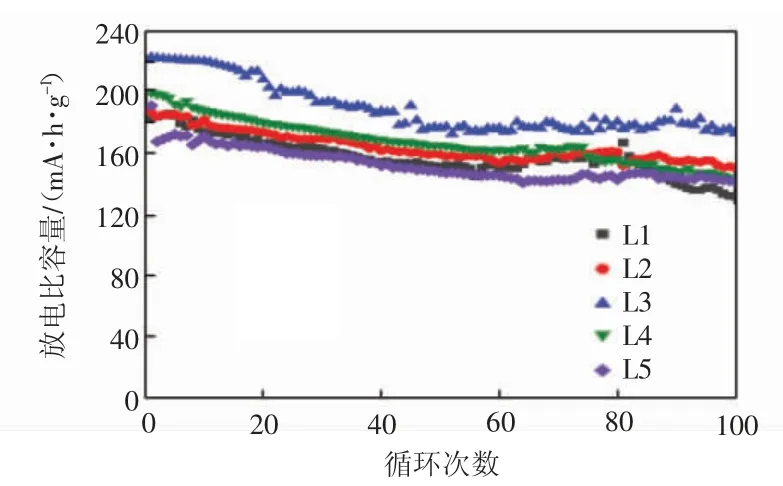
图5 L1—L5 的充放电循环曲线Fig.5 Charge and discharge cycle curves of L1—L5
由图5 可知,L3 不仅具有最高的初始放电比容量222.8 mA·h/g,在100 周的充放电循环过程中也始终保持最高的放电比容量,循环100 周后L1—L5 的容量保持率分别为 81.1%、80.0%、81.8%、79.9%和80.2%。充放电循环结果表明,前驱体制备过程中pH值的变化对NCM811 的循环稳定性并无明显的影响。XRD 中的(I003)/(I110)之比均小于1.2 也说明了调变pH 值对阳离子的混排程度影响较小[19]。所有样品的阳离子混排程度均较大,导致充放电循环稳定性欠佳。
图6 所示为L1—L5 的倍率性能曲线。
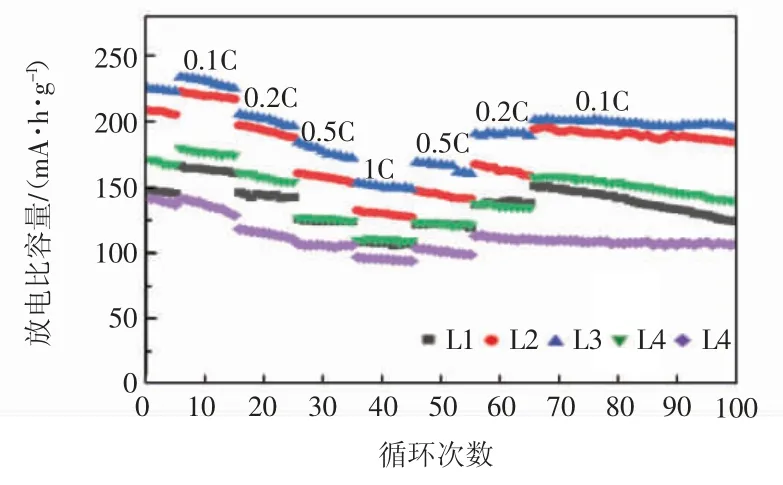
图6 L1—L5 的倍率性能曲线Fig.6 Rate performance curves of L1—L5
电池首先在0.2 C 下充放电活化5 次,然后分别在 0.1、0.2、0.5、1、0.5、0.2 C 充放电 10 次,最后回到0.1 C 的倍率。由图 6 可见,L1—L5 在 0.1 C 的第 15 周放电比容量分别为 158.3、223.5、227.5、176.9 和 128.3 mA·h/g,经过倍率测试再次回到0.1 C 放电时,第66周的放电比容量分别是 151.3、191.4、198.4、152.5、117.4 mA·h/g,经过倍率充放电循环后,L3 的容量保持最高。锂离子的扩散速率是影响倍率性能的主要原因[20-21],L3 拥有较小的平均粒径较且层状结构保持最好,这缩短了锂离子的传输路径,加快了锂离子的传输,所以L3 倍率性能优异。
图7 所示为L3 的循环伏安曲线。

图7 L3 的循环伏安曲线Fig.7 Cyclic voltammetry curves of L3
扫描电压范围为2.7 ~4.5 V,扫描速率为0.1 mV/s。由图7 可以看出,每条曲线都存在2 对氧化还原峰,分别对应锂离子的脱出和嵌入过程。首次循环时,在3.58 V/4.08 V 附近存在一对氧化还原峰,对应Ni2+/Ni3+的氧化还原过程。氧化峰与还原峰之间的差值(ΔV)代表Li+脱出与嵌入的可逆性,氧化还原电势差越大,表明电池的极化越大[22]。L3 的CV 曲线还表明,经过首周循环后,L3 的氧化还原电势差变小,氧化峰向低电压方向偏移,还原峰向高电压方向偏移。
L1—L5 的交流阻抗谱如图8 所示。

图8 L1—L5 交流阻抗曲线Fig.8 AC impedance curves of L1—L5
由图8 可见,5 个样品在高频区的半圆弧存在明显的差异。由于不同pH 条件下合成的样品的形貌差异较大,导致电极材料的电化学阻抗Rct发生变化。通常片状堆叠的电极材料更容易暴露在电解液中,导致电极材料表面的钝层不断增加,电荷转移阻抗增大,由此造成不可逆容量损失增大[23]。在5 个样品中,L3的电荷转移阻抗最小,为120 Ω,说明pH 值=11.5 条件下合成的样品具有最低的电荷传递阻抗。
3 结 论
本文采用氢氧化物共沉淀法合成三元材料NCM811的前驱体Ni0.8Co0.1Mn0.1O2(OH)2,将其与LiOH·H2O 混合,在氧气气氛下高温烧结得到三元材料LiNi0.8Co0.1Mn0.1O2。探究前驱体制备过程中pH 值对材料的影响。通过XRD、SEM、粒径分析、电化学测试等表征手段探讨了 pH 值对三元正极材料LiNi0.8Co0.1Mn0.1O2的性能的影响。结论如下:
(1)适当调节体系的pH 值对产物的晶体结构无明显影响,样品均具有α-NaFeO2型层状结构。
(2)pH=11.5 时,样品具有最佳的层状结构、最好的球形形貌、其组成也最符合预期的化学计量比,样品二次颗粒的粒径分布窄,振实密度高,有利于发挥三元正极材料高比容量的优势。
(3)电化学测试说明了pH=11.5 为最佳的合成条件,其具有最高的首次放电比容量222.8 mA·h/g,在长循环过程中也一直保持着最高的放电比容量,电荷转移阻抗最小为117 Ω。

