水蛭素对大鼠NRK-52E细胞尿酸盐转运体表达的影响*
赵应学,黄思诗,梁红,吴林秀,梁杏梅,周维海,甄汉深,黄敏琪,刘喜华**
(1.广西壮族自治区江滨医院南宁530021;2.广西卫生职业技术学院南宁530023;3.广西科康科技集团有限公司南宁530001;4.广西中医药大学药学院南宁530001)
尿酸是人体内嘌呤核苷酸的分解代谢产物,通常将血液中尿酸水平男性>420 μmol·L-1,女性>360 μmol·L-1定义为高尿酸血症(Hyperuricaemia),高尿酸血症常由嘌呤代谢紊乱、尿酸排泄减少所导致[1]。高尿酸血症是痛风的生化基础,虽然只有5-12%的高尿酸血症患者会发生痛风,但血液尿酸水平越高、持续时间越长,痛风的发病几率越高[2]。对高尿酸血症的长期治疗有助于防止痛风及其可能的肾脏、心脏或代谢并发症的发作,其首选药物是黄嘌呤氧化酶抑制剂,如别嘌呤醇[3-4]。但由于别嘌呤醇非选择性抑制嘌呤和嘧啶的其他酶而引起诸多不良反应,作为选择性抑制黄嘌呤氧化酶的非布司他在临床上的使用也会引起消化道、肝肾功能及心血管不良反应[5]。因此,寻找具有较好降尿酸效果且不良反应少的治疗新策略对于高尿酸血症及痛风的治疗具有重要意义。
金边蚂蟥为广西壮族自治区特色壮药,具有抗凝血、抗血栓、降血脂等作用,课题组前期研究发现,金边蚂蟥及其活性成分水蛭素可有效降低高尿酸血症小鼠血清尿酸水平,具有较好的抗痛风作用[6-8]。但尚未从细胞水平探索水蛭素降尿酸的可能机制,因此,本研究以大鼠肾小管上皮细胞NRK-52E为研究对象,检测不同剂量水蛭素对肾细胞尿酸盐转运体表达的影响,以期从细胞水平揭示水蛭素对尿酸排泄的影响。
1 材料
1.1 水蛭素制备
取金边蚂蟥活体(南宁市金海科康生物医药科技有限公司,批号:20180608),吸饱2%氯化钠后置于容器中,加入硫酸锌、乙醇混合液,使其吐出唾液,即为天然水蛭素提取液。将水蛭素提取液纯化后制成粉末状(质量分数为96%,凝血酶滴定约为500 ATU·g-1),蒸馏水稀释成含200 ATU·g-1的水蛭素溶液。
1.2 细胞与试剂
大鼠肾小管上皮细胞NRK-52E来源于中国科学院细胞库。主要试剂:DMEM(美国Hyclone公司),胎牛血清(美国Gibco公司),PBS、胰酶、CCK8溶液、Hoechst33258染色液、SDS、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),黄嘌呤(上海阿拉丁生化科技股份有限公司),TRIzol(美国Ambion公司),反转录试剂(宝生物工程(大连)有限公司),SYBR FAST qPCR Master Mix(美国KAPA Biosystems),氯仿、异丙醇、无水乙醇(国药集团化学试剂有限公司),PVDF转移膜、化学发光试剂(美国Millipore公司),兔抗葡萄糖转运蛋白9(Glucose transporter 9,GLUT9)抗体、兔抗尿酸盐转运体1(Urate transporter,URAT1)抗体、兔抗GAPDH抗体、山羊抗兔IgG(武汉贝茵莱生物科技有限公司),兔抗有机阴离子运输蛋白(Organic anion transporter 1,OAT1)抗体(英国Abcam公司)。
1.3 仪器
DMIL LED型倒置荧光显微镜(德国Leica公司),AMR-100型酶标仪(杭州奥盛仪器有限公司),CFXConnect 96型荧光定量PCR仪、mini protean 3 cell型电泳仪(美国Bio-Rad公司),Tanon-5200型全自动化学发光分析仪(上海天能科技有限公司)。
2 方法
2.1 细胞培养
将冻存的大鼠肾小管上皮细胞NRK-52E从液氮罐中取出,37°C水浴至冻存液完全融化,再将细胞悬液转移至离心管。1000 r·min-1离心3 min,弃上清,加入1 mL DMEM悬浮细胞沉淀。将细胞悬液转移至培养瓶中,加入含5%胎牛血清的DMEM进行培养。待细胞融合度达到80%以上时,按照1:2比例进行传代培养。
2.2 CCK8检测水蛭素对细胞的毒性作用
收集对数期NRK-52E细胞,调整细胞密度并分布于96孔板中,每孔180 μL,约5×103个细胞。待细胞贴壁后,用不同浓度(0、0.01、0.1、1、5和10 mg·mL-1)水蛭素处理24、48、72 h。取出细胞板,每孔加入10 μL CCK8溶液,继续培养4 h。在酶标仪上检测各孔于450 nm处的吸光值,计算细胞存活率=(其他浓度水蛭素组OD值-0 mg·mL-1水蛭素组OD值)×100%。
2.3 细胞分组与处理
将NRK-52E细胞分为5组:①正常组:采用含5%胎牛血清的DMEM培养细胞;②黄嘌呤(Xanthine)组:培养基中加入200 μmol·L-1黄嘌呤(浓度由前期预实验结果筛选所得)培养细胞;③水蛭素低浓度(Low)组:培养基中加入0.01 mg·mL-1水蛭素培养细胞;④水蛭素中浓度(Medium)组:培养基中加入0.1 mg·mL-1水蛭素培养细胞;⑤水蛭素高浓度(High)组:培养基中加入5 mg·mL-1水蛭素培养细胞。24 h后,进行后续检测。
2.4 Hoechst33258染色观察细胞形态
收集各组细胞分布于12孔板中,加入1 mL 4%多聚甲醛固定20 min。弃固定液,PBS清洗2次,加入1 mL Hoechst33258染色液染色5 min。弃染色液,PBS清洗5次,加入1 mL PBS,于荧光显微镜下观察各组细胞形态变化。
2.5 qRT-PCR检测细胞中GLUT9、OAT1和URAT1 mRNA表达水平
取各组细胞沉淀(约1×106个)于1 mL TRIzol中于冰上进行匀浆处理,12000 r·min-1离心10 min,加入氯仿、异丙醇提取总RNA。反转录合成cDNA,进行qRT-PCR扩增反应。扩增条件为95℃预变性3 min,95℃变性5 s,56℃退火10 s,72℃延伸25 s,40个循环。引物序列如下:
2.6 Western blot检测细胞中GLUT9、OAT1和URAT1蛋白表达水平
按照每1×106个细胞加入200 μL RIPA(强)组织细胞快速裂解液的比例,裂解细胞,提取总蛋白。BCA法测定蛋白浓度后,进行SDS-PAGE分离。将蛋白转移至PVDF膜,4℃封闭过夜。于湿盒内孵育一抗(1∶1000),室温1 h。洗膜,孵育HRP标记的山羊抗兔IgG,室温1 h。洗膜,滴加化学发光试剂,于全自动化学发光分析仪中检测,读取蛋白条带灰度值。
2.7 统计学处理
采用SPSS 23.0软件进行统计学分析,计量资料采用mean±SD表示,多组间比较采用单因素方差分析。以P<0.05表示差异具有统计学意义。
3 结果
3.1 水蛭素处理NRK-52E细胞的浓度及时间筛选
CCK8检测细胞活力,计算细胞增殖率,结果(图1)显示,同一时间点,随着水蛭素浓度的升高,NRK-52E细胞增殖率降低,而同一浓度水蛭素处理48 h对细胞增殖率的抑制作用低于24 h,因此,选择24 h为本次实验水蛭素处理NRK-52E细胞的时间。根据不同浓度水蛭素对NRK-52E细胞增殖率的影响,10 mg·mL-1处理下的细胞增殖率[(72.18±1.04)%]相较于其他浓度偏低,对细胞毒性作用较大,因此,为了在对细胞低毒性的情况下观察不同浓度水蛭素对NRK-52E细胞的影响,后续实验检测中设置的水蛭素低、中、高浓度分别为0.01、0.1和5 mg·mL-1。

图1 水蛭素对NRK-52E细胞增殖率的影响
3.2 水蛭素对NRK-52E细胞形态的影响
Hoechst33258染色观察结果(图2)显示,正常组细胞核呈椭圆形,被淡染,存在个别亮蓝色细胞碎片;黄嘌呤组细胞质固缩,细胞核碎裂增多,呈亮蓝色的凋亡小体增多;水蛭素低、中、高浓度组的细胞形态逐渐恢复椭圆形,细胞质固缩、细胞碎片逐渐减少,提示水蛭素可改善黄嘌呤诱导的细胞形态变化及凋亡。

图2 Hoechst33258染色观察NRK-52E细胞形态
3.3 水蛭素对NRK-52E细胞GLUT9、OAT1和URAT1表达的影响
qRT-PCR和Western bolt检测结果(图3-图4)显示,与正常组比较,黄嘌呤组细胞中GLUT9和URAT1 mRNA及蛋白表达水平显著升高(P<0.05),OAT1 mRNA及蛋白表达水平显著降低(P<0.05);与黄嘌呤组比较,水蛭素低、中、高浓度组GLUT9和URAT1表达显著减低(P<0.05),OAT1表达显著升高(P<0.05),且高浓度组与低浓度组之间的差异具有统计学意义(P<0.05)。提示水蛭素对NRK-52E细胞尿酸盐转运体(GLUT9、OAT1和URAT1)的表达具有调节作用。
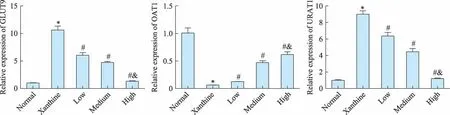
图3 qRT-PCR检测NRK-52E细胞GLUT9、OAT1和URAT1 mRNA表达水平

图4 Western blot检测NRK-52E细胞GLUT9、OAT1和URAT1蛋白表达水平

表1 qRT-PCR引物序列表
4 讨论
越来越多的证据表明,无症状高尿酸血症可预测高血压、糖尿病、肥胖、慢性肾脏疾病等的进展[9]。血尿酸浓度升高与代谢综合征有关,加强高尿酸血症的预防措施,可有效控制痛风、肥胖等疾病风险[10]。黄嘌呤在黄嘌呤氧化酶的作用下,氧化生成尿酸,当尿酸浓度超出其溶解度时,尿酸析出形成尿酸盐,沉积于关节及周围组织中,从而引发痛风[11]。目前,临床上降低尿酸的药物主要通过减少尿酸的产生、增加尿酸的排泄和促进尿酸溶解来实现,常用药物包括别嘌呤醇、非布司他、丙磺舒、苯溴马隆等[12]。但西药治疗痛风具有较多的不良反应,限制了临床应用。本课题前期发现金边蚂蟥具有较强的抗痛风作用,并为之申请专利(专利号:CN201410109937.2)。经过基础实验研究发现水蛭素是金边蚂蟥抗痛风的主要活性成分[7],基于前期研究结果,从动物水平探讨了广西壮族自治区特色壮药金边蚂蟥活性成分水蛭素对高尿酸小鼠的降尿酸的作用[8],本实验从细胞水平进一步研究水蛭素降尿酸的可能机制。本次研究采用黄嘌呤干预大鼠肾小管上皮细胞NRK-52E,发现黄嘌呤可破坏细胞形态,增加细胞的凋亡,而在水蛭素同时干预下的NRK-52E细胞形态逐渐正常,凋亡小体也逐渐减少,提示水蛭素可缓解黄嘌呤干预对NRK-52E细胞的损伤作用。
尽管饮食、遗传或疾病导致的尿酸生产过量是高尿酸血症的病理基础,但实际上高尿酸血症的主要原因是尿酸排泄量较低[13]。治疗高尿酸血症及痛风的策略之一即为采用尿酸盐抑制剂抑制从尿液中重新吸收尿酸盐的转运蛋白的表达[14]。全基因组关联研究表明,尿酸浓度与GLUT9、OAT4、URAT1、ATP结合盒转运体G2(ATP-binding cassette transporter G2,ABCG2)等转运体编码基因的单核苷酸多态性存在显著相关性[13]。GLTU9和URAT1主要是在肾近曲小管对尿酸盐的重吸收过程中起关键作用[15]。OAT1在肾脏尿酸排泄中发挥重要作用,研究发现调节肾脏GLUT9、OAT1、URAT1和胃肠道上OAT1、GLUT9的表达可对高尿酸血症小鼠产生降尿酸作用[16]。Fang等[17]实验结果也证实,增加OAT1和OAT3表达,降低GLUT9和URAT1表达,可减少大、小鼠高尿酸血症模型的血清尿酸水平。在本次研究结果中,黄嘌呤处理NRK-52E细胞,增加了细胞中GLUT9和URAT1的表达,而OAT1表达减少,水蛭素的干预可逆转黄嘌呤对NRK-52E细胞GLUT9、OAT1和URAT1表达的影响,即水蛭素可调节NRK-52E细胞尿酸盐转运体的表达水平。
民族医药治疗痛风具有较好的疗效,且毒副作用小,进而受到人们越来越多的重视,但民族药物的开发也伴随着一些问题,譬如研究基础薄弱,机制研究较少等,阻碍了民族医药的标准化与推广[18]。本研究从细胞水平揭示了水蛭素对尿酸排泄的可能机制,推测水蛭素可能是通过调节尿酸盐转运体的表达进而发挥降尿酸作用。本课题组对壮药金边蚂蟥及其活性成分水蛭素抗痛风效果的研究已有较多的基础,从动物水平和细胞水平系统阐述水蛭素抗高尿酸血症的作用及可能机制,为研制具有自主知识产权的高效低毒的抗高尿酸血症药物奠定了一定的基础,也为民族医药的开发建设提供了更多的参考资料。

