基于IL-17A/TNF-a信号通路的桔梗汤有效部位群干预COPD模型大鼠的实验研究*
张超云,李宏艺,郝鹏飞,高 丽,张仲鸣**
(1.南阳理工学院/河南省张仲景方药与免疫调节重点实验室 南阳473000;2.南阳仲景百信医药科技有限公司 南阳473000)
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Diseases,以下简称COPD),主要以气道不完全可逆性气流受限为特征,并可伴有气道高反应性,常与肺部对有害气体或有害颗粒的异常炎症反应有关[1,2],临床病例研究表明,该病具有进展迅速、预后不良、致死率高的特点,因此COPD一直是呼吸系统重点研究的方向之一。国内外的研究表明,辅助性T细胞17(T helper cell 17,以下简称Th17)及其特异性细胞因子在COPD的发病过程充当重要角色,参与介导COPD产生及进展过程中多个环节,尤以白细胞介素17(Interleukin 17,以下简称IL-17A)、肿瘤坏死因子(Tumor Necrosis Factor-α,以下简称TNF-α)、干扰素-α(Interferon-α,以 下 简 称IFN-α)、干 扰 素-β(Interferon-β,以下简称IFN-β)对于肺脏局部的炎症、自噬、纤维化等方面发挥重要作用,由于IL-17A、TNF-α、IFN-α、IFN-β等各类特异性细胞因子的异常高表达,加深加重了患者肺部病理变化,推进了COPD的发病进程[3-5]。也因此临床上常以药物对该类细胞因子是否具有调控能力,作为判断防治COPD是否有效的标准之一。
桔梗汤为《伤寒论》经方,方中主药桔梗为南阳“八大宛药”之一,俗称“桐桔梗”,为药食同源品种,近些年以桔梗为主的方剂依然保持了很高的使用频率,其与甘草配伍,主治肺痈,根据现代药理学研究,肺痈包含了部分COPD,因此现代临床也将该方用于COPD的预防与治疗,但截至目前,对于桔梗汤治疗COPD的研究均浅尝辄止,仅仅停留在理论讨论层面,尚未有更加深入的探讨。有鉴于此,本课题拟以桔梗汤治疗COPD为切入点,深入研究桔梗汤治疗COPD的药效物质基础及具体作用机制;而本文则是基于这样的背景,充分考虑了中药复方有效部位的研究现状和进展,参考了目前其它类似研究的方法[6],结合该方临床功效和应用,在前期分离所得桔梗汤总皂苷、桔梗汤总多糖、桔梗汤总黄酮等不同部位基础上[7],分别考察上述部位调控IL-17A、TNF-α、IFN-α、IFN-β等相关因子的作用,从而筛选桔梗汤防治COPD的有效部位,敲除无效部位,为桔梗汤的药效物质基础及微观配伍机理研究提供一定的依据。
1 实验材料
1.1 实验药物
方中中药饮片由南阳仲景百信医药科技有限公司提供,并由南阳理工学院中药教研室李超博士鉴定,桔梗(Platycodon grandiflorus(Jacq.)A.DC)、甘草(Glycyrrhiza uralensisFisch)两味药材均为2015版《中国药典》收载品种。其中桔梗汤总皂苷、桔梗汤总多糖、桔梗汤总黄酮均为实验室自制。
1.2 实验动物
大鼠40只,清洁级,雌雄各半,由河南省实验动物中心提供,体质量180±20 g,许可证号为SCXK(豫)2017-0001。随机分为5组,每组8只,分别为生理盐水组、模型组以及桔梗汤总皂苷组、桔梗汤总多糖组、桔梗汤总黄酮组。
1.3 实验试剂
乙醇、石蜡、二甲苯购自陕西圣瑞医药科技有限公司;水合氯醛购自武汉博士德生物工程有限公司;精制脂多糖(Lipopolysaccharide,以下简称LPS)购自默克化工技术(上海)有限公司;IFN-α、IFN-β、IL-17A检测试剂盒、TNF-α试剂盒购自南京建成生物工程研究所;帝豪香烟(河南中烟工业公司许昌卷烟厂,焦油量11 mg,烟气烟碱量1.0 mg,烟气一氧化碳量11 mg)。
1.4 实验仪器
自制烟熏箱(自制,亚克力玻璃);752-分光光度计(北京普析通用仪器有限责任公司);高速冷冻离心机(Sigma 2mk型);显微镜(日本OLYMPUS);全自动酶标仪(北京普朗新技术有限公司DNM-9802型);电泳仪(美国Bio-rad公司);FSH-2型可调高速匀浆器(金坛市恒丰仪器厂);WKY型微量移液器(德国艾本德)。
2 实验方法
2.1 COPD大鼠模型制作
参照宋一平[8]等经典的大鼠COPD模型构建方法,除了生理盐水组之外,模型组、桔梗总皂苷组、甘草总皂苷组及甘草总黄酮组大鼠均采用相同模型构建方法复制COPD大鼠模型,造模时间总计为42天。大鼠放入密闭烟熏箱(自制)内,每天对大鼠进行烟熏3次,每次20支香烟,每次烟熏时间各30 min,每次间隔6 h。第1天、第15天在大鼠气管内分别注入200 μL脂多糖(LPS,1 μg·μL-1),轻轻晃动,使注入的药物有效地分布于大鼠支气管粘膜的内表面,生理盐水组大鼠气管内注入200 μL生理盐水。
2.2 给药方法
从造模的第15天开始,桔梗汤总皂苷组、桔梗汤总多糖组、桔梗汤总黄酮组大鼠分别按照375 mg/kg/d、725 mg/kg/d、165 mg/kg/d灌胃(相当于成人10倍原方常用剂量,成人体重按60 kg计算),模型组和生理盐水组每天给予同体积生理盐水灌胃,连续28天。
2.3 血清制备方法
给药结束后,各组大鼠以10%水合氯醛麻醉后,腹主动脉下端采血,每只大鼠取血约5 mL,静置2 h后离心20 min,取上清,-80℃冰箱保存待测。
2.4 大鼠一般情况观察
造模及用药期间每日观察大鼠的呼吸情况,咳嗽、气喘、活动状况、毛发光泽等,记录体重变化等情况。数据使用均数士标准差(x±S)表示,利用SPSS19.0软件进行t检验。
2.5 COPD大鼠肺组织病理学观察
取气管与右侧下叶肺组织,4%多聚甲醛固定,脱水,石蜡包埋,常规切片(厚度3 um)。采用二甲苯脱蜡,然后进行苏木素染色,用流动的清水冲洗,经盐酸酒精分化,最后用蒸馏水冲洗,最后分别用100%、95%、80%、75%、50%的乙醇逐层脱水,苏木精-伊红染色,中性树胶封片,烘干,光学显微镜下病理观察[7]。并对染色病理切片的支气管壁厚度进行检测,在每张病理切片上随机选择气管横切直径在200~300 um范围内气管5支,测定各组大鼠气管壁厚度。数据使用均数士标准差(x±S)表示,利用SPSS19.0软件进行t检验。
2.6 ELISA法测定COPD大鼠血清中IL-17A、TNFa、IFN-a、IFN-β含量
参照酶联免疫吸附反应法(Enzyme-Linked ImmunoSorbent Assay,以下简称ELISA)[9],取出大鼠血清冷冻样本,室温解冻。每孔加入标准品稀释液或待测样品100 μL,37℃恒温箱中温育2 h,吸水纸拍干;每孔分别加入酶标抗体工作液100 μL,再次37℃恒温箱中温育1h,洗板液洗板3次,并吸水纸拍干;然后每孔加入底物工作液100 μL,置37℃恒温箱中闭光显色反应30 min;最后每孔加入50 μL终止液终止反应。在450 nm读取吸光值(A),然后绘制出A450 nm对细胞因子浓度标准曲线,根据待测样品A450 nm值,按照此步骤分别测定大鼠血清中IL-17A、TNF-a、IFN-a、IFN-β浓度。以上数据均使用均数士标准差(x±S)表示,并利用SPSS 22.0软件进行t检验统计分析,以P<0.05表示差异具有统计学意义。
3 实验结果
3.1 桔梗不同部位对COPD大鼠一般情况及体重影响的实验结果
生理盐水组大鼠毛发柔顺光滑有色泽,活动能力较强,无咳嗽、气喘等症状,进食进水正常,体重增长明显;COPD模型组大鼠毛发暗淡没有光泽,前期躁动不安,后期精神萎靡,个别大鼠四肢瘫软,有明显的咳嗽、气喘、打喷嚏等症状,呼吸急促,伴随腹肌抽搐,进食减少,进水增加,体重增长缓慢。桔梗汤不同部位组干预之后,总皂苷组和总黄酮组症状发展趋势向好,总多糖组无显著改善,以总皂苷组改善最明显,主要表现为咳嗽、气喘等症状改善,打喷嚏次数减少,呼吸明显平稳,精神状态好转,毛发柔顺且渐有光泽,体重有一定增加等。
各组大鼠体重变化如表1所示,模型组与生理盐水组比较有显著性差异(P<0.05),桔梗汤总皂苷组与总黄酮组和模型组比较均有显著性差异(P<0.05),桔梗汤总多糖组与模型组比较无显著性差异。此指标可初步排除桔梗汤总多糖组。
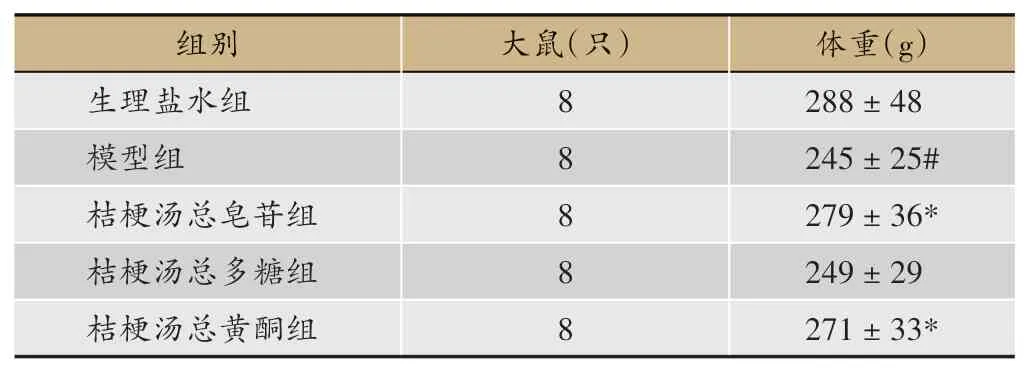
表1 不同组别大鼠体重变化(n=8,x±s,t检验)
3.2 桔梗汤不同部位对COPD大鼠肺组织病理学改变及气管壁厚度影响的实验结果
各组大鼠肺组织HE染色之后,显微镜下观察结果如下:生理盐水组大鼠支气管上皮细胞结构完整,支气管壁光滑,形态清晰,无异常分泌物,黏膜无充血水肿;模型组大鼠支气管柱状上皮细胞倒伏并有部分脱落,杯状细胞增多,大量炎性细胞分泌,黏膜充血水肿,支气管平滑肌增厚,肺泡扩张;桔梗汤总皂苷组和总黄酮组与模型组比较,支气管壁及支气管周围炎症细胞浸润均有所减少,已无明显的上皮细胞脱落,杯状细胞增生亦明显减少,肺泡扩张不明显;桔梗汤总多糖组与模型组比较无明显变化(图1)。

图1 各组大鼠肺组织病理切片(HE染色,200×)
各组大鼠气管壁厚度变化如表2所示,模型组与生理盐水组比较有显著性差异(P<0.05),表明COPD模型建立成功;经过4周给药后,桔梗汤总皂苷组、总黄酮组与模型组比较均有显著性差异(P<0.05),表明桔梗汤总皂苷、总黄酮可显著降低COPD模型大鼠的气管壁厚度,而经桔梗汤总多糖治疗后的COPD大鼠气管壁厚度与模型组比较无显著性差异,表明桔梗汤总多糖不能改善COPD模型大鼠的气管壁厚度。

表2 不同组别大鼠气管壁厚度(n=8,x±s,t检验)
3.3 桔梗汤不同部位对COPD大鼠血清IL-17A含量的实验结果
各组大鼠血清IL-17A含量如表3所示,模型组与生理盐水组比较有显著性差异(P<0.05),表明COPD模型大鼠血清中IL-17A含量异常增高;经给药治疗后,桔梗汤总皂苷组、总黄酮组和模型组比较均呈显著下降的趋势(P<0.05),表明桔梗汤总皂苷与总黄酮可干预COPD大鼠血清中IL-17A含量;而桔梗汤总多糖组与模型组比较无显著性差异,即桔梗汤总多糖不能改善COPD大鼠血清中IL-17A异常增高的症状。

表3 不同组别大鼠血清中IL-17A含量(n=8,x±s,t检验)
3.4 桔梗汤不同部位对COPD大鼠血清TNF-a水平的实验结果
各组大鼠血清TNF-a水平如表4所示,模型组与生理盐水组相比显著升高(P<0.05),桔梗汤总皂苷组、总黄酮组和模型组比显著下降,且具有统计学意义(P<0.05),桔梗汤总多糖组与模型组比较无显著性差异,即桔梗汤总多糖不能降低COPD大鼠异常升高的TNF-a水平。
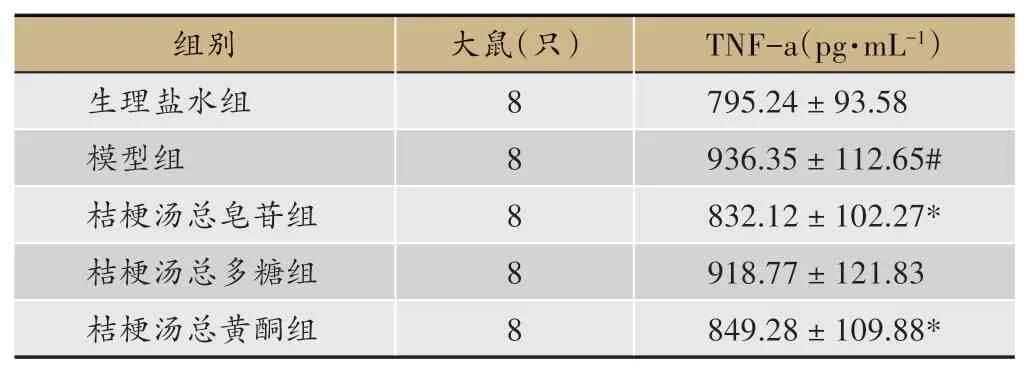
表4 不同组别大鼠血清中TNF-a水平(n=8,x±s,t检验)
3.5 桔梗汤不同部位对COPD大鼠血清IFN-α水平的实验结果
各组大鼠血清IFN-α水平如表5所示,模型组与生理盐水组比较有显著性差异(P<0.05),桔梗汤总皂苷组、总黄酮组和模型组比较均有显著性差异(P<0.05),桔梗汤总多糖组与模型组比较无显著性差异。
3.6 桔梗汤不同部位对COPD大鼠血清IFN-β水平的实验结果
各组大鼠血清水平如表5所示,模型组与生理盐水组比较有显著性差异(P<0.05),桔梗汤总皂苷组、总黄酮组和模型组比较均有显著性差异(P<0.05),桔梗汤总多糖组与模型组比较无显著性差异。

表5 不同组别大鼠血清中IFN-a水平(n=8,x±s,t检验)

表6 不同组别大鼠血清中IFN-β水平(n=8,x±s,t检验)
4 讨论
COPD病因病机比较复杂,临床治疗周期较长,预后不够理想,已然成为世界范围内致残率和死亡率较高的主要疾病之一,造成了严重的经济社会负担[10]。近年来研究表明,COPD的病机是遗传因素-环境因素经过一系列复杂的相互作用而形成的结果,这些致病因素会引起气道慢性变态反应性炎症,气道炎症是造成COPD气道重塑的主要原因。当肺部暴露在各种氧化应激因子下,可诱导中性粒细胞、巨噬细胞、细胞毒性T细胞等炎症细胞在肺部聚集,其中Th17细胞是此过程中的强大推手,主要由它分泌产生的各种细胞因子可有效介导气道炎症、细胞凋亡、T细胞平衡等,从而有力推进COPD的产生及进展[11]。
国内外诸多研究表明,Th17细胞的主要效应因子是IL-17,而IL-17作为诱导炎症反应的早期启动子,主要可通过促进效应细胞释放前炎性细胞因子,进而放大局部炎症反应,如:IL-17与相应受体结合后,可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核转录因子kB(Nuclear factor kB,NF-kB)途径发挥其促炎、募集中性粒细胞、激发自身免疫等生物学作用[12];还可通过死亡结构域蛋白通路(TNF receptor associated death domain,TRADD)参与诱导细胞凋亡[13,14]。此外,IL-17引发的促炎反应中,可进一步催化TNF-a、IFN-a、IFN-β的分泌,而这些炎症诱导因子又可作为其他受体蛋白/细胞的炎症启动信号,从而开启炎症-损伤-炎症的恶性循环,最终推动COPD不断进展[15,16](图2)。综上,遏制异常活跃的Th17细胞,控制其分泌的细胞因子IL-17,是预防治疗COPD的重要抓手,而TNF-a、IFN-a、IFN-β等相关细胞因子的表达,又可作为评判COPD是否有效的重要指标[17,18]。
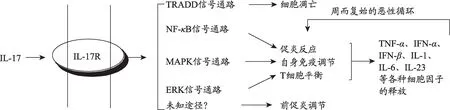
图2 IL-17信号通路示意图
在本文中,COPD模型组大鼠肺部结构发生显著病变,主要表现为气道粘膜炎症因子浸润、气管壁重塑、黏膜充血水肿及肺泡壁变薄等情况,另外COPD大鼠血清中IL-17A、TNF-α、IFN-α和IFN-β的表达显著高于生理盐水组(P<0.05),对于这些病理性改变,桔梗汤总皂苷及桔梗汤总黄酮均可显著改善,使COPD大鼠的支气管壁光滑,形态清晰,无异常分泌物,黏膜无充血水肿,并显著降低大鼠血清中IL-17A、TNF-α、IFN-α和IFN-β的表达;桔梗汤总多糖在上述方面的作用并不显著(图3),因此桔梗汤中防治COPD的有效部位群可能是桔梗汤总皂苷和桔梗汤总黄酮。

图3 各组大鼠血清中IL-17A、TNF-a、IFN-a、IFN-β的含量
综上,本论文首次将桔梗汤分成桔梗汤总皂苷、桔梗汤总多糖和桔梗汤总黄酮等不同部位,基于IL-17A/TNF-a信号通路,通过观察体重变化、肺组织病理切片、IL-17A表达、TNF-a表达、IFN-α表达和IFN-β表达等相关指标,分别考察不同部位对COPD大鼠模型的治疗作用。结果表明:桔梗汤总皂苷组和桔梗汤总黄酮组均可以不同程度的抑制炎症介质或细胞因子、改善肺部病理变化,恢复其正常功能,而桔梗汤总多糖组无明显作用,故可以初步排除桔梗汤总多糖组。本研究为桔梗汤的二次开发提供了科学依据,为桔梗汤的微观配伍提供理论支持,为相关课题的开展奠定了初步基础。而桔梗汤总皂苷和桔梗汤总黄酮是如何发挥此药效,两者之间是否存在有交互作用,这些科学问题还有待我们的进一步研究探讨。
——辨别味之苦甜

