CCT3在宫颈鳞癌组织中的表达及其对Hela细胞增殖和迁移能力的影响
蔡明博,金玉茜,徐苏龙,朱鹏飞,郭瑞霞
1)郑州大学第一附属医院妇科 郑州 450052 2)郑州大学第三附属医院盆底重建科 郑州 450052 3)郑州大学第一附属医院肝胆胰外科 郑州 450052
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,在很多发展中国家,即使给予标准治疗,宫颈癌患者的5 a生存率仍不足50%[1]。因此探索宫颈癌发病机制,寻找宫颈癌治疗新靶点,具有重要意义。伴侣蛋白携带t复合多肽1-亚基3(chaperonin containing tailless complex polypeptide 1-subunit 3,CCT3)定位于人1号染色体上[2]。CCT3作为伴侣蛋白复合体的一个重要亚基,在肝癌[3]、乳腺癌[4]、甲状腺癌[5]、胃癌[6]等多种恶性肿瘤中高表达,且与恶性肿瘤的发生、进展及预后密切相关。本研究检测了CCT3在宫颈鳞癌组织及癌旁正常组织中的表达,同时观察了抑制宫颈癌Hela细胞中CCT3表达对细胞增殖、迁移能力的影响,为宫颈癌靶向CCT3治疗提供实验依据。
1 材料与方法
1.1 宫颈组织标本获取收集2020年1~8月郑州大学第一附属医院妇科手术切除的宫颈鳞癌及癌旁正常组织标本共10对,患者年龄为35~65岁,临床分期为ⅠB期7例、ⅡA1期3例,术前均未接受任何治疗,标本均经病理证实。研究获得该院伦理委员会批准。组织标本获取后立即放入液氮中,然后转于-80 ℃冰箱中保存备用。
1.2 Hela细胞培养及分组Hela细胞购于中国科学院细胞库,常规在含体积分数10%胎牛血清的RPMI 1640、37 ℃、体积分数5% CO2及饱和湿度的条件下培养,2.5 g/L胰蛋白酶及0.2 g/L EDTA消化传代。取对数生长期细胞接种于6孔板中,每孔约5×104个细胞,培养至融合度达到50%左右时进行转染。将细胞分为空白对照组(正常培养)、阴性对照组(NC组,转染阴性对照shRNA)和干扰组(转染CCT3特异性shRNA)。CCT3 shRNA慢病毒及相应阴性对照慢病毒由上海吉凯基因公司构建,CCT3 shRNA序列为5’-CAAGTCCATGATCGAAATT-3’。细胞转染72 h荧光均达80%以上时,收集细胞检测干扰效果,并进行后续细胞学实验。
1.3 宫颈组织及Hela细胞中CCT3 mRNA表达的qRT-PCR检测取冷冻宫颈组织在液氮中经组织研磨管研磨。收集3组Hela细胞。使用MiniBEST Universal RNA提取试剂盒(日本TaKaRa公司)提取组织及细胞中的总RNA,检测样品RNA的纯度。使用HiFiScript cDNA合成试剂盒(康为世纪生物科技有限公司)将总RNA反转录为cDNA。选用GAPDH作为内参。qPCR扩增参照ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司)说明进行,引物由浙江尚亚生物技术有限公司合成。CCT3上游引物5’-AAGTCCATGATCGAAATTAGCCG-3’,下游引物5’-TGCTCAGCTACAGACAGCATT-3’,产物大小101 bp;GAPDH上游引物5’-GGAGCGAGATCCCTC CAAAAT-3’,下游引物5’-GGCTGTTGTCATACT TCTCATGG -3’,产物大小197 bp。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 60 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。采用2-ΔΔCt法计算CCT3 mRNA的相对表达量。实验重复3次。
1.4 宫颈组织及Hela细胞中CCT3蛋白表达的Western blot检测取小块宫颈组织标本,眼科剪剪碎,加入液氮研磨后用于提取组织总蛋白;收集3组Hela细胞用PBS清洗后用于提取细胞总蛋白。样品中加入RIPA裂解液及蛋白酶抑制剂,冰上静置30 min,每10 min吹打一次, 4 ℃ 12 000 r/min离心10 min,取上清液,BCA法测蛋白浓度,按每孔50 μg蛋白质上样。CCT3一抗为兔抗人多克隆抗体(英国Abcam公司),稀释度为1∶1 000;内参GAPDH一抗为兔抗人单克隆抗体(美国CST公司),稀释度为1∶1 000;二抗为辣根过氧化物酶标记的鼠抗兔IgG(武汉博士德生物工程有限公司),稀释度为1∶5 000。在暗室中,采用化学发光反应试剂盒(美国Thermo Scientific公司)进行发光,暗室曝光。条带采用Image J进行灰度分析,以目的蛋白条带与GAPDH条带灰度值的比值表示目的蛋白相对表达量。实验重复3次。
1.5 3组Hela细胞增殖活性的MTT法检测3组细胞铺于96孔板中,每孔细胞量约2 000个。各板细胞分别在37 ℃、体积分数5%CO2及饱和湿度条件下培养0、1、2、3、4、5 d后于每孔加入20 μL MTT溶液(5 g/L),继续培养4 h,吸弃孔中的液体。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,充分溶解结晶物,在酶标仪上于 570 nm波长处测量各孔的吸光度值,用Graphpad Prism 8.0绘制细胞增殖曲线。实验重复3次。
1.6 3组Hela细胞克隆形成能力的检测将3组细胞铺于6孔板中,每孔约1 500个细胞,连续培养14 d,每3 d换液并观察细胞状态。每孔加入1 mL 40 g/L多聚甲醛固定30 min,PBS清洗细胞,每孔加入1 mL结晶紫染液,染色约15 min,PBS洗涤数次,晾干,相机拍照。显微镜下观察、记录细胞克隆形成数(将≥50个细胞的聚集作为1个细胞克隆)。实验重复3次。
1.7 3组Hela细胞迁移能力的检测取3组细胞接种于6孔板中,细胞过夜贴壁,用无菌20 μL枪头垂直于细胞板,划直线,使用无菌PBS轻柔洗涤3次,洗去不贴壁的细胞,更换新鲜无血清培养基,在显微镜下观察,拍照记录划痕部位初始状态。将细胞继续放入37 ℃、体积分数5% CO2培养箱中培养24、48 h后取出,40倍显微镜下观察并拍照。分别对3组不同时间划痕内迁移细胞进行计数。实验重复3次。
1.8 NC组和干扰组细胞小鼠成瘤能力的检测10只6周龄雌性NOD-SCID小鼠由河南省实验动物中心提供,采用随机数字表法分成2组,每组5只,分别于小鼠前肢腋窝皮下注射NC组和干扰组Hela细胞悬液,100 μL/只(约106个细胞),出针后用无菌棉签按压出针处约5 s,以防液体溢出。小鼠继续在SPF级动物实验室饲养,每3 d用游标卡尺测量瘤体的长径和短径一次,20 d后处死小鼠,剥离皮下瘤体,称取质量。
1.9 统计学处理采用SPSS 20.0进行数据分析。宫颈鳞癌和癌旁正常组织中CCT3相对表达量的比较采用配对资料的t检验;2组小鼠移植瘤质量的比较采用两独立样本t检验;3组Hela细胞CCT3 mRNA和蛋白相对表达量、迁移细胞数、克隆形成数的比较均采用单因素方差分析和SNK-q检验。检验水准α=0.05。
2 结果
2.1 宫颈鳞癌和癌旁正常组织中CCT3 mRNA和蛋白表达的比较结果见表1。CCT3 mRNA和蛋白在宫颈鳞癌组织中的表达水平均明显高于癌旁正常组织。

表1 宫颈鳞癌和癌旁正常组织中CCT3表达水平的比较
2.2 3组Hela细胞中CCT3 mRNA和蛋白相对表达量的比较与空白对照组和NC组相比,干扰组中CCT3 mRNA和蛋白的表达水平均降低(图1和表2)。

图1 3组Hela细胞中CCT3蛋白的表达
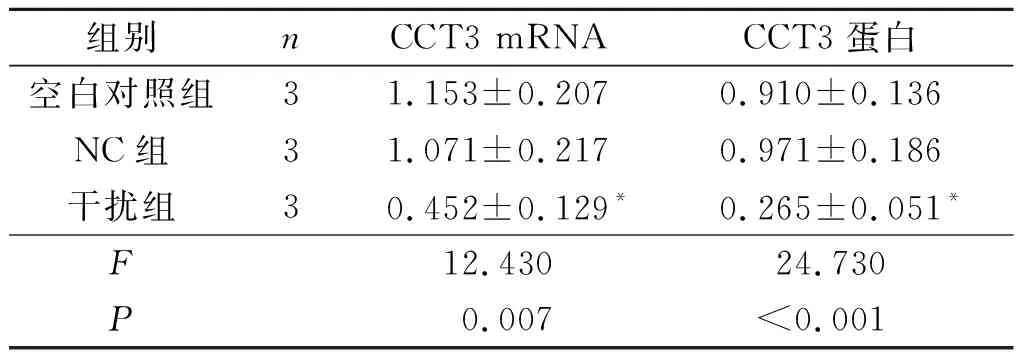
表2 3组Hela细胞CCT3 mRNA及蛋白表达水平的比较
2.3 3组Hela细胞增殖活性的比较3组细胞增殖曲线见图2。

图2 3组Hela细胞增殖曲线
2.4 3组Hela细胞迁移细胞数、克隆形成数的比较结果见表3。干扰组迁移细胞数、克隆形成数较空白对照组和NC组减少。

表3 3组Hela细胞迁移细胞数和克隆形成数的比较
2.5 NC组和干扰组细胞小鼠成瘤能力的比较结果见表4。干扰组移植瘤的质量低于NC组。
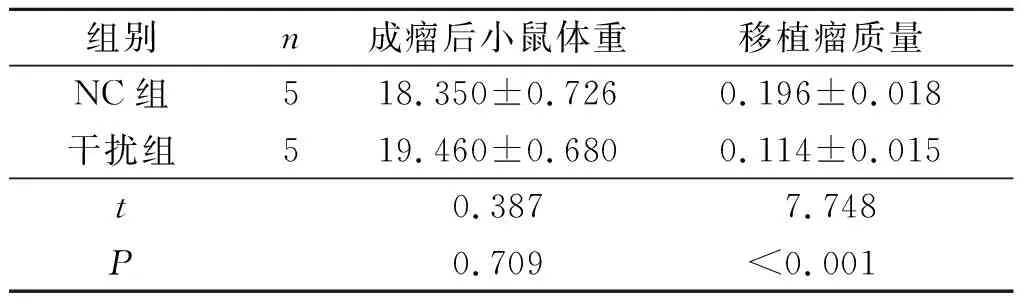
表4 NC组和干扰组细胞小鼠成瘤能力的比较 g
3 讨论
宫颈癌的发病率和病死率均居女性恶性肿瘤前列,其发病机制、早期诊断、预后评估是研究的重点,难治性的复发及转移性宫颈癌预后往往较差[7]。CCT3作为CCT复合体的一个重要亚基,可协助多种蛋白的折叠及重折叠过程,包括与细胞生长和分裂有关的细胞骨架蛋白[8]、与肿瘤及细胞周期相关调节蛋白[9-10]等。CCT3在多种肿瘤中高表达,且与肿瘤增殖、转移、预后等密切相关[11-13]。有研究[3]表明CCT3在肝癌组织中的表达明显高于癌旁正常组织,抑制肝癌细胞中CCT3的表达可降低细胞增殖活性;敲低甲状腺癌细胞中CCT3的表达后,细胞增殖活性明显受到抑制,凋亡增加[5]。本研究结果提示:CCT3 mRNA和蛋白在宫颈鳞癌组织中的表达较癌旁正常组织明显升高;下调Hela细胞中CCT3表达后,细胞增殖活性和克隆形成能力明显降低,细胞在小鼠体内的成瘤能力明显降低。以上实验结果提示:CCT3在体内外均可通过调控宫颈癌细胞增殖影响肿瘤发生、进展。
CCT复合体的活性与细胞骨架的完整性密切相关,新合成的肌动蛋白和微管蛋白单体必须依赖CCT复合体方可形成其活性的天然构象,CCT表达异常影响细胞侵袭和转移[8,14]。在肝癌[15]、肺癌[16]、乳腺癌[4]等恶性肿瘤中,CCT复合体不同亚单元的高表达可促进细胞侵袭和转移。本研究中,下调Hela细胞中CCT3表达后,细胞迁移能力明显降低。
综上所述,CCT3在宫颈鳞癌组织中高表达,下调Hela细胞中CCT3表达可以抑制细胞增殖和迁移能力。CCT3可能成为宫颈癌早期诊断、治疗及预后评价的新靶点。

