肝动脉化疗栓塞联合替雷利珠单抗成功转化不可切除肝细胞癌一例报道及探讨
江强,巢家硕,朱齐,安潇,袁琳,王兆文,孙红成
(1.上海市第一人民医院 肝胆外科,上海 200080;2.江苏省南通市通州区人民医院 普外科,江苏 南通 226399)
肝细胞癌(简称肝癌)是严重威胁人类健康的恶性肿瘤。大多数肝癌患者在确诊时已属中晚期,由于缺乏有效的治疗方法患者预后较差[1]。肝动脉化疗栓塞(TACE)是目前治疗中晚期肝癌的重要方法[1-2]。TACE能使一些肝癌缩小,将不可切除肝癌转化为可切除,并可行序贯挽救性切除,使患者获得与可切除肝癌相同的预后,但仅7%~18%的患者可实现转化[3-5]。近年来,TACE在肝癌治疗相关免疫反应方面的研究不断深入。一方面,TACE杀死肝癌细胞并引起肿瘤相关抗原释放,从而促进肿瘤特异性CD8+T细胞反应[6];另一方面,TACE诱导肝癌中程序死亡受体1(PD-1)和程序死亡配体1(PD-L1)的表达,可抑制抗肿瘤免疫反应[7]。因此,TACE联合免疫检查点抑制剂(ICIs)可能会协同优化肿瘤免疫反应,最大程度获得抗癌效应,成为提高肝癌转化效率的有效策略。替雷利珠单抗是一种人源化IgG4抗PD-1单克隆抗体,I期和II期临床试验结果显示替雷利珠单抗具有较好的抗肝癌活性[8]。本文回顾上海市第一人民医院1 例乙肝肝硬化伴不可切除肝癌患者的诊治经过,分析其临床病理资料特征,验证了TACE联合替雷利珠单抗在肝癌转化治疗中的潜在价值。
1 临床资料
患者男性,45 岁,因“乏力伴右上腹隐痛不适一月”于2020年6月3日入院,既往有慢性乙型病毒性肝炎(HBV)和肝硬化。查体:腹部平软,全腹未及压痛、反跳痛,未触及包块。实验室检查:乙肝两对半HBsAg(+)、Anti-HBe(+)、Anti-HBc(+)、HBeAg(-)、Anti-HBs(-),乙肝病毒DNA 2.29×103拷贝数/mL;甲胎蛋白(AFP)>1 210 ng/mL,异常凝血酶原(PIVKA-II)466 mAU/mL;总胆红素15 μmol/L、白蛋白30.6 g/L、前白蛋白41.5 mg/L、丙氨酸氨基转移酶(GPT)193.9 U/L、天冬氨酸氨基转移酶(GST)289.83 U/L;凝血酶原时间(PT)13.5 s、活化部分凝血活酶时间(APTT)29.4 s。肝脏增强磁共振(MRI)发现一个巨大不规则病灶,大小约15 cm×12 cm,位于第7、8段(S7、S8)(图1A、B)。右肝静脉(RHV)被肿瘤包围,中肝静脉(MHV)与肿瘤紧密相邻(图1A),肿瘤在第一肝门处累及右前叶肝蒂(图1B),未发现肝外转移。根据肿瘤典型的影像学特征、高AFP、PIVKA-II水平和HBV相关性肝硬化,诊断为肝细胞癌,无需活检。东部肿瘤协作组体能评分(ECOG-PS)评分为0分,Child-Pugh评分为6分,终末期肝病模型(MELD)评分为8分。
经多学科治疗(MDT)专家组讨论后,患者接受超选择性TACE(奥沙利铂、表柔比星和碘油),1周后静脉注射200 mg的替雷利珠单抗。TACE和替雷利珠单抗每4周重复1次。采用改良RECIST评估治疗效果,2个疗程后,MRI发现肿瘤体积明显缩小并有大规模的坏死(图1C、D)。在接受第3个疗程的替雷利珠单抗治疗的2 周后MRI再次评估,肿瘤边界清晰,体积继续缩小,减轻了对RHV的压迫(图1E、F),达到放射学完全反应(rCR)。在3个疗程中,均未发现免疫相关不良反应(irAE)。通过切除S5、S8和部分S7肝段实现肿瘤的根治性手术切除,并保留了S6和部分S7肝段确保残肝(FLR)足够。中肝静脉(MHV)与肿瘤分离,肿瘤累及的右前叶肝蒂与第一肝门分离,AFP、PIVKA-II和中性粒细胞-淋巴细胞比率(NLR)降低,白蛋白、前白蛋白水平增加,凝血酶原时间缩短(图2)。
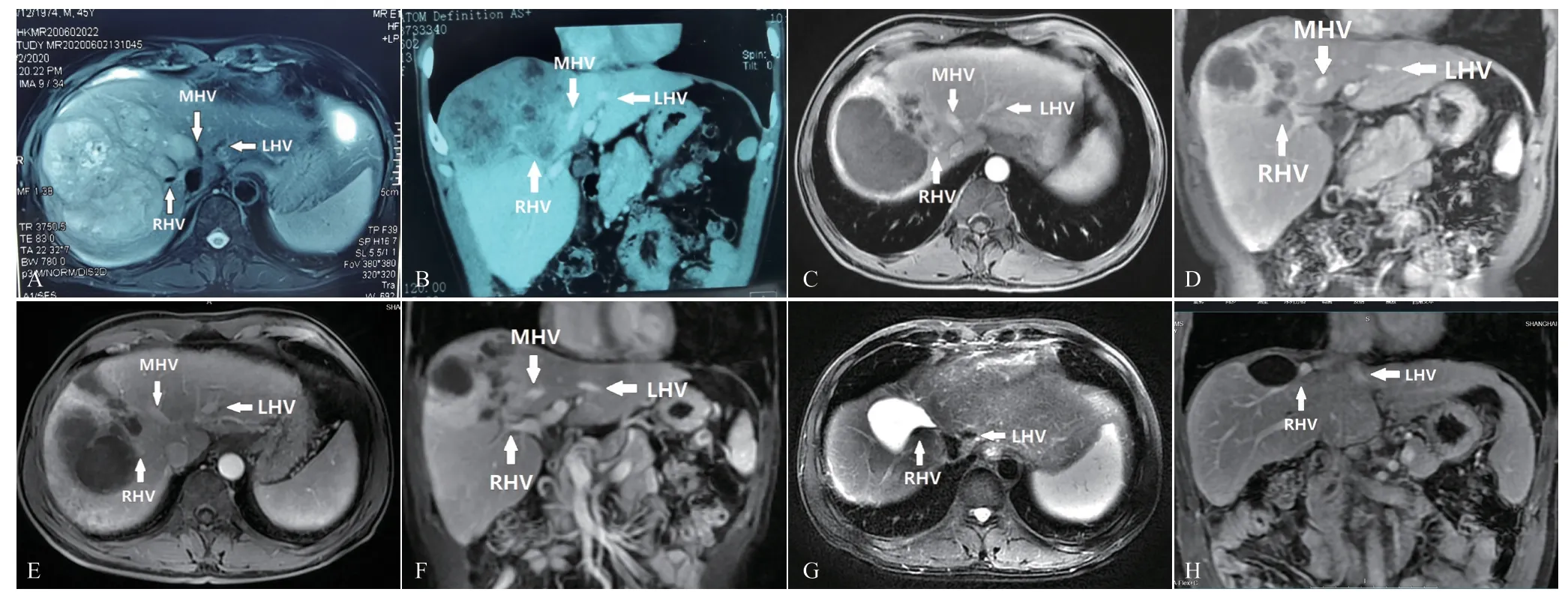
图1 不同治疗阶段的乙肝肝硬化伴不可切除肝癌患者腹部MRI增强扫描
手术后患者恢复顺利,无并发症,术后第8天出院。病理检查报告肿瘤组织完全坏死,两个主要病变,直径分别为10 cm和4.7 cm,伴有小卫星结节,周围非肿瘤组织出现淋巴细胞大量浸润和大量肉芽肿性炎症(图3)。术后1个月患者接受1次TACE辅助治疗,继续3周1次静脉注射替雷利珠单抗,规范随访,目前术后生存10个月,无肿瘤复发的迹象。
2 讨论
TACE序贯挽救性切除对初治不可切除肝癌患者具有良好疗效。然而,单独使用TACE转化率低,挽救性切除只在小部分患者中成功实施[3-4]。为了提高肿瘤反应率,TACE联合分子靶向药物的方案得到广泛关注,但是先前TACE联合酪氨酸激酶抑制剂(如索拉菲尼等)的临床研究并未展示比单独使用TACE更优的抗肿瘤效果[9]。近年来,ICIs(如PD-1、PD-L1和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抑制剂)对进展期肝癌具有理想的疗效[10]。虽然ICIs在一线、二线单药治疗晚期肝癌中均未显著改善患者生存率,但是其作为联合用药的一部分,具有协同效应,比如阿替珠单抗和贝伐珠单抗的联合方案较索拉非尼显示出更好的总体生存率和无进展生存率[11]。有文献报道,TACE可以引起肝癌细胞和肿瘤内炎症细胞的PD-L1 表达,以及肿瘤内炎症细胞PD-1表达[7]。因此,应用PD-1/PD-L1抑制剂可以通过抑制T淋巴细胞的PD-1/PD-L1信号通路来增强TACE的疗效。本案例中我们联合使用TACE和替雷利珠单抗成功转化序贯挽救性切除初治无法切除的大肝癌,在两个疗程的联合转化治疗后,MRI发现肿瘤体积明显缩小并有大规模的坏死(图1C、D)。同时,中肝静脉(MHV)与肿瘤分离,肿瘤累及的右前叶肝蒂与第一肝门分离,AFP、PIVKA-II和中性粒细胞-淋巴细胞比率(NLR)降低反映了肿瘤负荷的减轻(图2)。白蛋白、前白蛋白水平的增加以及凝血酶原时间的缩短表明肝功能改善(图2)。在3个疗程后,MDT专家组评估肿瘤可行根治性切除:(1)右前叶Glisson鞘的起始部清晰(图1F),可以精确切断右前叶肝蒂,而不影响S6肝段血供。(2)肿瘤存在包膜并且rCR,允许沿RHV安全切除肿瘤,保留了S6、S7肝段流出道。术后病理显示肿瘤完全坏死(图3A),这些都表明TACE联合替雷利珠单抗具有更强的抗肿瘤效应,而这种效应很难通过单用TACE来实现。
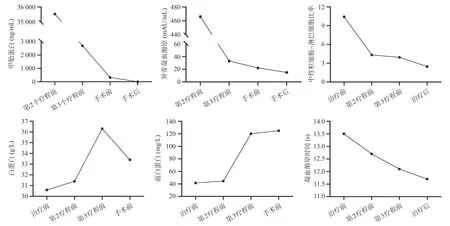
图2 治疗过程中肿瘤标志物水平、全身炎症指数和肝功能的动态变化
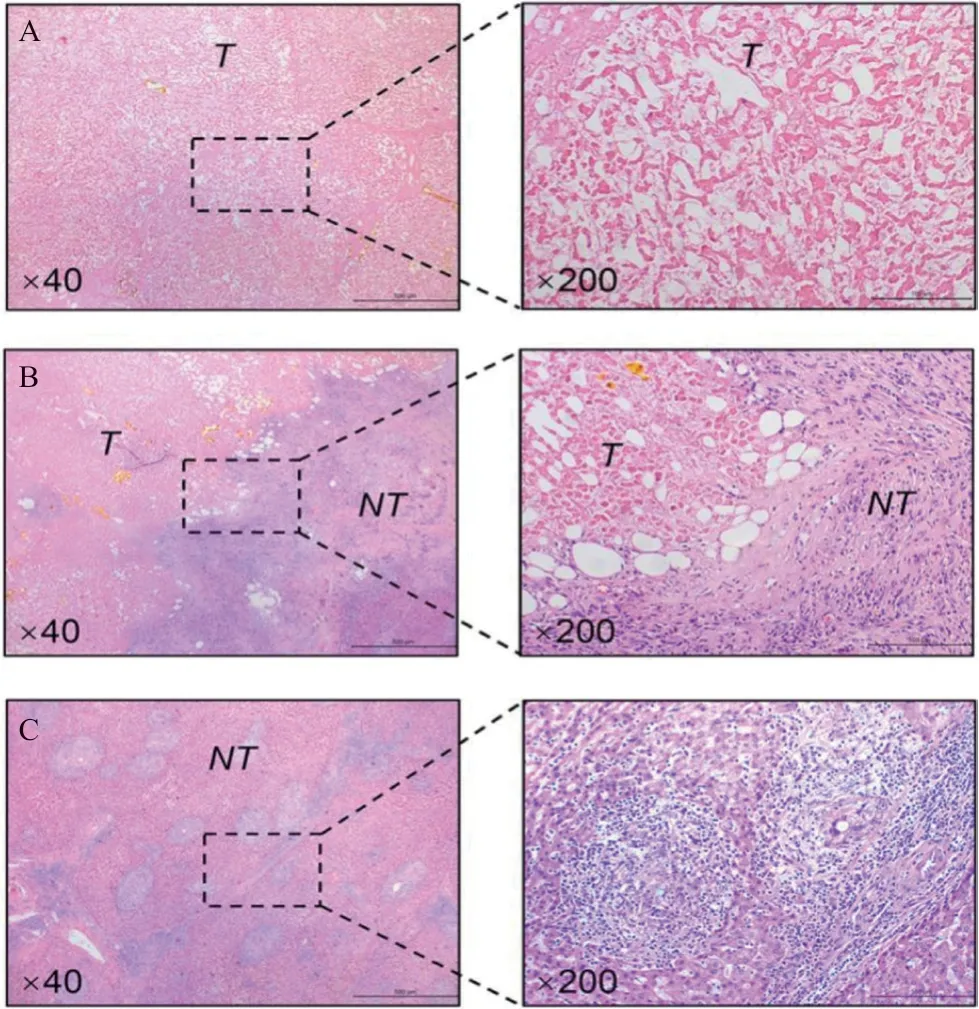
图3 切除标本的病理结果(HE染色)
近年来,新辅助或转化治疗在提高肿瘤R0 手术切除率、降低淋巴结阳性率、改善患者无瘤生存时间等方面的作用被广泛认可,已成为指南推荐的临界可切除和局部进展期乳腺癌、结直肠癌、胃癌、胰腺癌等多种实体癌治疗的首选治疗方法。本案例联合使用TACE和替雷利珠单抗成功转化大肝癌,提示TACE联合ICIs的新辅助或转化治疗方案在初治无法切除的肝癌治疗中具有良好的前景。然而,本案例有以下问题仍然值得探讨:(1)何时开始使用ICIs,是在TACE之前、同时还是之后?据报道,接受ICIs治疗的患者约16%会发生肝毒性相关的免疫相关不良反应[12],所以联合使用TACE和ICIs时应注意肝毒性的安全性问题。浙江大学附属第一医院正在进行的一项临床试验(NCT04174781),针对超出Milan标准的巴塞罗那(BCLC)分期A期和B期肝癌新辅助治疗方案中同时使用TACE和PD-1单抗。本案例中我们在TACE后间隔1周使用替雷利珠单抗,可以避免肝毒性副作用的叠加。(2)需要行多少次TACE?TACE应按肿瘤反应并遵循“按需”的原则,如果出现肿瘤耐受,则不应继续进行[2]。本患者在接受TACE的第1次和第2次疗程后均出现持续5~7 d高热的情况,我们认为发热是TACE治疗后的反应,反映肿瘤坏死而不是肝实质损伤,因为TACE采用超选技术来避免副损伤。事实上,在两次疗程后,MRI观察到肿瘤广泛坏死,表明肿瘤对TACE的反应良好。(3)肿瘤达到rCR后,是否需要行挽救性切除术?据报道,TACE后的挽救性切除术并没有给rCR的肝癌患者带来生存获益,但改善了部分反应的肝癌患者的总生存期[5]。16例rCR的肝癌患者手术切除标本中,有9 例发现仍有残留的活肿瘤细胞[4]。另有文献报道,TACE术后出现rCR的肝癌,2/5的患者的肿瘤坏死组织周围发现存活的肿瘤细胞[3]。这些数据表明,有rCR并不代表肿瘤真正完全坏死,仍有肿瘤细胞死灰复燃风险。本案例中,3个疗程后MRI提示rCR,但AFP水平仍然较高(322 ng/mL),提示活性肿瘤细胞残留可能。因此,有必要行挽救性切除手术,以完全清除残留的肿瘤细胞。不出所料,术后患者的AFP水平恢复正常。(4)肉芽肿性炎症和淋巴细胞浸润表明什么?TACE联合替雷利珠单抗是否有协同作用?本案病理检查发现癌旁肝组织内存在众多炎性肉芽肿,肿瘤边缘大量淋巴细胞浸润。我们回顾性检查了12例在TACE后接受挽救性切除的肝癌患者的标本,但未观察到大量淋巴细胞浸润或炎症性肉芽肿(图4)。此外,炎性肉芽肿在单独接受ICIs治疗的肝癌患者中也很罕见。Simoes等[13]对20例术前接受纳武利尤单抗的肝癌患者的标本进行评估时发现,仅1 例显示癌旁肝组织内有肉芽肿性炎症(该病例还显示完全的肿瘤坏死)。我们认为,大量的淋巴细胞浸润和炎性肉芽肿,可能提示TACE联合替雷利珠单抗激活了机体抗肿瘤免疫反应。但是也有学者认为炎性肉芽肿可能是肝毒性一种表现[12],本患者在治疗期间的肝功能逐渐改善(图2),炎症性肉芽肿和淋巴细胞浸润合理的解释应是机体抗肿瘤免疫反应增强,从而破坏肿瘤,改善肝功能。
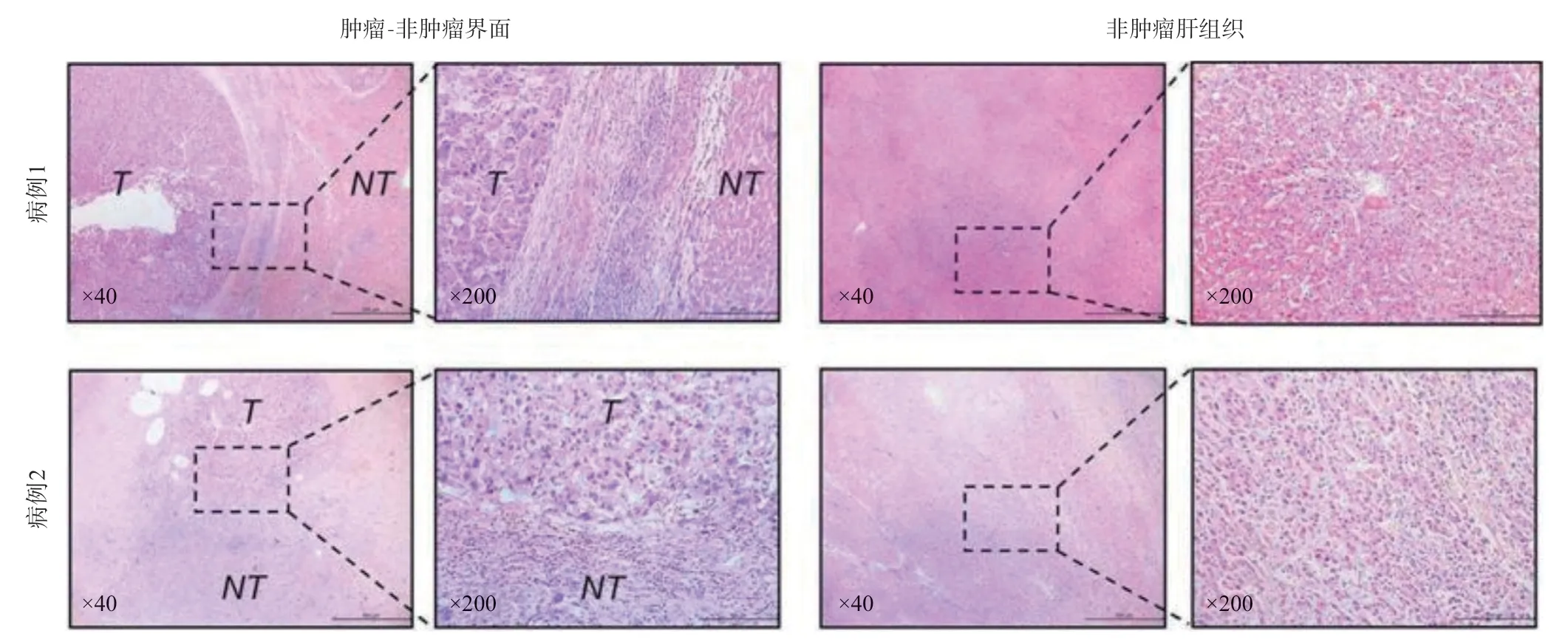
图4 12例在TACE后接受挽救性切除的肝癌患者中的2例典型病理结果(HE染色)。在“肿瘤-非肿瘤界面”(图左),可以观察到肿瘤一侧的活肿瘤细胞和非肿瘤一侧的轻度淋巴细胞浸润。在“非肿瘤肝组织”(图右),无法观察到肉芽肿性炎症。缩写:T:肿瘤组织;NT:非肿瘤肝组织。
总之,TACE联合PD-1 可能是初治不可切除肝癌的一种有效转化治疗策略。如果肿瘤展现良好的治疗反应,并且技术上允许切除,应考虑挽救性切除手术彻底消灭肿瘤。新辅助或者转化治疗在肝癌中的地位及其有效性和安全性仍然需要多中心随机对照临床试验来证实。

