PAQR4在肝细胞癌组织中的表达及其在细胞增殖、迁移和侵袭中的作用
康星凯,卢文勇,蔡慧欣,杨文军
(温州医科大学附属第一医院 肝胆胰外科,浙江 温州 32500)
肝细胞癌(HCC)是全球最常见的癌症之一,复发和转移的发生率高,患者的生存率低[1-2]。HCC的高病死率与缺乏早期诊断的相应指标有关,往往在诊断出HCC时患者多已经到了中晚期,并已发生转移[3]。因此,寻找HCC早期诊断及治疗的标志物具有很大意义。人孕激素和脂联素受体(progestin and adipoQ receptor,PAQR)家族目前已发现的成员有11个,被命名为PAQR 1至11。近来研究已发现,PAQR4 在乳腺癌[4]、胃癌[5]、非小细胞肺癌[6-7]中上调,促使疾病进展、提示预后不良。然而目前有关PAQR4在HCC中的表达和作用机制仍不清楚。本研究拟通过TCGA数据库分析PAQR4在HCC组织中的表达,并通过实验研究敲低PAQR4后分析肝癌细胞的增殖、侵袭和迁移情况,探讨PAQR4在HCC中产生作用的可能机制。
1 材料和方法
1.1 生物信息分析
本研究采用的基因表达数据和临床资料来源于TCGA数据库(http://cancergenome.nih.gov/)。临床病理资料包括患者的年龄、性别、家族癌症史等信息。
1.2 细胞培养
本实验使用了两种HCC细胞系Hep3B和Huh-7,购自美国模式培养物集存库(ATCC)。Hep3B细胞在添加丙酮酸钠、10%胎牛血清和1%青霉素-链霉素的DMEM中培养。Huh7 细胞在添加10%胎牛血清和1%青霉素-链霉素的DMEM中培养。细胞培养在37 ℃、5% CO2、饱和湿度条件的培养箱中,并视细胞的生长情况及时对细胞进行传代。
1.3 转染
使用两种siRNA下调Hep3B和Huh7 中PAQR4的表达,由吉玛基因公司合成。siPAQR4-1 序列:5’-AGGCUCCGUGCUCUAUCACTT-3’,5’-GUGAU AGAGCACGGAGCCUGC-3’;siPAQR4-2序列:5’-U CUUGCUCUGAGAGUUCAATT-3’,5’-UUGAACUC UCAGAGCAAGACG-3’。使用Lipofectamine2000(Life Technologies)将siPAQR4-1、siPAQR4-2和对照siRNA转染到Hep3B和huh7中,后续根据操作说明完成。将待处理细胞在6孔板中进行铺板,贴壁过夜后,待细胞达到60%左右,进行siRNA转染实验,(单转,终浓度为10 nmol/L siRNA),对照组转入等量对照siRNA,对照siRNA为和目的基因的序列没有同源性的普通阴性对照的siRNA,并于培养箱培养6 h后换回原培养基。
1.4 PAQR4表达水平检测
使用Trizol法,根据操作说明提取RNA,并使用分光光度计测量OD260、OD280数值,估算提取到的RNA的浓度及质量。根据TaKaRa公司说明书严格进行逆转录及实时定量聚合酶链(RT-PCR)反应。每组3个复孔,以GAPDH为内参,使用伯乐(Bio-Rad)实时定量PCR仪器检测。所用的引物序列为:PAQR4(F-5’-CGAACTGGGCAACATCTACA-3’;R-5’-AGGG TGTTGACAAGGCAGAC-3’),GAPDH(F-5’-GCAA ATTCCATGGCACCGTC-3’;R-5’-CCTGGAAGATG GTGATGGGA-3’),PAQR4的相对表达量采用2-△△Ct法计算。
1.5 PAQR4蛋白表达水平检测
采用Western blotting法。对Hep3B和Huh7进行转染操作后换回原培养基培养48 h,进行提蛋白,通过聚丙烯酰胺凝胶电泳并转移到PVDF膜上,5%脱脂牛奶中封闭1 h后,使用PAQR4抗体(13401-1-AP,proteintech)和GAPDH抗体(2118S,Cell Signaling Technology)作为一抗孵育,抗体均以1:1 000进行稀释,4 ℃摇床过夜,PBS洗膜3次后,用辣根过氧化物酶结合的二抗室温孵育1 h,PBS洗膜3 次后再用ECL plus试剂进行曝光,观察。
1.6 细胞增殖能力检测
采用MTS法。本研究使用MTS试剂盒(Promega)进行细胞增殖实验。使用96孔板,加入100 μL培养基。Hep3B和Huh7均为2 000个细胞/孔。在培养0、24、48 h后96孔板内分别加入20 μL的MTS溶液,置于37 ℃、5% CO2的恒温培养箱中孵育4 h,然后使用多功能酶标仪对各孔在570 nm波长下的OD值进行测量。然后依据所测到OD值数据绘制出细胞的增殖曲线。
1.7 细胞迁移和侵袭能力检测
Transwell小室进行迁移和侵袭实验,本研究使用的为24孔板,培养孔中放置8 μm孔径的普通(用于评估迁移)或基质凝胶涂层(用于评估侵袭)的transwell插入物(Costar)。
下室中加入500 μL DMEM(含10%胎牛血清)。Hep3B或huh7细胞转染24 h后,用PBS洗涤2次,重悬于200 μL无血清培养基(2×104个/孔)中,加入上室。37 ℃、5% CO2培养24 h后,将迁移到下室的细胞在多聚甲醛中进行20 min的固定,再使用20%乙醇0.01%结晶紫溶液对细胞进行染色。10 min后,使用棉签手动擦拭过滤器顶部未迁移的细胞。然后进行拍照。
1.8 统计学分析
采用SPSS 22.0对实验数据进行处理与分析,计量资料采用()表示,两组比较采用独立样本的t检验。组间比较采用Pearson卡方检验。采用Kaplan-Meier法进行生存分析。采用Pearson卡方检验进行PAQR4 表达与免疫细胞相关性分析。P<0.05 表示具有统计学意义。
2 结果
2.1 PAQR4在HCC组织中表达上调
首先从TCGA数据库中下载369 例HCC组织和50例癌旁组织的PAQR4 mRNA表达水平相关数据。分析发现,HCC组织中PAQR4 mRNA水平明显高于癌旁组织(P<0.05)(图1A)。
进一步在TCGA数据库中收集基因表达数据。生存分析显示,HCC患者组织中PAQR4高表达患者较PAQR4 低表达患者生存生存期短(P=0.0014)(图1B)。进一步分析两组临床病理特征发现,PAQR4的表达与年龄、家族癌症史、肿瘤组织学分级、TNM分期存在相关性,提示PAQR4高表达可能与这些因素有关(表1)。

表1 TCGA数据库中350例HCC患者PAQR4低表达组与高表达临床病理特征比较

图1 PAQR4在HCC组织中的表达比较(A)及PAQR4与HCC预后的相关性(B)
2.2 PAQR4调控HCC的细胞增殖能力
将两种不同的siRNA 转染到Hep3B 细胞和Huh7 细胞中,通过PCR检测PAQR4 RNA,观察肝癌细胞中PAQR4 的表达情况。结果表明,转染si-PAQR4-1、siPAQR4-2、siCon后Hep3b细胞中PAQR4的表达量分别为(0.714±0.076)、(0.492±0.157)、(1.001±0.001),差异具有统计学意义(图2A,P<0.05);Huh7 细胞中PAQR4 的RNA表达量分别为(0.477±0.155)、(0.304±0.107)、(1.001±0.000),差异具有统计学意义(图2B,P<0.05)。

图2 转染siRNA后HCC细胞系Hep3B(A)和Huh7(B)中PAQR4的RNA表达量(*P<0.05)
研究通过Western blotting检测Hep3B和Huh7中PAQR4 的蛋白表达量(图3),分析发现,敲低后PAQR4的表达量确实降低,表明本实验采用的敲低PAQR4模型可用于后续的研究。
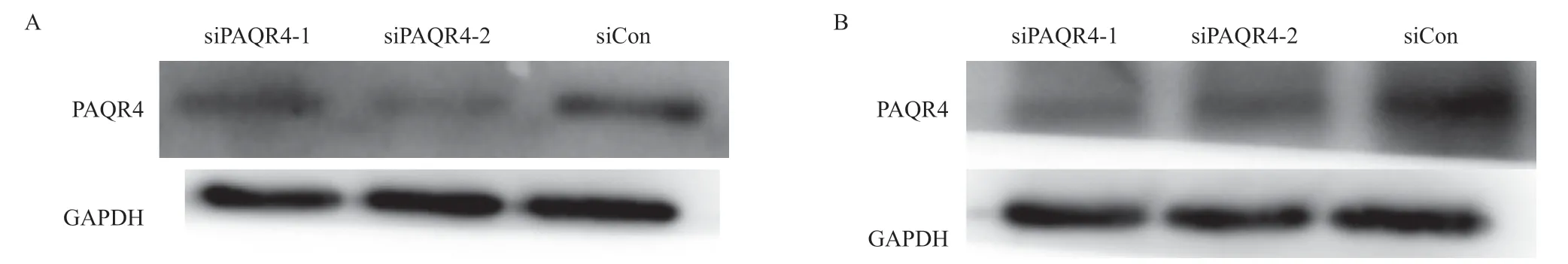
图3 转染siRNA后HCC细胞系Hep3B(A)和Huh7(B)中PAQR4的蛋白表达量
MTS细胞增殖能力检测结果表明,敲低PAQR4后细胞的吸光度值低于阴性对照,差异具有统计学意义(P<0.05,图4),这提示敲低PAQR4 会导致Hep3b和Huh7细胞的增殖能力减弱。
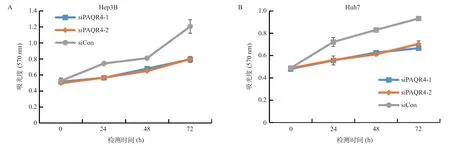
图4 HCC细胞系Hep3B(A)和Huh7(B)细胞增殖情况
2.3 PAQR4调控HCC的细胞侵袭和迁移能力
用Transwell实验分析敲低PAQR4 后HCC的细胞侵袭和迁移能力,结果表明,PAQR4在Hep3B和Huh7细胞中的表达下调导致细胞侵袭和迁移能力下降,穿过小室的细胞数量少于阴性对照组(图5)。
2.4 PAQR4表达与免疫细胞相关
免疫系统细胞浸润肿瘤,是肿瘤微环境的重要组成部分。Bindea[8]报道免疫细胞类型的特征基因集。因此,本研究评估了PAQR4的表达是否与HCC组织中的免疫细胞浸润有关,通过计算免疫细胞的特征基因集,利用GSVA(R包)的ssGSEA算法[9]分析HCC中这些免疫细胞类型的相对数量,以TPM值计算mRNA表达量。mRNA表达的标准化值以log2转化值表示。通过TCGA GDC门户网站(http://portal.gdc.cancer.gov/),获取HCCmRNA表达数据,然后计算PAQR4表达与免疫细胞浸润的Pearson相关性。
研究发现,PAQR4的表达与HCC组织中中性粒细胞、树突状细胞、细胞毒性细胞、调节性T细胞、T辅助型17(Th17)细胞、B细胞、未成熟树突状细胞、T细胞、CD8 T细胞、浆细胞样树突状细胞等免疫细胞浸润呈负相关,而与T辅助型2(Th2)细胞、效应记忆性T细胞、NK细胞、滤泡辅助性T细胞、CD56bright NK细胞的浸润呈正相关(图6、表2)。

表2 PAQR4表达与不同免疫细胞浸润的相关性分析

图6 PAQR4表达与不同免疫细胞浸润的关系
3 讨论
当前,HCC的治疗方法首选手术,但中晚期肝癌往往已经出现癌灶转移,治疗效果受限。肝移植也仍存在疾病复发等局限性。因此,寻找有效的肝癌治疗策略迫在眉睫[10-11]。
PAQR4属于PAQR家族,该家族在2005年首次被发现,具有7个跨膜拓扑结构域[12]。2017年Wang等[13]发现PAQR4 在细胞增殖中起着至关重要的作用。已有的研究表明,PAQR4可在多种癌症中高表达,并对癌症进展起到重要的作用。在乳腺癌中,PAQR4能够通过抑制CDK4的降解和泛素化,起到促肿瘤的效果[4]。在前列腺癌中,敲低PAQR4 能够抑制癌增殖、迁移、侵袭,还能够抑制上皮间充质转化(EMT)[14]。但截止目前,PAQR4在HCC中的表达与机制尚不清楚,需要进一步探讨。
本研究通过分析TCGA数据库发现,与正常的肝组织进行相比,PAQR4在肝癌组织中的表达上调;临床病理特征分析发现,PAQR4的表达与年龄、肿瘤组织学分级、TNM分期有关,这说明PAQR4对肝癌发生和进展具有促进作用。因此,PAQR4有望成为判断肝癌的一个新的生物标记物以及治疗靶点。PAQR高表达与肝癌患者预后较差存在着相关性,因而PAQR4可能成为一个潜在的预后指标。本研究通过siRNA敲低PAQR4导致HCC细胞系Hep3B和Huh7中的细胞增殖、侵袭和迁移能力遭到抑制,这进一步证实PAQR4在肝癌中的促进作用,也与其他文献中的PAQR4可促癌的结论一致。因此,我们的研究结果有助于进一步明确肝癌发生发展的机制。
近年来,car-t细胞疗法、免疫检查点抑制剂疗法等免疫治疗策略成为热点[15]。肝脏是重要的免疫器官。肿瘤微环境中免疫细胞组成和比例的变化对肿瘤的发展也起着至关重要的作用[16]。本研究发现,PAQR4的表达与肝癌组织中中性粒细胞、树突状细胞、细胞毒性细胞、调节性T细胞、T辅助型17(Th17)细胞、B细胞、未成熟树突状细胞、T细胞、CD8 T细胞、浆细胞样树突状细胞等免疫细胞浸润呈负相关,而与t辅助型2(Th2)细胞、效应记忆性T细胞、NK细胞、滤泡辅助性T细胞、CD56bright NK细胞的浸润呈正相关。PAQR4可能会影响这些免疫细胞的数量,从而最终改变各种细胞分泌物的多少,改变肿瘤的微环境。在未来我们需要进一步明确为何PAQR4导致了免疫环境的这种变化,及其在肝癌发生发展过程中的机制,这将会有助于我们制定靶向免疫治疗策略,为今后肝癌的治疗提供新的途径。

