维生素D佐治特发性荨麻疹患者的效果及对其T淋巴细胞亚群、体液免疫水平的影响
李双凤,马超,王伟,吴玉红
(安徽省阜阳市人民医院,安徽 阜阳 236000)
特发性荨麻疹是临床常见的一种皮肤病,调查显示,全球范围内特发性荨麻疹的患病率约为0.5%~1.0%[1],我国目前仍缺乏大样本流行病学调查资料,部分地区该病的患病率可高达3%[2]。该病治疗难度大,超过40%的患者伴有血管神经性水肿[3]。目前特发性荨麻疹患者常用地氯雷他定等抗组胺药物治疗,并配合卡介菌多糖调节免疫,可减轻临床症状,控制病情,但综合疗效不甚理想[4]。既往研究显示,特发性荨麻疹患者血清维生素D水平相较于健康人群偏低,且其水平越低,病情越严重[5]。但维生素佐治特发性荨麻疹患者的效果仍鲜有报道。另有报道指出,特发性荨麻疹患者免疫功能紊乱,T淋巴细胞亚群与体液免疫水平均有改变[6]。国外报道指出,特发性荨麻疹患者中免疫功能指标与血清维生素D水平有相关性[7]。但维生素D佐治特发性荨麻疹患者是否能有效调节细胞和体液免疫指标水平尚需深入探讨。本研究特对既往84例患者的临床资料进行回顾性分析,旨在解决上述问题,为此类患者提供一种高效、合理的方案。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 申请医院伦理委员会对本次回顾性分析审批通过后,纳入2018年3月—2019年5月收治的84例特发性荨麻疹患者并对其临床资料进行调阅研究。其中男28例、女56例,年龄16~68岁,平均(32.70±5.52)岁,病程 6周~36个月,平均(9.47±1.20)个月,症状评分,按照荨麻疹活动评分量表(UAS)[8]评价:瘙痒 1~3(1.99±0.37)分,风团数量 1~3(2.01±0.34)分,总分 2~6(4.00±0.43)分。根据治疗方法将纳入者分为2组,其中有41例仅接受常规治疗记为A组,余43例接受维生素D辅助常规治疗记为B组。2组基线资料比较差异均无统计学意义(P>0.05),见表 1。
表1 2组基线资料比较 (±s)

表1 2组基线资料比较 (±s)
组别 n 性别 年龄(岁) 病程(个月) 症状评分(分)男女瘙痒 风团数量 总分A 组 41 14(34.15) 27(65.85) 32.38±5.49 9.42±1.13 2.01±0.38 2.02±0.33 4.03±0.42 B 组 43 14(32.56) 29(67.44) 33.01±5.58 9.52±1.26 1.98±0.35 2.00±0.36 3.98±0.43 χ2/t 0.024 0.521 0.382 0.377 0.265 0.539 P 0.877 0.604 0.703 0.707 0.792 0.591
1.1.2 纳入与排除标准 纳入标准:①均证实为特发性荨麻疹,且为成年患者(年龄≥16岁);②病程均≥6周;③均接受荨麻疹活动程度评价和免疫指标检测;④均有完整的临床资料。排除标准:①伴有其他类型皮肤疾病者,如白癜风、面部激素依赖性皮炎等;②过敏源、自身免疫性疾病或甲状腺疾病者;③伴肝肾功能不全者;④存在维生素D代谢障碍疾病者,如低钙血症等;⑤伴有精神障碍者;⑥近3个月内有糖皮质类激素、唑类抗真菌药物或大环内酯类抗生素口服史者;⑦伴其他自身免疫性疾病者,如红斑狼疮、风湿性关节炎等;⑧近1个月内应用免疫抑制剂、免疫增强剂等药物者。
1.2 方法 A组仅接受常规治疗:①地氯雷他定(地氯雷他定分散片,海南普利制药股份有限公司,国药准字 H20040972,规格:5 mg)口服,10 mg/次,1次/d,共4周;②卡介菌多糖(卡介菌多糖核酸注射液,吉林亚泰生物药业股份有限公司,国药准字S20043033,规格:0.35 mg∶1 mL)1 mL 肌肉注射,隔日1次,共4周。B组在接受常规治疗的同时接受维生素D辅助治疗:常规治疗均同A组,维生素D(维生素D3注射液,上海通用药业股份有限公司,国药准字 H31021404,规格:7.5 mg∶1 mL)1 mL/次肌肉注射,1 次/周,共 4 周。
1.3 观察指标 ①对比不同时刻症状评分:包括治疗前、2周后和治疗后,按照四级评分法评价瘙痒、风团大小、风团数量,总分的理论得分为0~12分,评分越高认为症状越严重。②对比临床疗效:计算疗效指数=(治疗前症状总分-治疗后症状总分)/治疗前症状总分×100%。痊愈:疗效指数为100%;显效:疗效指数≥60%;好转:疗效指数≥20%且<60%;无效:疗效指数<20%[9];总有效率=痊愈率+显效率+好转率。③对比治疗前后T淋巴细胞亚群水平改变:包括 CD3+、CD4+、CD8+,采用流式细胞仪测定,并计算CD4+/CD8+。④对比治疗前后体液免疫水平改变:包括 IgG、IgA、IgM、总 IgE、C3 和 C4,均采用微量免疫比浊法测定。⑤对比不良反应:地氯雷他定常见不良反应为恶心、困倦、头晕等;卡介菌多糖常见不良反应为红肿、结节;维生素D3注射液常见不良反应有便秘、食欲减退、腹泻等。
1.4 统计学分析 以SPSS20.0软件检验,计量资料(±s)若为重复测量的数据需采用重复测量方差分析,并以t检验每2样本差异,本组内和2组间比较分别采用配对t和独立样本t检验;计数资料(%)借用χ2检验,若理论频数为1~5则对其校正,若为等级分布的数据需采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同时刻症状评分对比 症状评分组间、时间、交互比较差异均有统计学意义(P<0.05),2组2周后、治疗后症状评分均低于治疗前,2组治疗后症状评分均低于2周后,B组2周后和治疗后症状评分均低于A组,差异均有统计学意义(P<0.05),见表2。
表2 2组不同时刻症状评分比较 (分,±s)

表2 2组不同时刻症状评分比较 (分,±s)
注:与治疗前比较,*P<0.05;与 2 周后比较,#P<0.05;* 与 A 组比较,△P<0.05。
组别 n 治疗前 2周后 治疗后A 组 41 4.03±0.42 2.52±0.36* 1.68±0.29*#B 组 43 3.98±0.43 1.92±0.31*△ 1.07±0.25*#△F F 组间=10.802 F 时间=16.978 F 交互=13.383 P P 组间=0.003 P 时间=0.000 P 交互=0.001
2.2 临床疗效比较 经秩和检验2组临床疗效分布比较差异有统计学意义(P<0.05),总有效率B组高于A组,差异有统计学意义(P<0.05),见表3。

表3 临床疗效比较 例(%)
2.3 治疗前后T淋巴细胞亚群水平变化比较 治疗后2组CD3+水平与治疗前比较差异无统计学意义(P>0.05),治疗后 2 组 CD4+和 CD4+/CD8+均升高,CD8+均下降,且治疗后B组CD4+和CD4+/CD8+均高于A组,CD8+低于A组,上述差异均有统计学意义(P<0.05),见表 4。
表4 治疗前后T淋巴细胞亚群水平变化比较 (±s)

表4 治疗前后T淋巴细胞亚群水平变化比较 (±s)
注:①与治疗前比较,P<0.05。
组别 n CD3+CD8+ CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 41 69.52±8.13 69.02±8.31 38.20±5.10 43.46±5.97① 33.52±4.09 28.52±4.07① 1.14±0.25 1.52±0.30①B 组 43 69.20±8.05 68.69±8.19 38.55±5.07 49.58±6.12①* 33.07±4.12 22.07±3.96①* 1.17±0.23 2.25±0.34①*t 0.181 0.183 0.315 4.636 0.502 7.361 0.573 10.415 P 0.857 0.855 0.753 0.000 0.617 0.000 0.568 0.000 CD4+
2.4 治疗前后体液免疫水平变化比较 治疗后2组IgA、IgG、IgM、C3和C4水平与治疗前比较差异无统计学意义(P>0.05);治疗后2组总IgE水平均下降,且治疗后B组总IgE低于A组,上述差异均有统计学意义(P<0.05),见表 5。
表5 治疗前后体液免疫水平变化比较 (±s)
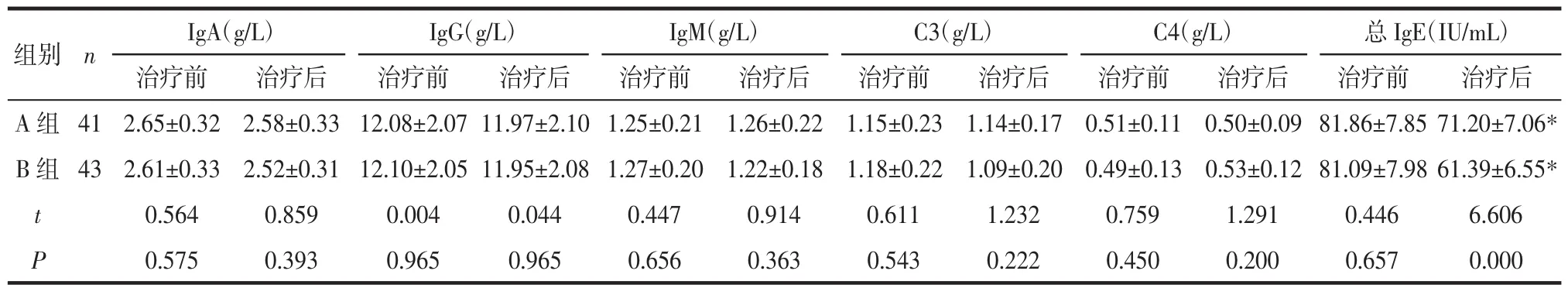
表5 治疗前后体液免疫水平变化比较 (±s)
注:与治疗前比较,*P<0.05。
组别 n IgA(g/L) IgG(g/L) IgM(g/L) C3(g/L) C4(g/L) 总IgE(IU/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 41 2.65±0.32 2.58±0.33 12.08±2.07 11.97±2.10 1.25±0.21 1.26±0.22 1.15±0.23 1.14±0.17 0.51±0.11 0.50±0.09 81.86±7.85 71.20±7.06*B 组 43 2.61±0.33 2.52±0.31 12.10±2.05 11.95±2.08 1.27±0.20 1.22±0.18 1.18±0.22 1.09±0.20 0.49±0.13 0.53±0.12 81.09±7.98 61.39±6.55*t 0.564 0.859 0.004 0.044 0.447 0.914 0.611 1.232 0.759 1.291 0.446 6.606 P 0.575 0.393 0.965 0.965 0.656 0.363 0.543 0.222 0.450 0.200 0.657 0.000
2.5 不良反应发生率比较 A组有1例恶心、1例头晕、1例注射部位红肿;B组有1例恶心、1例困倦、2例食欲减退、1例腹泻。A组与B组不良反应发生率分别为7.32%和11.63%,差异无统计学意义(校正 χ2=0.091,P=0.763)。
3 讨论
特发性荨麻疹的发病机制尚未完全明确,可能与遗传及环境因素、免疫紊乱等有关。有研究显示,特发性荨麻疹患者机体细胞免疫和体液免疫均有异常[10]。T淋巴细胞亚群是机体细胞免疫功能的重要指标,在自身免疫性疾病等多种疾病发生发展中起着重要作用。有研究指出,特发性荨麻疹患者CD4+减少,CD8+增多,则 CD4+/CD8+降低,引发免疫功能紊乱[11-12]。总IgE水平可在变态反应疾病中发挥关键作用,在特发性荨麻疹患者中异常升高[13]。因此积极调节此类患者的T淋巴细胞亚群和体液免疫水平很有必要。
本研究中,2周后和治疗后的2组症状评分均低于治疗前,但B组均低于A组,且B组总有效率优于A组,可知维生素D辅助治疗特发性荨麻疹可积极控制患者的症状,增强疗效。研究发现,25(OH)D3在特发性荨麻疹患者中水平减少,提示维生素D缺乏可能是该病发生的重要原因[14]。报道指出,特发性荨麻疹多在冬季和初春发作,可能与人们接受日光照射量普遍减少,维生素D合成量减少有关,因此建议对此类患者采用维生素D辅助治疗[15]。维生素D进入机体后经过一系列代谢过程可发挥多种作用,包括调节免疫功能和细胞因子水平等,促进临床症状减轻。
卡介菌多糖核酸可增强免疫功能,但对特发性荨麻疹患者的免疫调节作用仍不甚满意。维生素D不仅可调节肥大细胞的增殖与分化,还可增强其活性,对其他多种免疫细胞及其分泌的因子之间的相互作用也有调节作用,因此其辅助治疗特发性荨麻疹可改善免疫功能。有研究显示,对荨麻疹患者予以免疫调节剂治疗后CD3+、CD4+和CD4+/CD8+均升高,CD8+下降,提示免疫增强剂可改善其T淋巴细胞亚群水平[16]。本研究中,治疗后2组CD4+和CD4+/CD8+均升高,CD8+均下降,且 B 组 CD4+和 CD4+/CD8+均高于A组,CD8+低于A组,提示维生素D可改善其 CD4+、CD8+和 CD4+/CD8+水平,但 CD3+无明显变化,与上述报道部分不符,可能与报道中所用的基础治疗方法、患者病情严重程度不同等有关。也有报道指出维生素D可调节支气管哮喘患儿IgE的合成和分泌,抑制免疫紊乱,调节体液免疫功能[17]。本研究中治疗后2组总IgE均下降,但B组低于A组,提示维生素D治疗特发性荨麻疹也可调节体液免疫,与上述报道相符。既往报道显示,维生素D缺乏可参与慢性荨麻疹等疾病发生发展,并可增加IgE的表达,降低机体抵抗力[18-19]。沈萃萃等[20]报道显示在慢性荨麻疹患者中血清25(OH)D水平偏低,但可能与总IgE无关,与上述报道和本研究结果不符,可能由所选研究对象的分型不一致、所用检测方法的精准度差异等所致。
此外,本次研究还发现2组安全性相近,提示对特发性荨麻疹患者予以维生素D辅助治疗并不会增多不良反应。综上,建议在特发性荨麻疹患者中采用维生素D辅助治疗,可有效控制症状、增强疗效,还可调节T淋巴细胞亚群水平,控制总IgE水平,改善免疫紊乱状态,且安全。但维生素调节此类患者免疫的具体作用机制仍未明确,需深入探讨,应作为后期研究的重点。

