基于结核病宿主免疫反应的实验室检测技术及其临床应用
逄宇 高兴辉 汤一苇 高孟秋
结核病是全球重大公共卫生问题[1]。世界卫生组织估算全球每年新发结核病患者超过1000万例,死亡患者超过140万例,有效遏制结核病需要新型的防控技术[1-2]。人群暴露于结核分枝杆菌(Mycobacteriumtuberculosis, MTB)环境中后发生结核感染,但无临床症状,成为潜伏感染者,部分潜伏感染者在后期发展成活动性结核病患者,在人群感染结核分枝杆菌的过程中,存在两个主要状态:(1)是否能够清除入侵的结核分枝杆菌;(2)感染结核分枝杆菌的潜伏感染者是否会发病[3-4]。在这两个过程中,宿主的免疫系统都发挥至关重要的作用。其中入侵宿主的结核分枝杆菌激发感染性迟发型超敏反应,即由效应性T细胞与相应抗原作用后,引起的以单个核细胞浸润和组织细胞损伤为主要特征的炎症反应[3]。一方面,迟发型超敏反应能够保护患者在接受到抗原刺激后迅速应答以实现清除病原的目的;另一方面,肺结核患者对结核分枝杆菌产生T细胞免疫可导致自身组织损伤,形成干酪样坏死和肺空洞,精准调控免疫应答的保护和损伤作用的动态平衡是提高患者治疗效果的重要方面[5]。
当前结核病实验室诊断仍然是以病原学为主,通过检测到结核分枝杆菌或其核酸,为临床诊断结核病提供重要的实验室证据[2]。虽然病原学检测被视为结核病实验室诊断的可靠方法,但是超过半数患者无法找到确定的实验室证据,提示亟待开发新型的诊断技术满足日益增长的临床需求[6]。培养是结核病实验室诊断的金标准,其成本低廉也是其显著优势,但是培养方法自身的缺点也成为制约其在基层实验室推广使用的主要限制因素[6-7]。结核分枝杆菌是高致病性病原微生物,开展结核分枝杆菌的实验需要符合特殊生物安全标准,这也成为制约分枝杆菌培养在基层推广的重要因素;最后,培养操作相对繁琐,对实验室操作人员的熟练程度要求较高[8]。近些年多种分子生物技术在结核病及耐药结核病早期诊断方面发挥重要作用[2,9]。但是与传统的培养相比,其高敏感度造成的特异度稍差可能造成临床诊断困难;此外,由于DNA的高稳定性,基于DNA的检测方法难以区分结核分枝杆菌的死活,限制了分子生物学诊断技术在结核病患者疗效评价中的应用[2]。对于部分早期诊断的肺结核患者,缺乏临床症状且无法排出高质量的痰,也造成了分子生物学诊断技术在痰菌阴性肺结核诊断中的困境[6]。免疫学诊断技术目前是辅助结核病实验室诊断的重要方面[10]。结核菌素皮肤试验(tuberculin skin test, TST)和结核特异性γ-干扰素释放试验(interferon-gamma release assay,IGRA)是目前应用最广泛的结核病免疫学诊断技术,在《WS 288—2017 肺结核诊断》[11]中作为活动性结核病的辅助诊断技术。但由于仅对结核抗原刺激的迟发型超敏反应进行检测,无法区分活动性结核病和潜伏感染者,这导致两种方法在结核病诊断方面的特异度较低。近年来,聚焦于提高结核病实验室诊断,特别是痰菌阴性肺结核诊断,充分发掘宿主抗结核的特异性应答反应,寻找新型的免疫学诊断标志物或标志物组合用于结核病诊断成为未来重要方向。本文系统梳理了结核病宿主反应实验室检测技术的进展及其临床应用。
一、结核病宿主反应实验室检测
(一)TST
TST是1907年奥地利科学家Von Pirquet提出的,其基本原理是通过皮内注射结核菌素,并根据注射部位的皮肤状况诊断结核分枝杆菌感染所致Ⅳ型超敏反应的皮内试验[12]。在过去TST一直用于识别结核分枝杆菌潜伏感染的风险人群,但TST的主要问题是高水平的假阳性结果,是由于TST无法区分结核分枝杆菌感染和接触非结核分枝杆菌或接种卡介苗引起的阳性反应,这两种假阳性反应通常归因于由卡介苗接种或环境分枝杆菌的同源抗原触发的免疫反应[13]。TST特点是操作简单,无需特殊设备,是临床上常用的辅助诊断结核病方法,其敏感度约为68%~95%,特异度约为96%~99%[14]。其敏感度受注射结核菌素的效力和剂量、感染后间隔时间、脱敏、故意干扰、产后免疫抑制和观察者变异的影响。特异度受鸟分枝杆菌、副结核分枝杆菌和环境分枝杆菌的致敏作用以及皮肤结核的影响[14]。TST可用于结核病流行情况的调查和监测,通过该试验可获得一个地区结核感染和结核分枝杆菌的传播情况;可为接种卡介苗提供依据并监测卡介苗的免疫效果与质量;可辅助结核病诊断和鉴别诊断,对于临床疑似结核病患者,若阳性反应可支持结核病的诊断,若阴性反应则说明结核病可能性较小,但阴性反应不能排除其他情况导致,如免疫缺陷、营养不良、炎症或全身播散性结核病、肺炎、肿瘤、病毒感染等[15]。重组结核杆菌融合蛋白(EC)是一种新型的皮肤试验产品,在结核病患者中EC具有良好的敏感度(90.64%),与TST具有较高的一致性;在未感染结核分枝杆菌人员中EC的两次检测阴性一致率较高(88.20%);在非结核性疾病患者中EC的阴性符合率较高(73.10%),与T-SPOT.TB的一致性较好;同时不受卡介苗接种的影响[16-19]。
(二)IGRA
IGRA的基本原理是机体感染结核分枝杆菌以后,存于血液中的特异性T淋巴细胞会在再次接触结核分枝杆菌特异性抗原(如早期分泌抗原靶6和培养滤液蛋白10等)时,T细胞活化并分泌相应的细胞因子γ干扰素,通过对效应T细胞和γ干扰素的检测,判断机体被结核分枝杆菌感染的风险[20]。IGRA包括干扰素体外释放酶联免疫法和体外酶联免疫斑点试验,前者检测γ干扰素产生水平,后者检测产生γ干扰素细胞的数量,这两种检测方法不受卡介苗接种的影响,可以区分结核分枝杆菌感染与非结核分枝杆菌感染,诊断结核分枝杆菌潜伏感染的敏感度为70%~80%,特异度为88%~97%[21]。
1. 干扰素体外释放酶联免疫法:干扰素体外释放酶联免疫法产品目前主要有QuantiFERON-TB (QFT)、QuantiFERON-TB gold (QFT-G)、QuantiFERON-TB gold in-tube(QFT-GIT)、Quanti-FERON-TB gold plus(QFT-G Plus)等检测产品。QFT是2001年美国食品药品监督管理局(FDA)批准的第一代用于诊断结核分枝杆菌潜伏感染的IGRA试剂盒,它是利用来自结核分枝杆菌的PPD刺激全血细胞,检测活化T细胞分泌产生γ-干扰素。QFT-G是第二代的IGRA试剂盒,刺激全血细胞的PPD换成了结核分枝杆菌特异性抗原——结核分枝杆菌早期分泌抗原靶6和培养滤液蛋白10,这些抗原不能被卡介苗和非结核分枝杆菌编码,对结核分枝杆菌的特异性更高。QFT-GIT是第三代IGRA试剂盒,它利用结核分枝杆菌的早期分泌抗原靶6、培养滤液蛋白-10、特异性抗原TB7.7,去刺激患者免疫T淋巴细胞产生γ-干扰素,对γ-干扰素进行定量测定[22]。QFT-GIT对儿童和成人活动性肺结核的诊断敏感度与特异度分别为83.9%和88.5%、73.7%和70.4%,QFT-GIT诊断结核分枝杆菌潜伏感染的敏感度为70%,特异度在未接种卡介苗者为99%,接受卡介苗治疗的患者为96%[23]。QFT-G Plus是最新一代IGRA试剂盒,QFT-Plus的新颖之处在于,除了CD4+T细胞外,它还诱导CD8+T细胞产生应答,从而比QFT-GIT从T细胞亚群获得更广泛的应答。它的目的是提高结核分枝杆菌潜伏感染的检测,特别是在最近接触者、免疫功能低下的宿主和幼儿人群中[24]。在治愈肺结核患者中,QFT-G Plus阳性率为82.0%,高于QFT-GIT(73.0%)。在隐匿性结核病感染中 QFT-GIT与QFT-G Plus检测结果一致性较高。与QFT-GIT相比,QFT-G Plus与结核病疑似患者的替代指标有更强的相关性。在老年人中,QFT-G Plus检测结果比QFT-GIT有更高的敏感度。QFT-G Plus总的敏感度、特异度、阳性似然比、阴性似然比和诊断优势比分别为94%、96%、24.4、0.05和414,ROC曲线下面积为0.99[25]。QFT-GIT和QFT-G Plus在活动性结核病患者中的敏感度差异在所有研究中都不显著。在高危人群中,QFT-G Plus和QFT-GIT之间的一致性为89.9%~96.0%,低风险人群中QFT-Plus的特异度略低于QFT-GIT[10]。QFT-G Plus对活动性结核病的联合敏感度为94.0%,而对健康人的联合特异度为96.0%。结核分枝杆菌潜伏感染的联合敏感度和特异度分别为91.0%和95.0%[26]。
2.干扰素体外酶联免疫斑点试验:酶联免疫斑点试验是用于测定分泌特异性抗体或细胞因子的单个细胞对特异性抗原的应答能力及产生应答的细胞数量。常用的酶联免疫斑点试验是T-SPOT.TB试剂盒。在诊断结核分枝杆菌潜伏感染人群的研究中,QFT-G的敏感度为64.2%,特异度为99.6%,T-SPOT.TB的敏感度为50.0%,特异度为90.6%,TST的敏感度为70.9%,特异度为68.3%,T-SPOT.TB的特异度较高,敏感度较差[27]。 在儿童结核病的诊断中,T-SPOT.TB敏感度为84.0%,特异度为99.1%,阳性预测值为93.1%,阴性预测值为97.8%。T-SPOT.TB诊断肺结核敏感度显著高于肺外结核,同时T-SPOT.TB的敏感度随着年龄的增长而增加[28]。在诊断血液透析患者的结核分枝杆菌潜伏感染方面,TST的敏感度为31%,特异度为63%; QFT-G试验的联合敏感度为53%,特异度为69%;T-SPOT.TB的敏感度为50%,特异度为67%[29]。IGRA和TST在儿童、免疫缺陷人群和结核病高发国家新移民人群的17项研究中,发现在两项儿童研究中,QFT-GIT和TST(≥5 mm)之间差异无统计学意义,但其他两项研究显示QFT-GIT在识别结核分枝杆菌潜伏感染方面优于TST(≥10 mm),差异有统计学意义;在免疫功能低下者中,IGRA(T-SPOT.TB)在鉴别结核分枝杆菌潜伏感染患者方面,与TST(≥10 mm)差异无统计学意义;在结核病高发国家新移民人群进行的两项研究结果不一致,具有高度异质性(表1和表2)[30]。
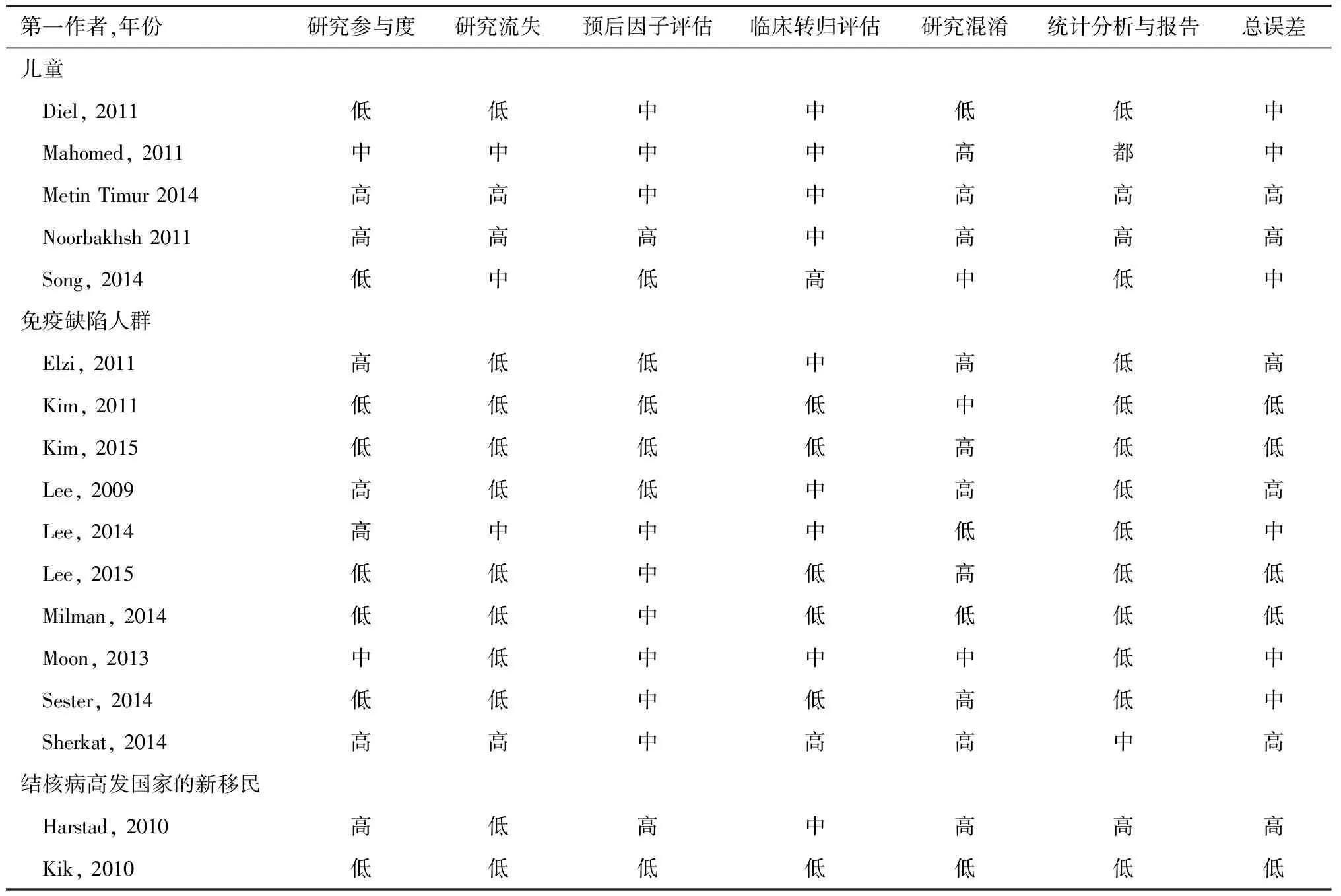
表1 IGRA与TST在儿童、免疫缺陷人群和结核病高发国家新移民人群中活动性结核病发病率研究的偏倚风险(参考文献[30])
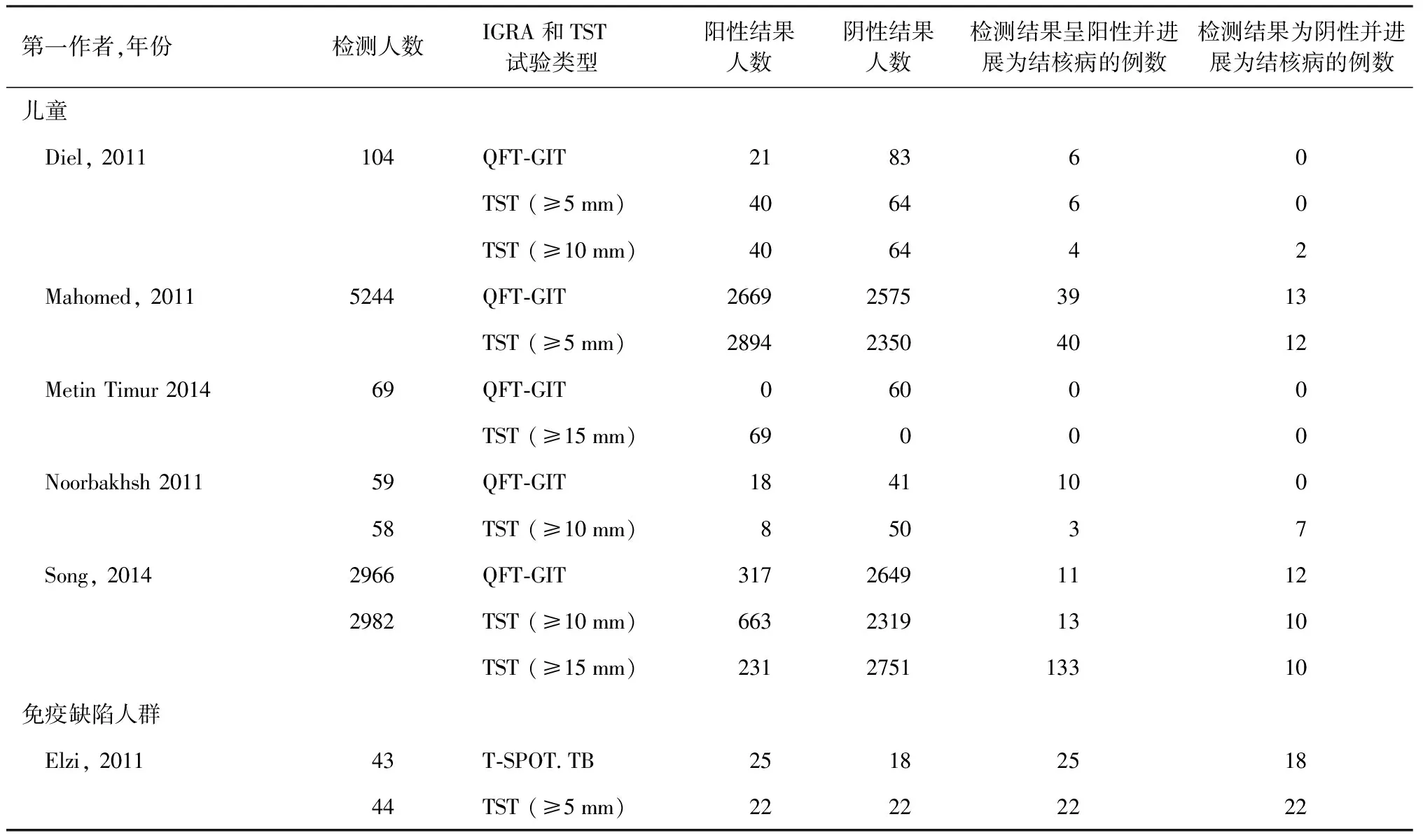
表2 儿童、免疫缺陷人群和结核病高发国家新移民人群中通过结核分枝杆菌潜伏感染检测(IGRA与TST)后进展为结核病(参考文献[30])
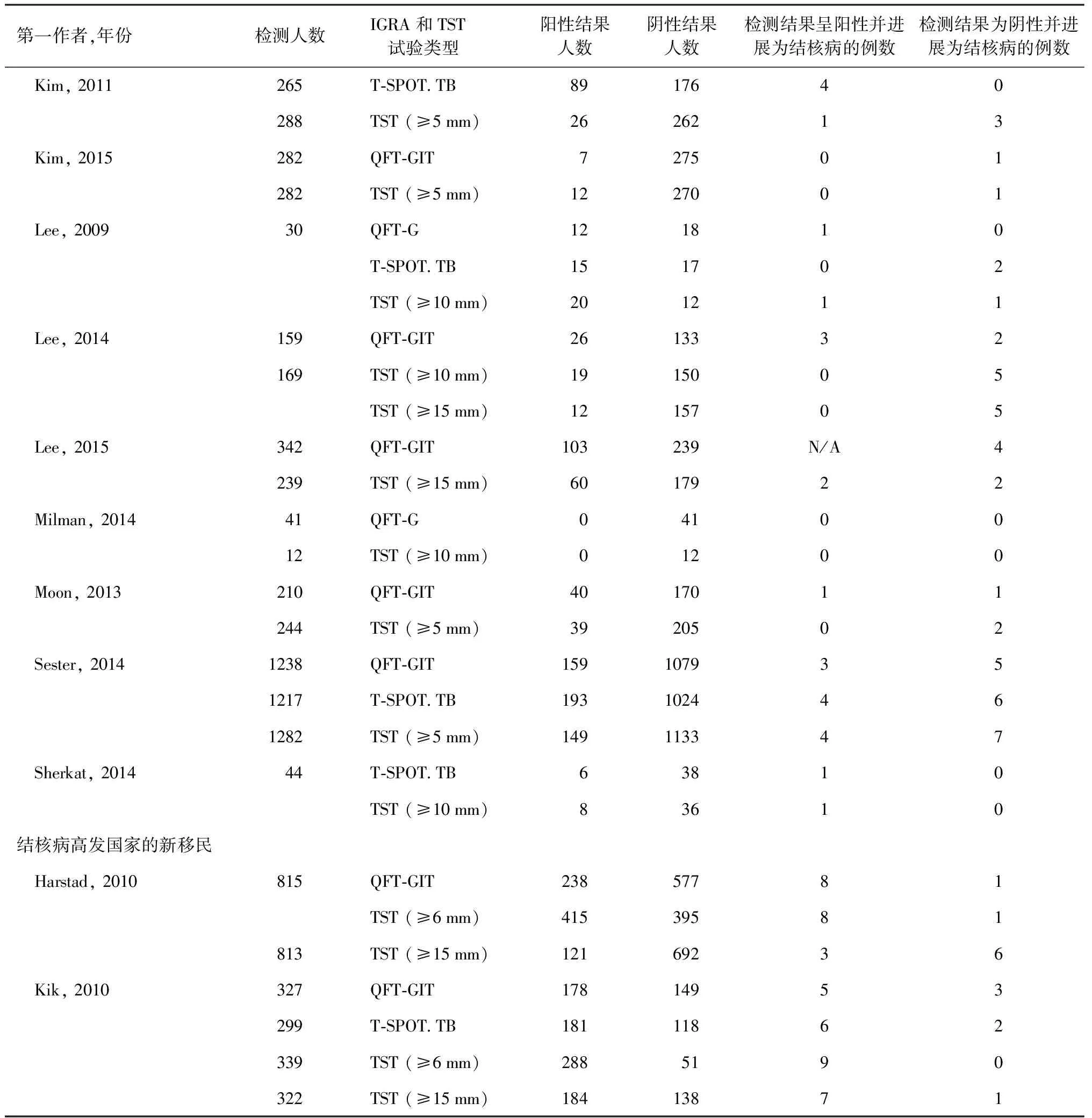
续表2
(三)IFN-γ/IL-2双因子试验
Essone等[31]评价INF-γ/IL-2双因子试验在肺结核的诊断与治疗反应相关研究结果提示,同时检测结核分枝杆菌特异性γ-IFN和IL-2水平可能增加活动性结核病的诊断敏感度。有研究发现活动性结核病患者的IFN-γ+IL-2-T 细胞中位频率和比例显著高于非活动性结核病患者,且IFN-γ+IL-2-T 细胞诊断活动性结核病的受试者工作特征(ROC)曲线下面积为0.788,联合IFN-γ+IL-2-T 细胞的频率和比例诊断活动性结核病的敏感度从79.7%提高到95.3%,特异度从69.8%提高到83.2%[32-33]。IFN-γ/IL-2双因子试验结果有待进一步的研究验证。
(四)宿主转录水平检测
对血浆中结核病相关转录因子分析可以对结核病诊断、鉴别诊断及其治疗效果检测起到一定作用。目前对结核病的血液转录组学研究发现干扰素诱导的基因信号在成功治疗后表达减少,这有助于改善结核病的诊断和治疗监测,这对根除结核病至关重要。同时分析各种不同的血液转录特征,被提议用于结核病的诊断和无症状高危人群的鉴定,并提出了新的方法来开发这种生物标记物用于临床[34]。Berry等[35]通过转录芯片技术对活动性结核病患者和结核分枝杆菌潜伏感染者的全血中393种转录因子水平进行检测,发现其与疾病的放射结果相关,并在治疗后恢复到健康对照组的水平。同时发现86种转录因子水平在活动性结核病与其他炎症或感染性患者之间有显著差异。通过模块化和通路分析显示,结核病的特征是由中性粒细胞驱动的干扰素诱导的基因谱决定的,包括IFN-γ和Ⅰ型IFN-α信号通路。此研究揭示了Ⅰ型IFN-α信号通路在结核病发病机制中的作用,促进结核病疫苗和治疗的发展,还提供了广泛的转录生物标志物,有可能作为诊断和预测结核病流行的工具[35-36]。结核病患者和结核分枝杆菌潜伏感染者的全血微阵列基因研究发现, FCGRIB、CD64、 LTF、GBP5和颗粒酶A的差异表达最显著,5个标记物联合诊断的敏感度为94%,特异度为97%,有利于活动性结核病和结核分枝杆菌潜伏感染的鉴别诊断[37]。同时确定了活动性结核病特有的差异表达基因,及其与结核病易感性和耐药性相关的基因谱。此研究结果发现的基因表达谱有利于更好地理解从潜伏感染到活动性疾病的进展,并为结核病保护提供方法[37]。在HIV与结核混合感染患者血液转录组表达谱中,Kaforou等[38]建立了27个转录因子集,用于区分活动性结核病和结核分枝杆菌潜伏感染,其敏感度为95%,特异度为90%;44个转录因子集,用于区分结核与其他疾病,其敏感度为93%,特异度为88%。血液转录因子集能把结核病从艾滋病病毒感染和未感染人群的其他疾病中区分出来,未来有可能作为一种适合于HIV流行国家的结核病检测方法。结核病患者中15个宿主基因表达可准确区分结核病患者与TST阳性和TST阴性患者,因此有望作为生物标志物将埃塞俄比亚的活动性结核病与结核分枝杆菌潜伏感染进行分类。当ROC曲线临界值≥0.80时,FCGR1A是区分结核分枝杆菌潜伏感染和结核病的唯一标志物,与HIV感染状况无关。随着结核分枝杆菌的RNA检测技术不断发展,结核病诊断准确性和实用性得到不断拓展[39-40]。
在基于宿主反应的结核病诊断基因meta分析研究[41]发现 11个培养证实诊断活动性结核病患者研究的加权平均ROC曲线下面积>0.80,2个研究的加权平均ROC曲线下面积为0.60。除2个研究外,其他研究均具有高阴性预测值(2%患病率时>98%)。除了3个使用培养证实为活动性结核病研究外,临床诊断为活动性结核病的所有研究的加权平均ROC曲线下面积和特异度降低最小。当包括临床诊断为活动性结核病的数据集时,只有4个研究具有均匀的诊断优势比和较低的假阳性率;其他研究要么具有异质的诊断优势比或较高的假阳性率,要么两者兼有。同时16个基因研究中有7个预测了痰转换前6个月结核分枝杆菌潜伏感染到活动性结核病进展,其阳性预测值>6%(患病率为2%时)。总之,基于宿主反应的诊断方法可以准确地识别活动性结核病患者,并在痰转换前预测结核分枝杆菌潜伏感染进展为活动性结核病的高危个体。诊断组合中增加检测基因的数量并不一定提高诊断的准确性。到目前为止,Sweeney团队筛选的标志物组合具有最佳的诊断效能[41]。基于宿主反应的结核病诊断对实现世界卫生组织2035年终止结核病的目标方面提供了有力的证据,并且有利于临床应用 (表3和表4)[41]。结核分枝杆菌特异性细胞免疫反应检测试剂盒(IP-10.TBTM)是新一代结核病诊断产品,利用实时荧光PCR 技术体外检测全血样本中经结核特异性抗原刺激前后IP-10 m RNA水平,并据此判断人体是否有针对结核特异性的细胞免疫反应[42-43],检测性能有待进一步评估和验证。

表3 应用双变量荟萃分析比较用于诊断活动性结核病的16个基因特征 (参考文献[41])
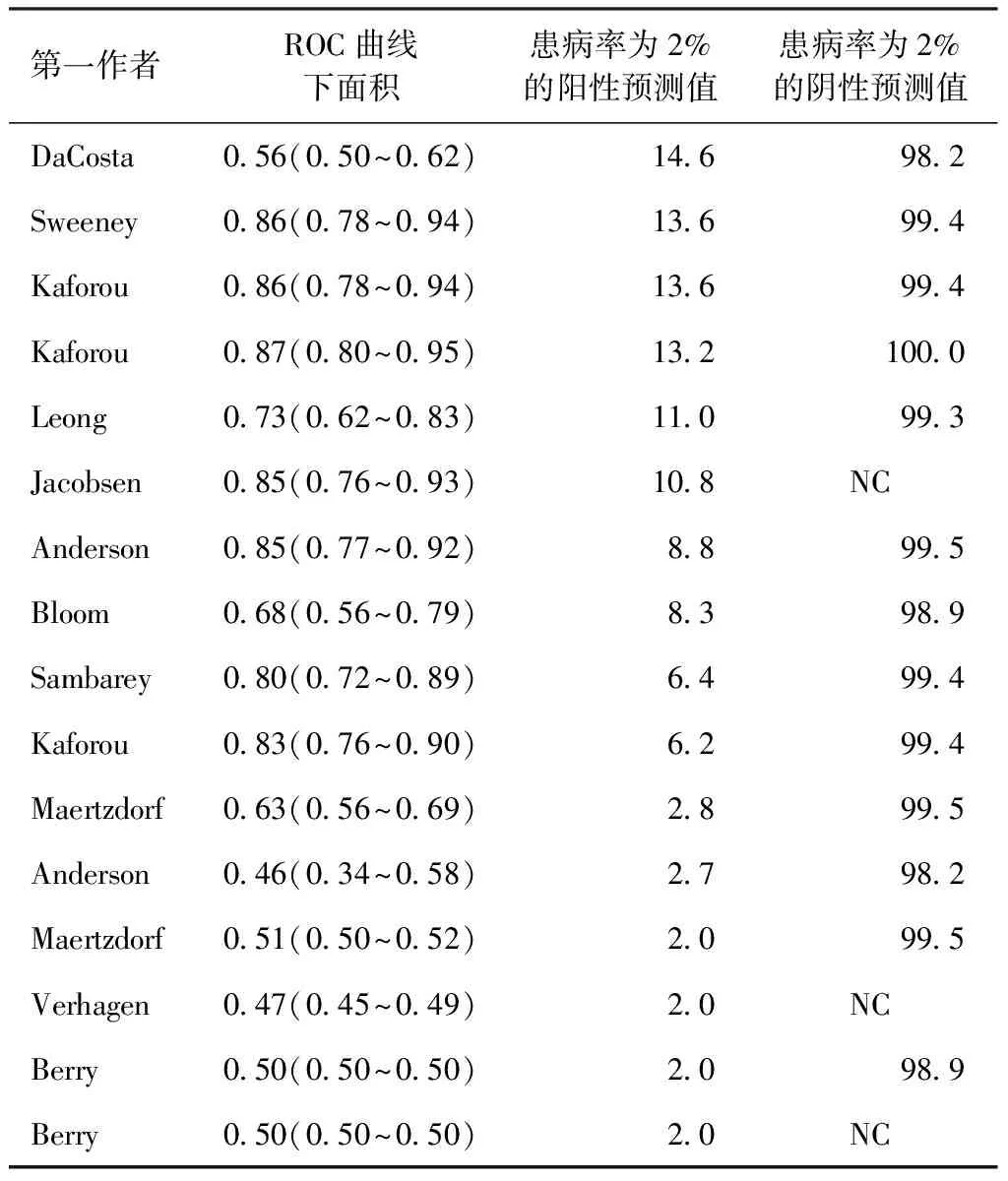
表4 青少年队列研究中诊断前180天从结核分枝杆菌潜伏感染进展到活动性结核病的ROC曲线下面积、阳性预测值和阴性预测值 (参考文献[41])
(五)结核病宿主反应试剂盒
TB Host response试剂盒是通过计算结核分数(TB-scores)进行检测,TB-scores是由Sweeney团队通过筛选了2572例结核病患者全血中结核感染相关的转录因子水平发现的,其定义为TB-scores=(GBP5+DUSP3)/2-KLF2,可用于结核分枝杆菌潜伏感染和活动性结核病的鉴别诊断以及治疗效果的快速准确监测[44]。在结核病患病率为4%的情况下,TB-scores诊断活动性结核病方面的敏感度为90%、特异度为70%和阴性预测值为99.3%,如果结果为阴性,基本排除是活动性结核病[45]。目前Xpert MTB Host response试剂盒采用利用这个技术进行TB-scores计算,该试剂盒采用0.1 ml末梢或采集静脉血,随到随测,可以在30 min完成检测。该试剂盒在HIV混合结核感染人群的鉴别诊断方面,其敏感度约为90%,与微生物综合参考标准相比,其特异度为55.8%;与Xpert MTB/RIF相比,其特异度为85.9%。在独立诊断方面,在该试剂盒的特异度接近95%时,其敏感度为65.7%,而C-反应蛋白(C-reactive protein,CRP))的敏感度仅为13.6%[46]。肺结核患者的TB-scores显著低于对照组人群,Xpert MTB Host response在区分肺结核患者和对照组时,其ROC曲线下面积为0.84;在敏感度为90%时,Xpert MTB Host response的特异度(53.0%)显著高于CRP(28.1%)。在Xpert MTB/RIF半定量为中或高负荷的肺结核患者中,Xpert MTB Host response的敏感度较高(96.8%),而CRP敏感度为90.3%[47]。
Xpert MTB Host response试剂盒的出现,为无痰样本的疑似结核病患者在快速筛查、鉴别诊断以及治疗监测方面提供新的便利的检测方法,可改善结核病目前的检测困境[46],期待更多地对不同人群及其对肺外结核患者的不同临床应用的研究成果问世。
二、结核病宿主反应临床应用
虽然标本中直接查到结核分枝杆菌病原学依据是诊断结核病的金标准,但是临床实践中不是所有结核病患者都可以获得来自病灶的标本供病原学检测,比如肺内病变远离支气管、比较局限且有完整包膜,病灶与支气管、气管不通,痰标本中不可能有来源于病灶的结核分枝杆菌;有些肺外结核病灶部位特殊,不适于穿刺活检获得来自于病灶的标本,比如颅内结核瘤。对处于潜伏感染及感染阶段的结核病,菌量少,未形成病灶或病灶较小,低于现有检查手段的分辨率的下限,临床检查未发现病灶,亦无可供病原学检测的标本。利用检测宿主感染结核分枝杆菌后产生的免疫反应,间接证明体内结核分枝杆菌的存在,是临床诊断结核病的重要依据。
(一)结核病筛查
结核病经呼吸道传播,排菌的肺结核患者是传染源。未经有效治疗的患者痰标本中获得病原学诊断依据就意味着患者作为传染源已经对密切接触人群造成很大的传播风险。利用宿主对结核分枝杆菌的免疫反应,主动筛查结核分枝杆菌潜伏感染人群、有/或无结核中毒症状的结核病疑似患者,做到早期诊断,早期干预治疗,杜绝发展成为排菌患者(传染源)无疑是控制结核病传播的重要手段。
结核病筛查分为主动筛查及被动筛查,主动筛查即对无症状的高风险人群进行定期结核病相关检查,被动筛查为患者出现结核疑似症状(咳嗽、咳痰2周以上或咯血)或发现可疑结核病灶,进一步进行结核病相关检查。宿主对结核分枝杆菌的免疫反应相关检查方法(TST或IGRA)由于标本采集简单、可行(皮试或静脉采血)、避免放射检查方法对特殊人群(15岁以下儿童)造成伤害,成为结核病筛查的首选方法。根据《中国结核病预防控制工作技术规范(2020年版)》要求[48],在中国疫情背景下需要主动筛查的人群包括:(1)艾滋病病毒感染人群;(2)学校人群;(3)流动人口;(4)病原学阳性肺结核患者密切接触者,尤其是5岁以下儿童;(5)老年人;(6)糖尿病患者; (7)羁押人群;(8)其他人群:需使用肿瘤坏死因子治疗、长期应用透析治疗、准备做器官移植或骨髓移植者、矽肺患者以及长期应用糖皮质激素或其他免疫抑制剂的患者。需要特别注意的是对于存在免疫抑制的患者,宿主对结核分枝杆菌的免疫反应亦可能受到抑制而出现假阴性的情况,临床需要结合患者流行病学史、症状、其他检查情况等综合判断。
(二)区分活动性结核病与结核分枝杆菌潜伏感染
结核分枝杆菌潜伏感染及活动性结核病是结核病发生、发展的不同阶段,宿主对结核分枝杆菌的免疫反应处于不同的状态。Petruccioli等[49]研究者纳入57例受试者,其中27例活动性结核病患者、 30例结核分枝杆菌潜伏感染者,通过流式细胞仪及细胞染色,对QFT-Plus管中结核分枝杆菌抗原产生反应的特异性CD4+T细胞进行检测,结果显示在活动性结核病和结核分枝杆菌潜伏感染患者中检测到特异性的CD4+T细胞反应,而特异性的CD8+T细胞应答主要与活动性结核病相关。在潜伏感染和活动性肺结核中CD4+T和CD8+T细胞对结核分枝杆菌特异性抗原刺激后应答的差异,可能成为区分潜伏感染和活动性结核病的标志,但上述结论尚缺乏大规模人群的临床验证。目前已经上市的产品尚未获得有效区分结核分枝杆菌潜伏感染和活动性结核病的适应证。
(三)疗效监测
经过有效治疗后的结核病患者,一方面体内结核分枝杆菌的负荷量发生了明显的变化,另一方面随着菌量下降,患者结核中毒症状、营养状态发生了很大变化,机体的免疫状态也发生了变化。虽然痰菌阴转率是肺结核治疗转归的金标准,但是不适用于不排菌状态的临床诊断肺结核患者;虽然影像可以形象地显示病灶转归,但是需要有经验的医生判断,临床急需要一种简单易行的检测方法观察疗效。Lee等[50]招募了336名(例)参与者(118名无感染接触者,105名结核分枝杆菌潜伏感染者,113例活动性肺结核),以QFT-Plus检测的CD8应答在未感染接触者、结核分枝杆菌潜伏感染接触者和活动性结核病之间不同且呈递增的趋势;CD8应答在培养确诊的活动性结核病患者中高于组织确诊的活动性结核病患者。作者结论为通过动态监测CD8特异性淋巴细胞的反应,有望作为一个结核病活动程度的潜在生物标志物。目前宿主免疫反应标志物在疗效监测的应用尚缺乏大规模队列研究的支持。
(四) 特殊人群的辅助诊断
免疫缺陷患者、器官移植患者、HIV感染者由于机体免疫系统受到抑制,成为结核病易感高危人群,一旦感染结核分枝杆菌易发展成为重症结核病,在HIV感染者中,并发结核病成为主要致死原因。利用宿主免疫反应早期诊断结核病、早期给予有效治疗是改善免疫抑制人群合并结核感染预后的重要手段。宿主免疫反应是利用机体特异性淋巴细胞对结核分枝杆菌特异性蛋白的识别来实现的,虽然机体存在的免疫抑制情况影响了体内免疫反应(TST)结果,但对于采用体外免疫反应的IGRA试验,由于采用淋巴细胞体外分离培养技术,避免了体内免疫抑制状态对检测结果的影响。而基于ELISPOT 技术由于在检测过程中对单个核细胞数量进行了标准化,消除了淋巴细胞减少对检测结果的影响,更适用于CD4+T细胞减少人群。2011年Cattamanchi等[51]的meta分析结果为在HIV感染人群中宿主免疫反应诊断结核感染的敏感度,T-SPOT.TB为 72%(95%CI: 62%~81%), QFT-GIT 为61%(95%CI: 41%~75%),两种体外免疫检测方法均优于TST。Jiang等[52]观察到在中国BCG普遍接种的背景下,在HIV感染人群中当CD4+T细胞<500/μl时,T-SPOT.TB和TST诊断活动性结核病的敏感度分别为64.5%和22.6%,诊断结核分枝杆菌潜伏感染的敏感度为 62.2%和29.7%;Petruccioli等[53]研究者在HIV感染并发结核病及单纯结核病患者中观察到以QFT-Plus检测方法诊断结核感染的敏感度分别为81.8%和86.8%。在免疫抑制人群中,宿主免疫反应为早期诊断结核感染的重要手段,其中体外宿主免疫反应检测方法优于体内免疫反应检测方法;在判读宿主免疫反应检测结果时需要结合临床症状、检测方法和患者的免疫背景。
三、总结与展望
TST一直用于识别结核分枝杆菌潜伏感染的风险人群,但TST的敏感度和特异度较低,受其他因素干扰,存在较多的假阳性结果。目前IGRA试验主要应用于诊断结核分枝杆菌潜伏感染和区分结核分枝杆菌感染与其他结核分枝杆菌感染,其敏感度和特异度比TST有较大提高,但是在区分活动性结核病和潜伏感染者方面诊断价值有限。结核病患者的确诊需要依赖传统病原学检测技术,但其对菌阴结核病应用的局限性明显,基于新方法或者新型标志物的诊断策略将成为菌阴结核病实验室诊断的主要突破方向。近年来,人们对于结核与人体免疫系统互作机制认识的不断深入,筛选出多个结核感染特异性的宿主免疫标志物,基于这些标志物的联合应用可以准确鉴别诊断活动性结核病。但与传统病原学检测方法存在差异,增加宿主基因转录因子的数目并不与诊断准确性成正比,如何在符合成本-效益的前提下优选适宜的宿主标志物组合是未来开发平台技术的核心;其次,基于宿主的诊断技术需要细胞纯化及核酸检测等步骤,限制了其在基层的使用,开发自动化的分子检测平台将是研究的首要任务;再次,目前诊断主要针对活动性结核病患者开展,利用宿主免疫应答水平及时预测结核分枝杆菌潜伏感染向活动性结核病进展的危险程度是实现对潜伏感染者精准干预的基础;第四,应用基于宿主的免疫诊断标志物依赖于对结核宿主互作的机制解析,但部分宿主因子对抗结核的作用机制尚不明晰,成为未来潜在的研究方向。总之,基于宿主反应的结核病诊断技术有望在临床上达到进一步的应用,并为实现世界卫生组织在2035年提出的全球消灭结核病的宏伟目标发挥重要作用。

