高危人群结核分枝杆菌潜伏感染检测及预防性治疗专家共识
中国防痨协会
结核分枝杆菌潜伏感染(latent tuberculosis infection,LTBI)[1]是指机体对结核分枝杆菌(Mycobacteriumtuberculosis,MTB)抗原刺激产生的持久性的反应,临床上没有任何活动性结核病征象。目前尚没有能够直接测量人体MTB感染的技术手段。据估算,全球近1/3的人感染了MTB,感染人数约20亿,估算我国LTBI人数逾2亿[2-3]。研究表明,LTBI者中将有5%~10%在一生中发生结核病[4];在结核病高危人群中发病率更高,尤其是在≤5岁的确诊结核病患者的儿童家庭密切接触人群中,2年内发病率高达19%[5]。如果并发HIV感染,则结核病年发病率达到5%~10%。2018年“第73届联合国大会防治结核病问题高级别会议”提出,2018—2022年全球要完成3000万LTBI高危人群的抗结核预防性治疗。而截止到2020年,全球完成预防性治疗人数为800万[6],仅占目标任务的27%。加强LTBI者的主动发现,对结核病患者密切接触者进行筛查,对新近感染和免疫力低下LTBI人群给予预防性治疗,是降低LTBI者发病的重要措施。我国在新规范出台之前,限于试点或局部地区开展,全国性的LTBI筛查和预防性治疗数据尚不完全掌握,并且当前业内人士对预防性治疗的适用对象、化学药物预防性治疗方案和预防性治疗效果尚存在较多疑虑和争议,同时,新的LTBI诊断技术和预防性治疗方法也在不断研究和应用。有鉴于此,中国防痨协会组织专家编写了《高危人群结核分枝杆菌潜伏感染检测及预防性治疗专家共识》,从LTBI检测原理,以及预防性治疗对象、诊断方法、化学预防和免疫预防等方面进行论述,以供我国结核病防治工作者借鉴和参考。
一、LTBI检测原理
因没有检查方法和技术可以找到在机体隐匿的MTB,故一般说LTBI诊断缺乏“金标准”。诊断LTBI的技术原理,是通过检测机体的结核病特异性免疫反应[7]。
结核菌素皮肤试验(tuberculin skin test,TST)是基于Ⅳ型迟发型变态反应的一种皮肤试验。结核菌素有200多种抗原成分,其中,部分与卡介苗(BCG)和非结核分枝杆菌(nontuberculous mycobacteria,NTM)的抗原成分相同,容易发生交叉反应。试验结果有可能出现假阳性,特别在NTM的高流行地区,TST的特异度将受到影响。常用的纯蛋白衍生物(purified protein derivative,PPD)是通过MTB或卡介苗菌经培养、杀菌、过滤去除菌体后纯化制成,其中可能仍有变性蛋白[8]。
γ-干扰素释放试验(interferon-γ release assays,IGRA)是采用MTB蛋白质的多肽抗原[包括早期分泌抗原靶6(ESAT-6)、培养滤液蛋白10(CFP-10)和TB7.7(p4)],刺激效应T淋巴细胞分泌γ-干扰素(interferon-γ,IFN-γ),检测并定量分析IFN-γ的浓度,判断是否存在MTB特异性细胞免疫反应。所有BCG菌株和绝大部分的NTM都不含有这三种蛋白质,因此,IGRA采用的抗原与BCG及绝大多数NTM无交叉,可避免BCG接种和NTM感染带来的假阳性[9-10]。
重组结核杆菌融合蛋白(EC),是由高效表达MTB的ESAT6-CFP10基因的大肠埃希菌,经发酵、分离和纯化后制成。重组结核杆菌融合蛋白(EC)皮肤试验反应的原理是迟发型细胞过敏反应,即Ⅳ型变态反应。ESAT-6蛋白不仅存在于早期培养滤液中,还存在于细胞浆和细胞壁,从基因和蛋白水平研究表明,ESAT-6仅存在于致病性分枝杆菌中,所有BCG菌株及绝大部分环境分枝杆菌基因组均丢失该基因,不表达ESAT-6,该蛋白与其他微生物的已知蛋白无明显同源性。CFP-10蛋白可强烈诱导50%~90%的结核病患者外周血单核细胞产生增殖反应并分泌大量的IFN-γ,诱导T细胞释放IFN-γ、诱发迟发型变态反应,而接种BCG的健康人对该抗原反应水平低。已感染结核分枝杆菌的机体T淋巴细胞对ESAT-6蛋白和(或)ESAT-6与CFP-10蛋白联合抗原的反应是敏感和特异的。重组结核杆菌融合蛋白(EC)皮肤试验又称新型结核菌素皮肤试验(creation tuberculin skin test,C-TST),可用来检测机体是否感染过MTB[11-12]。
二、 LTBI筛查及预防性治疗对象
受MTB感染人群数量大,对该人群均进行LTBI的筛查和预防治疗,不仅花费巨大,管理困难,还要承担严重药物不良反应的风险。世界卫生组织(World Health Organization,WHO)发布的《结核分枝杆菌管理指南》推荐结核病发病率低于100/10万的高及中高收入国家对所有并发HIV感染、成人及儿童结核病密切接触者、接受免疫抑制剂治疗的患者,以及透析、器官移植、矽肺病患者进行LTBI筛查;资源许可的情况下推荐对囚犯、医务工作者、结核病高疫情地区的移民、流浪者、药物滥用者进行LTBI筛查;资源有限或中低收入国家推荐仅对HIV感染者及<5岁的家庭密切接触者进行LTBI筛查。除此之外,由于学校结核病聚集性疫情时有发生,新生入学体检LTBI的筛查和学校结核病患者密切接触者LTBI筛查应作为学校结核病防控策略的重要内容。
《中国结核病预防控制工作技术规范(2020年版)》(以下简称《技术规范》)要求对以下对象开展结核病预防性治疗:(1)与病原学阳性肺结核患者密切接触的5岁以下儿童LTBI者;(2)HIV感染者及艾滋病患者中的LTBI者,或感染检测未检出阳性而临床医生认为确有必要进行治疗的个体;(3)与活动性肺结核患者密切接触的学生等新近LTBI者;(4)其他人群,包括需使用肿瘤坏死因子治疗者、长期应用透析治疗者、准备做器官移植或骨髓移植者、矽肺病患者,以及长期应用糖皮质激素或其他免疫抑制剂的LTBI者。其中,(1)~(3)条为重点对象。
三、LTBI检测方法
MTB感染的检查技术分为皮肤试验和IGRA两种[3]。
(一)TST
目前,全球仍有100多个国家使用TST 作为LTBI检测技术。我国TST均使用PPD进行[13]。PPD制剂有20 IU/ml和50 IU/ml两种规格。试验方法:在左前臂掌侧前1/3中央皮内注射0.1 ml PPD,以局部出现7~8 mm大小的圆形橘皮样皮丘为宜。结果测量:72 h(48 h~96 h)检查反应。以皮肤硬结为准。试验结果判断标准和意义:阴性(-):硬结平均直径<5 mm或无反应者为阴性。阳性反应(+):硬结平均直径≥5 mm者为阳性。硬结平均直径≥5 mm,<10 mm为一般阳性;硬结平均直径≥10 mm,<15 mm为中度阳性;硬结平均直径≥15 mm或局部出现双圈、水泡、坏死及淋巴管炎者为强阳性[14]。
(二)C-TST
目前,全球已研制成功的结核融合蛋白皮肤试验试剂包括丹麦研制的C-Tb[15-16]、俄罗斯研制的Dia skin test[17]和我国研制的重组结核杆菌融合蛋白(EC)等[11-12,18-20],该类试剂包含针对MTB特异性抗原ESAT-6和CFP-10,在卡介菌和其他大多数NTM中不含这些抗原,因此,该试验可以有效鉴别BCG接种与MTB感染。
在我国上市使用的C-TST的制剂产品规格有3种:每瓶0.3 ml、0.5 ml和1.0 ml,用于6月龄及以上婴儿、儿童及65周岁以下成人。试验方法:在前臂掌侧皮内注射,每人皮内注射0.1 ml(5 U)。结果测量:注射后48~72 h检查注射部位反应,测量记录红晕和硬结的横径及纵径的毫米(mm)数,以红晕或硬结大者为准。反应平均直径≥5 mm为阳性反应。凡有水泡、坏死、淋巴管炎者均属于强阳性反应。
(三)IGRA
IGRA作为LTBI检测技术在全球使用多年。IGRA是检测MTB特异性抗原刺激T细胞产生的IFN-γ,以判断是否存在MTB感染。IGRA有两种方法:(1)采用酶联免疫吸附试验(ELISA)检测全血中致敏T细胞再次受到MTB特异性抗原刺激后释放IFN-γ水平,称之为全血检测或结核感染T细胞免疫检测;(2)采用酶联免疫斑点技术(enzyme-linked,ELISPOT)测定在MTB特异性抗原刺激下,外周血单个核细胞中能够释放IFN-γ的效应T细胞数量,称之为细胞检测或结核感染T细胞检测。
四、LTBI诊断标准[21]
1.在没有BCG接种或NTM干扰时,以PPD反应硬结平均直径≥5 mm视为已受MTB感染。
2.在BCG接种地区或NTM感染地区,以PPD反应硬结平均直径≥10 mm视为MTB感染标准。
3.对HIV阳性或接受免疫抑制剂治疗大于1个月,以及与活动性肺结核患者有密切接触的未接种BCG的5岁以下儿童PPD反应硬结平均直径≥5 mm视为MTB感染。
4.C-TST阳性即表明受到MTB感染。
5.IGRA检测阳性说明存在MTB感染。
五、LTBI化学预防性治疗方案[21-22]
我国《技术规范》推荐LTBI预防性治疗方案包括:单用异烟肼、异烟肼联合利福平、异烟肼联合利福喷丁、单用利福平等方案(表1)。
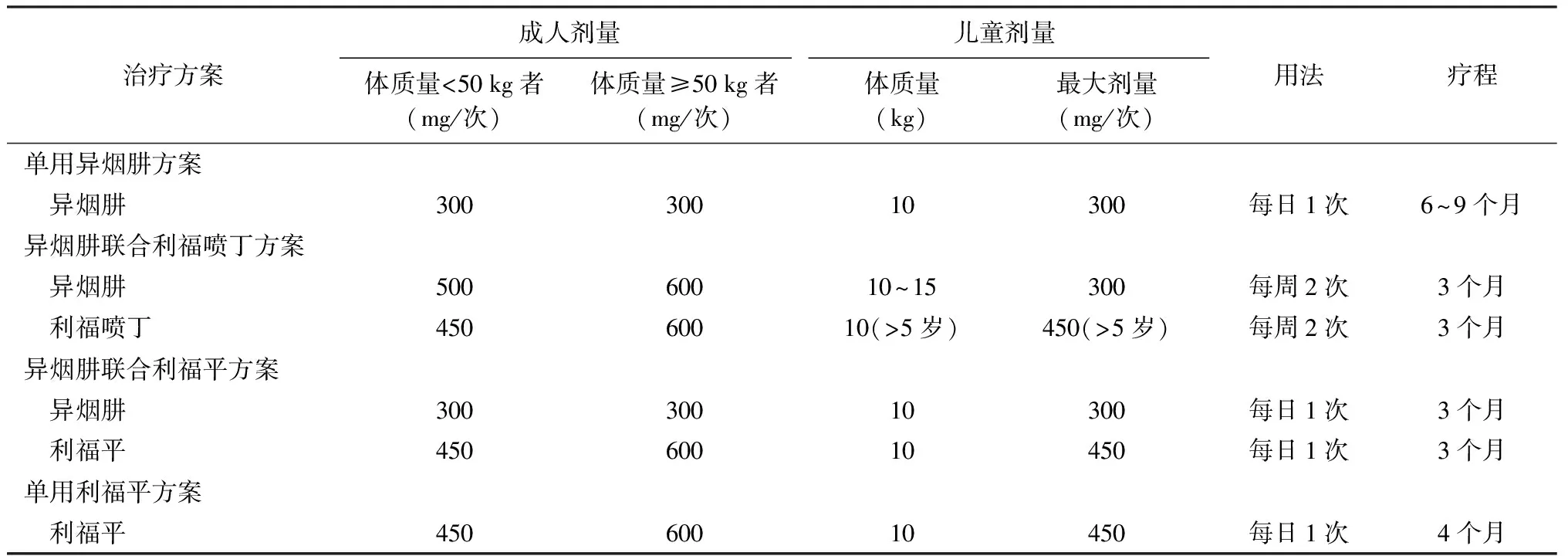
表1 结核分枝杆菌潜伏感染者化学预防性治疗方案和药物剂量
六、LTBI化学预防性治疗管理
为使得化学预防性治疗能顺利实施,获得最佳效果,同时也为了最大限度避免和减少耐药性的产生。应严格遵循预防性治疗流程,强化预防性治疗对象的管理[23-25]。
(一)排除活动性结核病
治疗前了解治疗对象有无结核病中毒症状和(或)不同系统的相关可疑症状,询问既往有无肺结核患者密切接触史或与耐药肺结核患者密切接触史;对治疗对象进行全面体格检查、胸部影像学检查,排除全身任何部位的隐蔽的活动性结核病病变。
(二)排除预防性治疗禁忌证
治疗前医务人员应仔细询问患者既往病史、用药史、药物过敏史,以及结核病患者接触史(是否有耐多药结核病患者接触史)。进行血常规、肝肾功能检查,除外用药禁忌,依据评估结果选择适宜的抗结核预防性治疗方案。
(三)有下列情况之一者,不适宜接受抗结核化学预防性治疗
1.正在接受治疗活动性病毒性肝炎或伴血丙氨酸氨基转移酶(ALT)升高者。
2.过敏体质患者,或身体正处于变态反应期者。
3.癫痫患者、精神病患者,或正在接受抗精神病药物治疗者。
4.患有血液系统疾病,血小板降低至<50×109/L者,白细胞减少至<3000×109/L者。
5.服药前已知依从性差,不能坚持规定疗程者。
6.既往患过结核病,完成规范抗结核治疗5年内者。
(四)预防性治疗的登记管理
对于诊断为LTBI者实行预防性治疗前需进行登记、开展健康教育、签署知情同意书,落实预防性治疗督导管理措施,做好治疗期间的随访观察和疗程结束的评价,包括治疗期间是否规律服药、药物不良反应发生情况和是否完成治疗疗程等。为了防止不规律用药产生耐药性和减少抗结核药物不良反应的发生,治疗期间应有监督管理措施,保证服药者的依从性,以使其能够顺利完成治疗疗程。
(五)药物不良反应观察与处理
LTBI者进行化学预防性治疗的服药期间应定期随访检查,密切观察抗结核药物引起的不良反应发生情况。出现药物不良反应时,应详细追问病史,确定不良反应的原因。解除诱因是最主要的药物不良反应处理措施。
(六)停药指征
LTBI者化学预防性治疗出现以下情况时应停止治疗:(1)完成规定的抗结核预防性治疗疗程;(2)任何方案出现药物不良反应、变态反应等时,原则上应停止治疗;(3)因各种原因不规律服药或不能完成整个疗程治疗;(4)预防性治疗期间发现身体任何部位的活动性结核病病灶时,应及时停止,并根据患者发病部位选择标准抗结核化疗方案。
七、LTBI的免疫预防
WHO于近年陆续公布了全球十余项在进行的结核病疫苗研究,包括用于LTBI人群的免疫预防性疫苗研究[3,6,26-28]。在传染病防治国家科技重大专项的支持下,我国研发上市了“注射用母牛分枝杆菌”,该制剂用母牛分枝杆菌培养后收集的菌体,经高压均质、灭活后加入稳定剂冻干制成,主要有效成份为母牛分枝杆菌菌体蛋白,经药效学研究显示,注射用母牛分枝杆菌具有双向免疫调节功能。大规模的Ⅲ期临床研究显示,该产品用于预防LTBI人群发生肺结核,具有安全性好、保护效果稳定、疗程短等优势。该产品的研发上市,为我国LTBI者预防性治疗提供了新的方法,将促进我国LTBI防控策略和措施的发展,对控制结核病疫情具有十分重要的作用。
1.用量及用法:推荐每次给药1瓶,用1.0 ml灭菌注射用水稀释,摇匀后,臀部肌肉深部注射。间隔2周给药1次,共给药6次。
2.注意事项:(1)以下情况者慎用:家族或个人有惊厥、癫痫、脑病和神经系统症状或体征病史者;有严重药物过敏史者、过敏体质者;有并发症的糖尿病患者、有症状的艾滋病患者、恶性肿瘤患者;肝肾功能异常者、患血小板减少症或凝血障碍者。(2)有发热症状者,患急性病或处于慢性病急性发作期者应暂缓给药。(3)在溶解摇匀后使用。如有凝块、异物、药瓶有裂纹及超过有效期均不得使用。(4)注意肌肉注射的深度,注射过浅可能导致局部出现红肿和硬结。不得进行皮内注射、皮下注射或静脉注射。(5)如果发生过敏反应或类过敏反应,应及时采取适当的治疗措施,包括使用肾上腺素等药物。
综上所述,我国结核病防治规划已将LTBI的筛查和预防纳入到结核病防治常规工作中。要达到LTBI人群预防性治疗的效果,需要系统地制定LTBI筛查和预防性治疗的计划,将LTBI控制纳入当地结核病防治工作中。加强对高危人群和重点人群LTBI筛查和预防性治疗的登记管理,推广使用新技术和新方法,加强质量控制,做好LTBI筛查和预防性治疗的效果评价。
执笔者周林、初乃惠、陆伟
指导专家刘剑君、赵雁林、王国治
专家组成员(排名不分先后) 刘剑君(中国疾病预防控制中心);赵雁林、周林、刘二勇、成君(中国疾病预防控制中心结核病预防控制中心);王国治、徐苗、赵爱华、卢锦标(中国食品药品检定研究院);金奇、高磊(中国医学科学院病原生物学研究所);万康林、李桂莲(中国疾病预防控制中心传染病预防控制所);马艳(中国中医科学院中医临床基础医学研究所);成诗明、樊海英(中国防痨协会);屠德华、贺晓新(北京结核病控制研究所);初乃恵、高微微、高孟秋、黄海荣、陆宇(首都医科大学附属北京胸科医院);陆伟、竺丽梅(江苏省疾病预防控制中心);沈鑫、陈静(上海市疾病预防控制中心);沙巍、王丽(同济大学附属上海市肺科医院);卢水华、李涛(上海市公共卫生临床中心);王晓萌、陈彬(浙江省疾病预防控制中心结核病预防控制所);白丽琼、谭云洪(湖南省结核病防治所 湖南省胸科医院);王晓林(宁夏回族自治区第四人民医院 宁夏回族自治区结核病防治所);于艳玲、孙彦波(黑龙江省疾病预防控制中心);陈禹(沈阳市第十人民医院 沈阳市胸科医院);郑建刚(江西省疾病预防控制中心结核病防治所);刘洁(安徽省结核病防治研究所 安徽省胸科医院);何金戈(四川省疾病预防控制中心结核病预防控制所);申阿东(首都医科大学附属北京儿童医院)

