肝泡型棘球蚴病并发肺泡型棘球蚴病相关危险因素分析
陈锐,王志鑫,许晓磊,王凯强,周留馨,樊海宁,王海久
1.青海大学附属医院肝胆胰外科,青海 西宁 810001; 2.青海省包虫病研究重点实验室
棘球蚴病俗称包虫病,是由棘球蚴寄生于动物或人体内所致的一种人畜共患病[1],主要分布于我国以农牧业为经济支柱的西部地区,如西藏、青海、四川、新疆等[2]。根据棘球蚴感染种类的不同可分为囊型棘球蚴病(cystic echinococcosis,CE)与泡型棘球蚴病(alveolar echinococcosis,AE),其中AE的致病性、致残率、致死率均明显高于CE,有报道称未经治疗或治疗不当的AE患者10~15年的病死率可高达90%[1]。AE素有“虫癌”之称,有向周围组织浸润生长的生物学行为。多房棘球蚴自门静脉入肝后在此滞留生长,常以出芽或浸润的方式增殖,不断产生新囊泡深入组织[3],除主要侵犯肝脏外,肺、脑等器官也可出现侵袭性病变。研究认为肝泡型棘球蚴病(hepatic alveolar echinococcosis,HAE)并发肺、脑病变可引起复杂肝泡型包虫病(complex hepatic alveolar echinococcosis,cHAE)[4],往往提示病程已进入晚期。若单纯并发单个肺叶段内病变尚可通过肺叶段联合肝切除实现根治性切除,但并发脑部病变时患者多已失去了手术机会,预后极差[5]。此外,HAE早期多无明显临床症状,且该病流行区多为偏远地区,医疗水平相对落后,极易造成误诊、漏诊[2]。目前HAE并发肺泡型棘球蚴病的机制尚未明确,相关危险因素也未确定。本研究对青海大学附属医院收治的HAE患者临床资料进行回顾性分析,初步探讨HAE并发肺泡型棘球蚴病的影响因素,旨在为临床诊疗提供更多参考依据。
1 资料与方法
1.1研究对象 青海大学附属医院肝胆胰外科2017年10月至2019年4月收治的HAE并发肺泡型棘球蚴病患者(并发组)以及HAE未并发肺泡型棘球蚴病患者(对照组)。
1.2调查方法
1.2.1入组标准 纳入标准为本次入院前未接受过治疗,经术前增强CT、MRI(包括头颅、胸部、腹部以及盆腔影像学结果)以及术后病理结果证实为HAE并发或未并发肺泡型棘球蚴病的患者。排除标准包括:①本次住院未接受手术治疗;②合并囊型棘球蚴病;③肝脏部位病灶与膈肌关系密切,考虑为浸润性侵犯;④有肺以外脏器或组织AE病变;⑤合并有其他严重疾患(肝癌、肺癌、胰腺癌等);⑥情况极其危重难以进行评估;⑦存在严重的应激反应状态(高热、重度感染、创伤);⑧临床资料不齐全。
1.2.2观察指标 患者一般临床资料,包括性别、年龄;首次实验室检验结果,包括谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、总胆红素(TBiL)、凝血酶原时间(PT)、白细胞(WBC)、血小板(PLT)、白蛋白(ALB)、HBeAg、肝功能Child分级等;术前影像学结果,包括肝内原发灶最长径,病灶位置,有无钙化灶,有无坏死,肝内病灶是否侵犯肝内胆管、肝管、肝后下腔静脉、肝动脉、肝静脉、门静脉等,所有术前影像学结果均经术后病理证实。
1.3统计学方法 采用SPSS 23.0统计软件进行统计分析。将计量资料转换为计数资料(通过ROC曲线计算最大约登指数从而确定最佳截断值),计数资料的比较采用χ2检验或Fisher确切概率法。使用Logistic回归分析对肝泡型棘球蚴病并发肺泡型棘球蚴病的危险因素进行多因素分析。以P<0.05为差异有统计学意义。
1.4伦理学审查 本研究经过青海大学附属医院伦理委员会的审批(批号:PSL2018006),所有患者均已签署知情同意书,符合医学伦理相关规定。
2 结 果
2.1一般情况 共收集青海大学附属医院肝胆胰外科2017年10月至2019年4月收治的HAE并发肺泡型棘球蚴病患者(并发组)49例,其中男性22例,女性27例;年龄为5~70岁,平均年龄(43.7±14.0)岁,30岁以上患者占81.63%(40/49),30岁及以下占18.37%(9/49)。同期收治HAE未并发肺泡型棘球蚴病患者(对照组)55例,其中男性17例,女性38例;年龄为7~76岁,平均年龄(38.7±16.1)岁,30岁以上患者占67.27%(37/55),30岁及以下占32.73%(18/55)。两组间性别及年龄构成差异均无统计学意义(χ2=2.164、2.780,P均>0.05)。
2.2HAE并发肺泡型棘球蚴病相关因素分析
2.2.1实验室检查结果 并发组HBeAg阳性和阴性患者数分别为3和46例,对照组为14和41例,两组间差异有统计学意义(P<0.05);并发组与对照组ALT、ALP、GGT、TBiL、PT、WBC、PLT、ALB、肝功能Child分级差异均无统计学意义(P均>0.05)。见表1。

表1 HAE未并发与并发肺泡型棘球蚴病患者实验室检查结果
2.2.2影像学检查结果 并发组与对照组两组间肝后下腔静脉、肝动脉、肝静脉和门静脉侵犯情况差异有统计学意义(P均<0.05);并发组与对照组肝内原发灶最长径、病灶位置、有无钙化灶、有无坏死灶、是否侵犯胆道和是否侵犯左右肝管差异均无统计学意义(P均>0.05)。见表2。
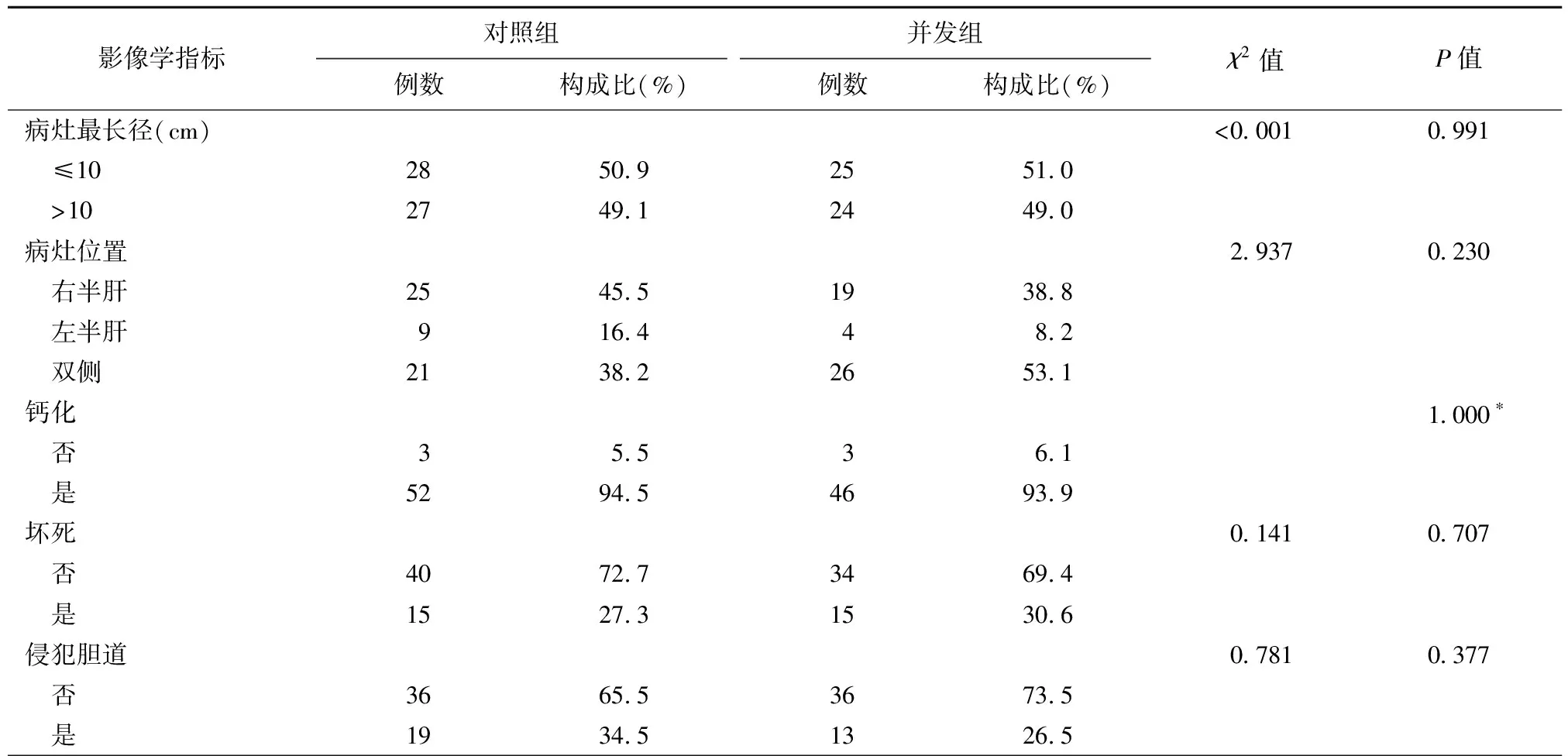
表2 HAE未并发与并发肺泡型棘球蚴病患者影像学检查结果
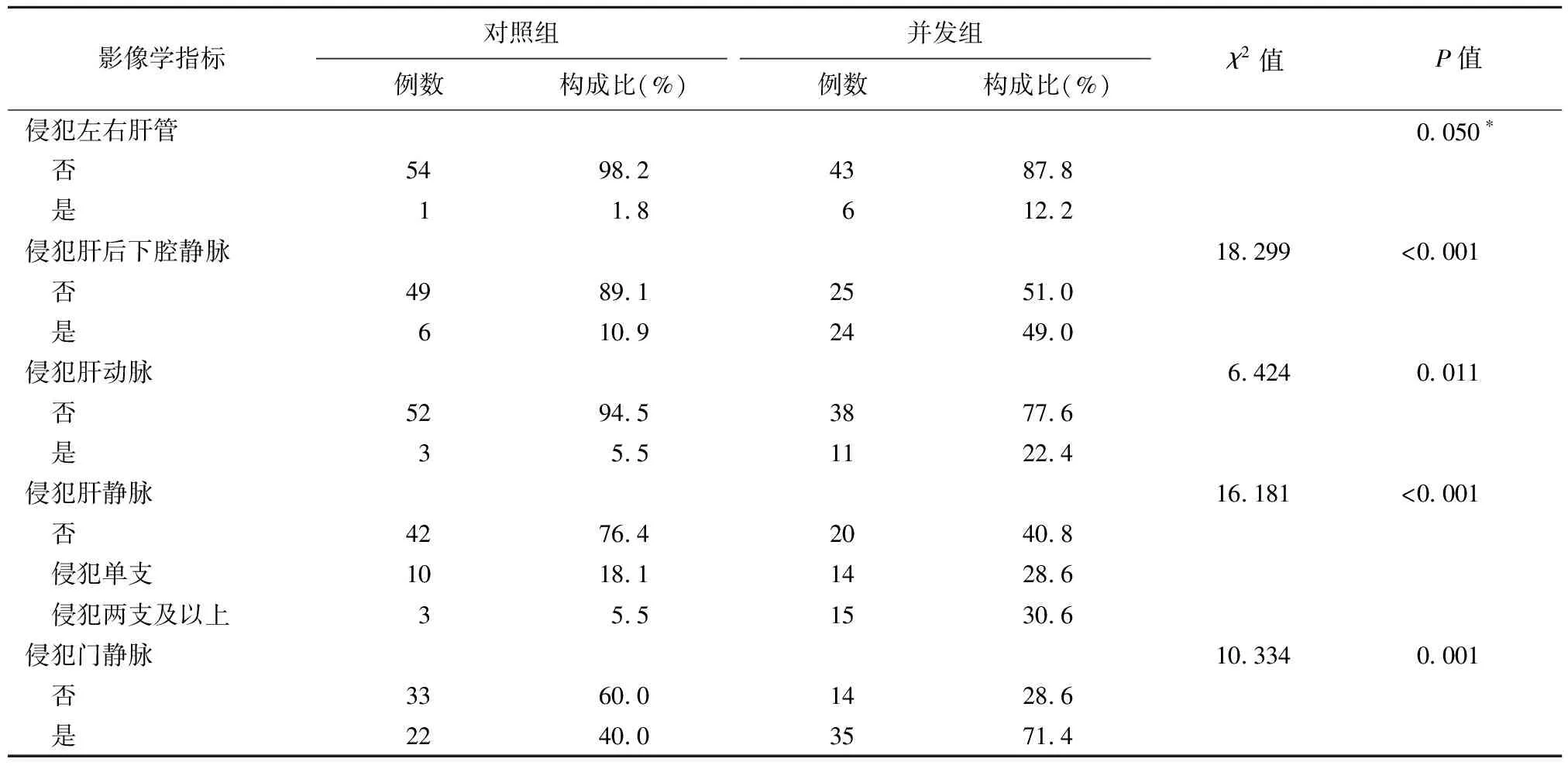
续表
2.2.3HAE并发肺泡型棘球蚴病的二元多因素Logistic回归分析 以是否并发肺泡型棘球蚴病作为因变量,以肝后下腔静脉、肝动脉、肝静脉和门静脉侵犯情况为自变量,采用条件向前逐步法进行多因素Logistic回归分析,具体赋值见表3。分析结果提示,侵犯肝后下腔静脉、侵犯肝静脉是HAE并发肺泡型棘球蚴病的危险因素,见表4。

表3 HAE并发肺泡型棘球蚴病影响因素和赋值

表4 HAE并发肺泡型棘球蚴病的 二元多因素Logistic回归分析
3 讨 论
HAE并发肝外病变危害性大,同时肝外病变也是HAE患者死亡的重要原因之一[6]。AE中肺的受侵率仅次于肝,当HAE并发肺泡型棘球蚴病时会出现胸痛、咳嗽、咯血等症状,严重影响患者的生活质量与生命健康安全[7]。既往研究认为HAE可通过直接浸润、血行转移以及淋巴转移3种方式向肝外扩散[8],其中淋巴转移相对罕见[9]。Treugut[10]等认为根据肺泡型棘球蚴病的起源不同可将其分为血源性转移型与病灶侵犯膈肌蔓延型。Eckert[11]等在小鼠颈部皮肤下植入AE组织,观察到病灶可通过血液与淋巴系统分别向肺部以及引流淋巴结扩散。Matsuhisa[12]等也在HAE小鼠中观察到肝内病灶可通过侵犯肝内静脉进入血液系统向肺部转移。Graeter[13]等初步分析了HAE并发肝外病变的影响因素,发现肝外AE存在与否和肝内病灶大小具有相关性,肝内病灶越大肝外脏器受侵率越高。部分研究发现与恶性肿瘤转移相关的生物标志物如CD44[14]、骨桥蛋白[15]等在HAE中也有表达,推测HAE向肝外转移的分子生物学机制可能与肿瘤转移类似,但具体机制尚不明确,还待进一步研究。
HAE病灶与肝内管道系统关系密切,增强CT或MRI可以对术前肝内管道的受侵情况作出准确的评估进而指导手术方案的制定[13,16]。YANG[16]等通过分析160例中、晚期HAE患者病灶的病理学以及影像学特点发现,门静脉、肝内静脉(左、中、右肝静脉,下腔静脉)和肝动脉的受侵率分别为51.88%、43.28%和26.87%,推测HAE的侵犯行为可能具有静脉靶向性。鉴于HAE患者肝内静脉系统受侵的普遍性,有研究提出根据门静脉、肝静脉和下腔静脉侵犯的严重程度进行华西PHI分级和分型(HX-PHI Staging systen),从而指导手术方式和选择自体肝移植适应证[4]。前期研究发现,德国、法国以及中国HAE患者的影像资料存在洲际差异,其中中国患者肝内胆管、血管的受侵率明显高于欧洲患者,且中国患者更易发生肝外脏器受侵[13]。龙丹丹[17]等通过分析HAE并发肝外转移患者的CT影像学特征发现,发生转移组肝内胆管与血管受肝内病灶的侵犯程度较对照组更重。本研究同样发现HAE并发肺泡型棘球蚴病的危险因素为肝内病灶侵犯肝后下腔静脉以及肝静脉,推测并发肺部病变的过程可能涉及以下环节:①虫体自门静脉入肝后滞留生长并不断向外增殖;②肝内AE病灶浸润肝静脉和(或)肝后下腔静脉后,源于生发细胞的“芽”等组织游走至血管内;③相关结构随血液系统进入肺循环并于肺部定植。此外,不排除血源性直接转移型的可能,即虫体未经肝脏停留直接进入肺循环并于肺中定植,但鉴于AE的原发灶几乎全部为肝脏[6],加之肝内血窦对虫体的阻塞以及肝内免疫细胞杀伤作用,绝大多数肺部AE病变的起源更倾向于血源性间接转移型。
综上所述,HAE病灶与肝内管道系统尤其是肝静脉系统关系密切,肝内病灶侵犯肝后下腔静脉以及肝静脉是HAE并发肺泡型棘球蚴病的危险因素。对于肺部病灶界定困难的HAE患者,若术前影像学检查提示肝静脉以及肝后下腔静脉受病灶侵犯,应考虑并发肺泡型棘球蚴病的可能,并需要针对患者的实际情况予以预防性处理,从而使患者受益最大化。

