组织蛋白酶B响应的超极化129Xe MRI探针对肺癌细胞的超灵敏探测
王崇武,黄 曦,石 磊,陈世桢,周 欣
组织蛋白酶B响应的超极化129Xe MRI探针对肺癌细胞的超灵敏探测
王崇武1,2#,黄 曦1#,石 磊1,陈世桢1,周 欣1*
1. 波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院精密测量科学与技术创新研究院,中国科学院武汉物理与数学研究所),湖北 武汉 430071;2. 中国科学院大学,北京 100049
组织蛋白酶B(Cat B)是一种溶酶体半胱氨酸蛋白酶,在细胞代谢中起重要作用.已有研究表明Cat B在肺癌细胞中会过表达.因此,细胞内Cat B水平的检测非常重要.迄今为止,细胞内Cat B的检测方法主要为荧光成像,但该技术受限于渗透性和自发荧光背景干扰.为了解决这些问题,我们设计了一种基于超极化129Xe磁共振成像的新型探针.它由一个作为129Xe 核磁共振(NMR)报告基团的穴番分子笼和一个作为Cat B特异性可裂解基团的酰胺键组成.当探针与Cat B相互作用时,酰胺键的断裂会导致其129Xe化学位移发生变化.结合超极化-化学交换饱和转移(Hyper-CEST)技术,可为Cat B提供一种新颖的检测方法.
核磁共振(NMR);造影剂;肺癌;超极化129Xe MRI探针;组织蛋白酶B,化学交换饱和转移(CEST)
引 言
组织蛋白酶B(Cat B)在肿瘤的生长、迁移、侵袭和转移中起着至关重要的作用[1],关于实体瘤的一些报道表明,Cat B表达与肿瘤发展进程之间存在相关性[2],这一特点使得Cat B可以用作生物标志物,成为癌症诊断和治疗的靶标.迄今为止,已有许多研究[3-5]对Cat B进行了检测,且大多数方法集中于光学成像.然而,较差的穿透能力和自发荧光背景限制了该技术的应用.
磁共振成像(MRI)具有高的空间分辨率和深层的组织穿透能力,在疾病临床诊断方面享有独特的优势.然而,传统的质子MRI信号具有灵敏度低和背景干扰强等缺点[6,7].为解决这一问题,伴随着自旋交换光泵技术[8-12]的发展,超极化129Xe MRI分子探针开始实用化.129Xe是一种无毒的惰性气体,可溶于血液,其化学位移对周围环境(pH、温度、酶等)非常敏感,这些特性使129Xe非常适合生物医学成像.129Xe可以在“分子笼”的帮助下与蛋白质、磷脂等相互作用.目前,一系列新的分子笼[13]已被开发.其中,穴番-A及其衍生物是最合适的129Xe结合分子笼[14],因为它们与129Xe的亲和力最佳.近年来,已开发出大量基于穴番-A的129Xe生物传感器,用于检测金属离子[15-17]、硫醇[18,19]、pH[20,21]、酶[22,23]、硫化氢[24]、核酸[25]、跨膜受体靶标[26-30]、蛋白质[31-33]等.与传统的热极化相比,新的超极化129Xe技术可以使129Xe的极化增强10万倍以上,大大提高MRI信号的检测灵敏度.但是,超极化129Xe MRI探针的灵敏度仍然不足以支持体内相关分子的检测.为此,结合了超极化129Xe和化学交换饱和转移的Hyper-CEST技术被开发出来,以进一步提高129Xe分子探针的检测灵敏度.Hyper-CEST使用交换进出超分子笼的129Xe和施加的预饱和脉冲来减少在129Xe溶解状态下观察到的信号.
本文设计了一种新型的将高灵敏度的129Xe Hyper-CEST与特定刺激响应相结合的穴番-A功能化分子探针a,由129Xe 核磁共振(NMR)报告基团的穴番分子笼和对Cat B特异性相应的酰胺键组成.Cat B已被证实在非小细胞肺癌中过表达[34],当探针与非小细胞肺癌A549相互作用时,酰胺键的断裂会导致其129Xe化学位移发生变化.结合Hyper-CEST技术,可为Cat B提供一种新颖的检测方法.
1 实验部分
1.1 试剂
Cat B、N,N-二异丙基乙胺(DIPEA)和三氟乙酸(TFA)购自西格玛奥德里奇(上海)贸易有限公司;N-Boc-溴乙胺、N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸(EDCI)、Val-Lys-PABA-PNP和L-半胱氨酸(L-Cys)购自阿拉丁生化技术有限公司;碳酸钾、丙酮、乙酸乙酯、正己烷、二氯甲烷、盐酸、碳酸氢钠、氯化钠、甲醇和EDTA-2Na购自国药集团化学试剂有限公司;Cat B抑制剂CA-074 Me购自MCE;穴番-A购自武汉利普尔森科技有限公司;人肺腺癌细胞系A549和人胚肺成纤维细胞系MRC-5获自中国科学院细胞库(中国上海).除非另有说明,否则所有试剂未经进一步纯化直接使用.
1.2 探针a的合成
化合物2的合成.将穴番-A(化合物1,50 mg,0.057 mmol)和N-Boc-溴乙胺(100 mg,0.476 mmol)溶于25 mL丙酮中.向溶液中加入碳酸钾(100 mg,0.725 mmol),在回流条件下反应12 h.使用旋转蒸发仪除去丙酮,并将乙酸乙酯和水加入到残余固体中.有机层用水洗涤3次,然后旋干.使用硅胶柱色谱法,利用正己烷:乙酸乙酯=1:1的洗脱液纯化粗产物,得到白色固体状的化合物2(47 mg,产率为80%).1H NMR谱图(500 MHz,CDCl3):6.80~6.65(m,12H),4.59(m,6H),4.23~4.10(m,12H),4.03(m,1H),3.87(m,1H),3.83~3.75(m,15H),3.65(m,1H),3.40(m,7H),1.53(s,9H).高分辨质谱[HRMS,采用电喷雾离子源(ESI)]:[M+K]+质荷比(/)的计算值为1 062.404 2,实验值为1 062.404 9.
化合物3的合成.冰浴条件下,滴加TFA:CH2Cl2=1:1的混合溶液(20 mL)至47 mg化合物2.反应15 min后,将TFA和CH2Cl2通过旋蒸除去,得到化合物3(产率为93%).HRMS(ESI):[M-CF3COO]-的/计算值为924.395 9,实验值为924.408 3.
化合物4的合成.将中间体化合物3溶解在再蒸馏的CH2Cl2(25 mL)中,并加入0.5 mL DIPEA.搅拌10 min后,向溶液中添加Val-Lys-PABA-PNP二肽衍生物(40 mg,0.053 mmol),室温条件下,搅拌反应16 h.然后向溶液中加入20 mL CH2Cl2,依次用30 mL 0.1 mol/L HCl、饱和NaHCO3、饱和NaCl洗涤.干燥后,将残余物使用硅胶柱色谱纯化,洗脱剂溶剂为CH2Cl2:MeOH=20:1(/),得到浅黄色固体,即化合物4(29 mg,产率为42%).
探针a的合成.冰浴条件下,将TFA:CH2Cl2=1:1的混合溶液滴加到化合物4中.反应15 min后,通过旋转蒸发仪除去TFA和CH2Cl2,得到探针a(25 mg,产率为85%).HRMS(ESI):[M+Na]+的/计算值为1 456.625 7,实验值为1 456.625 1.
合成过程和反应机理如图1所示.首先对穴番进行氨基衍生化,然后通过酰胺键将穴番与Z-Val-Lys的衍生物Val-Lys-PABA-PNP连接。该探针的酰胺键可被Cat B特异性酶切,随后进一步重排、离去生成穴番的氨基衍生物.

图1 穴番探针a的(a)合成路线和(b)反应机理
1.3 溶液129Xe Hyper-CEST实验
向10 mmol/L乙酸钠的缓冲液(pH 5.0,含2 mmol/L EDTA-2Na、2 mmol/L L-Cys和0.1% DMSO)中加入不同浓度的探针a,配置成不同浓度的探针溶液,使用的Cat B含量为1 UN/mL,使用的Cat B抑制剂CA-074 Me浓度为10 μmol/L.
溶液129Xe Hyper-CEST测试在配备微成像梯度线圈的Bruker AV400宽口径波谱仪(Bruker Biospin,Ettlingen,Germany)上进行.Xe核的射频脉冲频率为110.7 MHz.具有90˚翻转角矩形脉冲的10 mm双谐振探头(129Xe和1H,PA BBO 400 W1/S2 BB-HD-10Z)用于采集129Xe NMR信号. 使用课题组自制超极化装置,通过自旋交换光泵法来制备超极化129Xe气体,129Xe核自旋极化度约为20%.
进行溶液129Xe Hyper-CEST实验时,将2 mL溶液样品装入10 mm NMR样品管中,通入由10% N2、88% He和2% Xe(86%富集的129Xe或天然丰度129Xe)组成的混合气体,持续20 s,然后等待3 s以确保产生的气泡完全破裂,再开始采集129Xe NMR信号.样品温度设定为300 K,由变温单元控制.Xe位于50~100 ppm之间,步长为5 ppm.饱和照射功率为6.5 μT,照射时间为10 s.
使用快速采集弛豫增强(RARE)序列采集磁共振图像,成像视野(FOV)=2×2 cm2、matrix size=32×32、slice thickness=30 mm、echo time=6 ms、repetition time=99.3 ms、rare factor=16.129Xe磁共振图像使用0.2*最大值作为阈值进行分割,然后插值到64×64矩阵中.
1.4 细胞129Xe Hyper-CEST实验
实验组样品制备:将A549细胞在25 cm2培养瓶中培养到大约90%的面积(5×106细胞).弃去培养基,用磷酸盐缓冲液(PBS)冲洗2次,加入2 mL含10 μmol/L(或其他浓度)探针a的MEM培养基(含1% DMSO);在培养箱中孵育6 h后,吸出培养基,用PBS冲洗3次细胞后,使用细胞刮刀将其收集在2 mL PBS中,以3 000 rpm离心2 min后,弃去上清液,将细胞分散在2 mL PBS中.
对照组A样品制备:其他条件与实验组相同,但在与探针a溶液(10 μmol/L)孵育前,将细胞用2 mL含50 μmol/L Cat B抑制剂CA-074 Me的MEM培养基(含1% DMSO)预处理1 h,并除去未吸收的CA-074 Me.然后进行后续实验.
对照组B样品制备:其他条件与实验组相同,但使用MRC-5细胞与含有10 μmol/L探针a的MEM培养基孵育.
空白组样品制备:其他条件与实验组相同,但未添加探针a溶液.
对上述样品进行细胞129Xe Hyper-CEST实验及磁共振图像采集,测试饱和照射功率为13 μT,其他方法及参数与溶液129Xe Hyper-CEST实验时相同.
1.5 细胞毒性检测实验
我们采用甲基四唑蓝(MTT)法检测探针a的细胞毒性,将A549细胞接种在96孔板中,细胞密度为5×104细胞/孔,培养过夜让细胞贴壁生长,弃去旧培养基,并添加200 μL设定浓度梯度(0、1、5、10、20、50、100 μmol/L)的探针a溶液(探针a溶于MEM培养基中,含1% DMSO),探针a终浓度以在490 nm波长下的吸光度确定.细胞与探针孵育4 h后,吸出培养基,用无菌PBS洗3遍;再加入新鲜全培养基,继续孵育44 h,接着加入MTT溶液至终浓度为0.5 mg/mL,继续孵育4 h;然后吸出培养基,加入200 μL DMSO,活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臜(Formazan)并沉积在细胞中,而死细胞不具备此功能.DMSO能溶解细胞中的结晶甲臜,将DMSO震荡均匀后,用酶联免疫检测仪在490 nm波长处测定其光吸收值,可间接反映活细胞数量.
2 结果与讨论
2.1 溶液129Xe Hyper-CEST研究
探针a是一个可以装载129Xe的分子笼,笼内的129Xe将与溶液中的129Xe发生交换.其结构中的酰胺键可被Cat B特异性剪切,导致分子笼的结构和性能发生变化.利用129Xe对化学环境的敏感性,获得超极化129Xe CEST信号,用于Cat B的超灵敏检测.
我们首先比较了探针a与Cat B反应前后(37 ℃,24 h)的Hyper-CEST信号,选择的饱和照射频率(RF)位点为60~80 ppm,每两点之间的间隔为1 ppm,并收集300 ppm的信号以对数据进行归一化.如图2所示,浓度为2 μmol/L的探针a与Cat B反应前无CEST信号;与Cat B反应后,在68 ppm处出现非常明显的CEST信号.浓度为5 μmol/L的探针a反应前在70 ppm处具有相对较小的信号;反应后在68 ppm处具有非常明显的CEST信号.可以证明与Cat B反应前后,探针a的信号强度和化学位移存在差异,这表明它作为Cat B反应探针的可行性,并且CEST信号强度随探针浓度的增加而增加.

图2 (a) 2 μmol/L和(b) 5 μmol/L的探针a与Cat B反应前后的129Xe Hyper-CEST信号
为验证该探针的特异性,我们添加了Cat B特异性抑制剂CA-074 Me,并保持溶液中其他成分浓度不变(探针a浓度为5 μmol/L).如图3所示,加入抑制剂后的探针a和Cat B混合溶液的CEST信号与仅含探针a的溶液类似,而未加抑制剂的探针a和Cat B混合溶液在68 ppm处出现一个明显的CEST信号.这证明探针a对Cat B具有特异性响应,并且该响应可以被Cat B特异性抑制剂抑制.
2.2 细胞129Xe Hyper-CEST研究
为了验证细胞水平下探针a对Cat B的响应,我们检测到探针a与A549细胞孵育后的Hyper-CEST信号位于78 ppm处(图4),且CEST信号强度随探针a浓度的增加而增强.与溶液体系中探针a与Cat B反应后的信号出现在68 ppm不同,细胞体系中出现在78 ppm.这可能是因为复杂的细胞体系影响了129Xe在笼内笼外的交换速率,从而使得化学位移发生偏离.
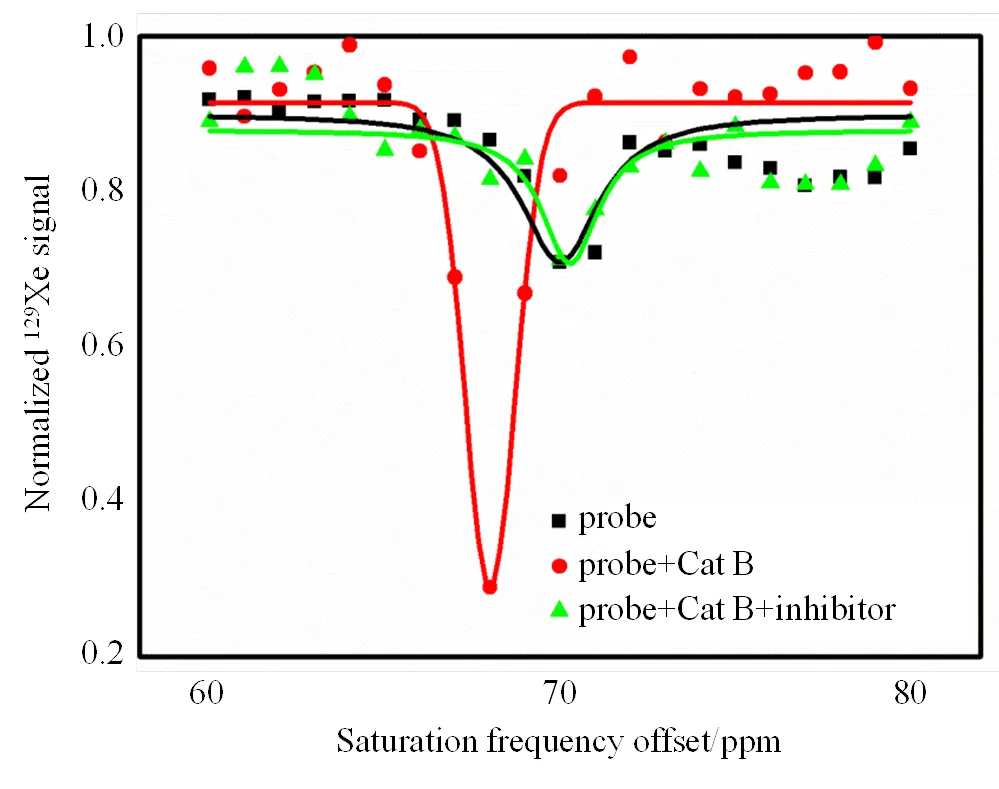
图3 抑制剂CA-074 Me对探针a和Cat B相互作用的影响

图4 不同浓度的探针a与A549细胞孵育后的Hyper-CEST信号
使用Cat B特异性抑制剂CA-074 Me预处理A549细胞,然后与探针a进行孵育.如图5所示,加入抑制剂后,仍然可以检测到Hyper-CEST信号,但是强度远低于没有添加抑制剂时,这说明A549细胞中含有Cat B,并证明了探针a能特异性响应Cat B.将探针a分别与MRC-5与A549细胞孵育,检测Hyper-CEST信号.如图6所示,从A549细胞变为正常MRC-5细胞后,未检测到Hyper-CEST信号,证明了探针a对Cat B过表达的A549细胞的特异性识别能力.

图5 抑制剂CA-074 Me对探针a和A549细胞相互作用的影响

图6 MRC-5与A549细胞分别与探针a孵育的Hyper-CEST信号
2.3 129Xe Hyper-CEST MRI效果
从图7中可以看出,5 μmol/L探针a与低浓度的Cat B反应时,具有一定的Hyper-CEST成像效果(27.78%);当添加Cat B特异性抑制剂时,Hyper-CEST成像效果几乎消失,仅为0.5%;而空白溶液中没有此效果(-2.33%),这证明Hyper-CEST成像效果是由于探针a与Cat B的反应所致.将探针a的浓度增加至15 μmol/ L后,Hyper-CEST成像效果明显增强,达到62.98%.而且通过探针a和Cat B的反应,我们可以获得高对比度的图像.这证明我们设计的探针a可实现低浓度Cat B的Hyper-CEST成像.

图7 (a) 溶液129XeHyper-CEST MRI和(b) CEST效果
从图8中可以看出,高浓度(25 μmol/L)探针a与A549细胞共孵育具有较好的Hyper-CEST成像效果,达到52.25%.当添加Cat B抑制剂时,成像效果显著降低至13.83%.没有探针(空白对照)的A549细胞没有CEST效应(-0.5%),这证明该效应源自探针a与A549细胞的反应.而探针a与MRC-5细胞孵育的Hyper-CEST成像效果也很差(7.76%),证实该探针具有特异性检测肺癌细胞的潜力.

图8 (a) 细胞129Xe Hyper-CEST成像和(b) CEST效果
2.4 探针a的细胞毒性检测
图9显示了采用MTT法检测的探针a的细胞毒性,表明即使使用浓度高达100 μmol/L的探针a,A549细胞存活率仍可以大于80%,这证明该探针具有良好的生物相容性.前面实验使用的探针浓度最高为30 μmol/L,因此对A549细胞不会产生明显的细胞毒性,这证明该探针适用于MRI测试.

图9 探针a对A549细胞的毒性测试
3 结论
我们合成了一种新型的超灵敏的穴番衍生物129Xe探针,该探针由穴番和Cat B响应的二肽组成,并成功用于获得溶液和细胞的CEST NMR谱,而且灵敏度较高.与正常细胞相比,该探针a的CEST信号强度在与A549细胞孵育时显着增加,证明了其检测肺癌细胞的能力.我们还将该探针用于低浓度溶液和细胞的CEST成像,并获得了明显的成像对比效果,进一步证明了该探针可用于Cat B的超灵敏检测.
致谢:
感谢国家自然科学基金资助项目国家自然科学基金资助项目(91859206,81625011);国家重点研发计划(2016YFC1304704);中国科学院前沿科学重点研究计划(QYZDY-SSWSLH018).
利益冲突:
无
[1] López-otín C, Matrisian L M. Emerging roles of proteases in tumorsuppression[J]. Nat Rev Cancer, 2007, 7(10): 800-808.
[2] Sinha A A, Jamuar M P, Wilson M J, et al. Plasma membrane association of cathepsin B in human prostate cancer: biochemical and immunogold electron microscopic analysis[J]. Prostate, 2001, 49(3): 172-184.
[3] MAHMOOD U, TUNG C H, BOGDANOV A JR, et al. Near-infrared optical imaging of protease activity for tumor detection[J]. Radiology, 1999: 213(3): 866-870.
[4] HABIBOLLAHI P, FIGUEIREDO J, HEIDARI P, et al. Optical imaging with a Cathepsin B activated probe for the enhanced detection of esophageal adenocarcinoma by dual channel fluorescent upper GI endoscopy[J]. Theranostics, 2012, 2(2): 227-234.
[5] RYAN L S, LIPPERT A R. Ultrasensitive chemiluminescent detection of cathepsin B: insights into the new frontier of chemiluminescent imaging[J]. Angew Chem Int Ed Engl, 2018, 57(3): 622-624.
[6] TASSALI N, KOTERA N, BOUTIN C, et al. Smart detection of toxic metal ions, Pb2+and Cd2+, using a129Xe NMR-based sensor[J]. Anal Chem, 2014, 86(3): 1783-1788.
[7] GAO D L, SUN P, ZHANG X, et al. Interactions between albumin and fatty acids studied by NMR spectroscopy[J]. Chinese J Magn Reson, 2018, 35(3): 338-344.
高东莉, 孙鹏, 张许, 等. 运用NMR研究白蛋白与脂肪酸的相互作用[J]. 波谱学杂志, 2018, 35(3): 338-344.
[8] PALANIAPPAN K K, FRANCIS M B, PINES A, et al. Molecular sensing using hyperpolarized xenon NMR spectroscopy[J]. Israel J Chem, 2014, 54(1/2): 104-112.
[9] WALKER T, HAPPER W. Spin-exchange optical pumping of noble-gas nuclei[J]. Rev Mod Phys, 1997, 69(2): 629-642.
[10] ZHOU X, SUN X P, LUO J, et al. Production of hyperpolarized Xe-129 gas without nitrogen by optical pumping at Cs-133 D-2 line in flow system[J]. Chin Phys Lett, 2004, 21(8): 1501-1503.
[11] ZHOU X, GRAZIANI D, PINES A. Hyperpolarized xenon NMR and MRI signal amplification by gas extraction[J]. Proc Natl Acad Sci U S A, 2009, 106(40): 16903-16906.
[12] ZHAO X C, SUN X P, ZHOU X, et al. Measuring polarization of hyperpolarized xenon-129 gas with low-field NMR[J]. Chinese J Magn Reson, 2016, 33(3): 458-467.
赵修超, 孙献平, 周欣, 等. 超极化气体氙-129的低场NMR测量[J]. 波谱学杂志, 2016, 33(3): 458-467.
[13] WANG Y F, DMOCHOWSKI I J. An expanded palette of xenon-129 NMR biosensors[J]. Acc Chem Res, 2016, 49(10): 2179-2187.
[14] YUAN C L, GUO Q N, CHEN S Z, et al. A novel molecular cage for hyperpolarized129Xe based on cucurbit[6]uril nanoparticles [J]. Chinese J Magn Reson, 2019, 36(4): 472-480.
袁晨露, 郭茜旎, 陈世桢, 等. 新型葫芦[6]脲纳米颗粒超极化129Xe"分子笼"研究[J]. 波谱学杂志, 2019, 36(4): 472-480.
[15] TASSALI N, KOTERA N, BOUTIN C, et al. Smart detection of toxic metal ions, Pb2+and Cd2+, using a Xe-129 NMR-based sensor[J]. Anal Chem, 2014, 86(3): 1783-1788.
[16] ZHANG J, JIANG W P, LUO Q, et al. Rational design of hyperpolarized xenon NMR molecular sensor for the selective and sensitive determination of zinc ions[J]. Talanta, 2014, 122: 101-105.
[17] GUO Q N, ZENG Q B, JIANG W P, et al. A molecular imaging approach to mercury sensing based on hyperpolarized Xe-129 molecular clamp probe[J]. Chem Eur J, 2016, 22(12): 3967-3970.
[18] YANG S J, JIANG W P, REN L L, et al. Biothiol xenon MRI sensor based on thiol-addition reaction[J]. Anal Chem, 2016, 88(11): 5835-5840.
[19] ZENG Q B, GUO Q N, YUAN Y P, et al. Mitochondria targeted and intracellular biothiol triggered hyperpolarized129Xe magnetofluorescent biosensor[J]. Anal Chem, 2017, 89(4): 2288-2295.
[20] BERTHAULT P, DESVAUX H, WENDLINGER T, et al. Effect of pH and counterions on the encapsulation properties of xenon in water-soluble cryptophanes[J]. Chemistry, 2010, 16(43): 41-46.
[21] RIGGLE B A, WANG Y, DMOCHOWSKI I J. A “smart” Xe-129 NMR biosensor for pH-dependent cell labeling[J]. J Am Chem Soc, 2015,137(16): 5542-5548.
[22] WEI Q, SEWARD G K, HILL P A, et al. Designing Xe-129 NMR biosensors for matrix metalloproteinase detection[J]. J Am Chem Soc, 2006, 128(40): 13274-13283.
[23] CHAMBERS J M, HILL P A, AARON J A, et al. Cryptophane xenon-129 nuclear magnetic resonance biosensors targeting human carbonic anhydrase[J]. J Am Chem Soc, 2009, 131(2): 563-569.
[24] YANG S J, YUAN Y P, JIANG W P, et al. Hyperpolarized Xe-129 magnetic resonance imaging sensor for H2S[J]. Chemistry-A European Journal, 2017, 23(32):7648-7652
[25] ROY V, BROTIN T, DUTASTA J P, et al. A cryptophane biosensor for the detection of specific nucleotide targets through xenon NMR spectroscopy[J]. Chemphyschem, 2007, 8(14): 2082-2085.
[26] KHAN N S, RIGGLE B A, SEWARD G K, et al. Cryptophane-folate biosensor for Xe-129 NMR[J]. Bioconjugate Chem, 2015, 26(1): 101-109.
[27] PALANIAPPAN K K, RAMIREZ R M, BAJAJ V S, et al. Molecular imaging of cancer cells using a bacteriophage-based129Xe NMR biosensor[J]. Angew Chem Int Ed, 2013, 52(18): 4849-4853.
[28] ROSSELLA F, ROSE H M, WITTE C, et al. Design and characterization of two bifunctional cryptophane A-based host molecules for xenon magnetic resonance imaging applications[J]. Chempluschem, 2014, 79(10): 1463-1471.
[29] WITTE C, MARTOS V, ROSE H M, et al. Live-cell MRI with xenon Hyper-CEST biosensors targeted to metabolically labeled cell-surface glycans[J]. Angew Chem Int Ed, 2015, 54(9): 2806-2810.
[30] ROSE H M, WITTE C, ROSSELLAA F, et al. Development of an antibody-based, modular biosensor for Xe-129 NMR molecular imaging of cells at nanomolar concentrations[J]. Proc Natl Acad Sci U S A, 2014, 111(32): 11697-11702.
[31] SCHLUNDT A, KILIAN W, BEYERMANN M, et al. A xenon-129 biosensor for monitoring MHC-peptide interactions[J]. Angew Chem Int Ed, 2009, 48(23): 4142-4145.
[32] BOUTIN C, STOPIN A, LENDA F, et al. Cell uptake of a biosensor detected by hyperpolarized Xe-129 NMR: The transferrin case[J]. Bioorg Med Chem, 2011, 19(13): 4135-4143.
[33] KOTERA N, DUBOST E, MILANOLE G, et al. A doubly responsive probe for the detection of Cys4-tagged proteins[J]. Chem Commun, 2015, 51(57): 11482-11484.
[34] BROKER L E, HUISMAN C, SPAN S W, et al. Cathepsin B mediates caspase-independent cell death induced by microtubule stabilizing agents in non-small cell lung cancer cells[J]. Cancer Research, 2004, 64: 27-30
Cathepsin B Triggered Hyperpolarization129Xe MRI Probe for Ultra-Sensitive Lung Cancer Cells Detection
1,2#,1#,1,1,1*
1. State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, National Center for Magnetic Resonance in Wuhan (Wuhan Institute of Physics and Mathematics, Innovation Academy for Precision Measurement Science and Technology, Chinese Academy of Sciences), Wuhan 430071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China
Cathepsin B (Cat B) is a lysosomal cysteine protease that plays an essential role in cellular metabolism. Cat B is overexpressed in lung cancer cells. Fluorescence imaging techniques have been developed for measuring intracellular Cat B levels, which, however, suffers from limited penetration depth and interferences from autofluorescence background. To resolve these technical difficulties, we designed a novel Cat B biosensor detected by hyperpolarized xenon magnetic resonance imaging. It consists of a cryptophane cage as a129Xe NMR reporter and an amide bond as a Cat B-specific cleavable group. When the biosensor interacts with Cat B, the cleavage of amide bond leads to changes in129Xe chemical shift. Combing with hyperpolarization-chemical exchange saturation transfer (Hyper-CEST), our biosensor provides a novel method for responsive detection of Cat B.
nuclear magnetic resonance (NMR), contrast agents, lung cancer, hyperpolarization129Xe MRI probe, cathepsin B, chemical exchange saturation transfer (CEST)
O482.53
A
10.11938/cjmr20202828
2020-04-25;
2020-05-14
国家自然科学基金资助项目(91859206,81625011);国家重点研发计划(2016YFC1304704);中国科学院前沿科学重点研究计划(QYZDY-SSWSLH018).
* Tel: 027-87198802, E-mail: xinzhou@wipm.ac.cn.
# 共同第一作者

