祛寒逐风颗粒对骨性关节炎大鼠炎症反应的影响
马晓程 赵亚君 毛世刚△
祛寒逐风颗粒主要由黑顺片、制川乌、秦艽、威灵仙、细辛、花椒、麸炒白术、泽泻、制龟甲、制鳖甲和川芎组成,具有温经活络、除湿消肿、活血止痛和益肾强筋之效[1]。最早是由武威汉代医简“伤寒逐风方”结合基础临床应用加减形成的药方,临床主要用来治疗风湿性关节炎、骨性关节炎、强直性脊椎炎、肩周炎等风寒痹症[2]。但是祛寒逐风颗粒对膝骨性关节炎的作用机制依然不太清晰,因此,本研究探讨祛寒逐风颗粒对膝骨性关节炎(KOA)大鼠炎症反应和NF-κB介导NLRP3炎性小体活化的作用,为临床使用提供理论依据。
1 材料与方法
1.1 动物与分组
SPF级别SD大鼠48只,雌性,体质量200~250 g,购买于山东大学动物实验中心(许可证号为SCXK(鲁)2019-0001),随机分为假手术组、模型组、祛寒逐风颗粒3 g/kg(低剂量组)、祛寒逐风颗粒6 g/kg(中剂量组)、祛寒逐风颗粒9 g/kg(高剂量组)、阳性对照组(双氯芬酸钠肠溶片,4 mg/kg),各8只。
1.2 主要试剂
双氯芬酸钠肠溶片(北京诺华制药有限公司,国药准字H11021640),IL-1β(货号1910122)、TNF-α(货号1917202)和IL-6(货号1910602)大鼠ELISA试剂盒(达科为,北京),p-p65(3033号)、p65(8242号)、p-IκBα(8219号)、NLRP3(15101号)、Caspase-1 p20(4199号)、IL-1β p17(12703号)抗体均购自CST(美国)。
1.3 KOA模型建立
如前所述,采用前交叉韧带横断(ACLT)外科手术建立大鼠模型[3]。异氟烷-氧气麻醉大鼠,固定于实验操作台,用电动剪刀将左后肢的前部刮毛并用乙醇清洗。沿膝盖骨内侧边界垂直切开膝盖骨周围的皮肤。将膝盖骨横向移位,露出前交叉韧带。随后,用手术剪刀将前交叉韧带切开,不损伤胫骨软骨。然后将膝盖骨放回原处,并用缝合线闭合筋膜和皮肤。手术后肌肉注射4 d氨苄青霉素(4 × 104U/d),假手术组在没有其他任何处理的情况下缝合伤口。
1.4 药物干预处理
根据体表面积法将人体剂量折算为大鼠剂量,同时根据之前文献描述给药[4],祛寒逐风颗粒3 g/kg(低剂量组)、祛寒逐风颗粒6 g/kg(中剂量组)、祛寒逐风颗粒9 g/kg(高剂量组)灌胃给予相对应的药物剂量,阳性药组给予双氯芬酸钠肠溶片4 mg/kg,假手术组和模型组均给予等体积生理盐水。
1.5 机械性痛阈值测量
机械止痛仪(BME-404,天津)评估后爪缩回的机械性异常性疼痛,简要如下:将大鼠放在金属网地板的笼子里,通过不锈钢丝(直径0.6 mm)线性增加施加力,以机械刺激后爪,施加50 g质量的临界值以防止组织损伤,重复3次,取平均值。
1.6 膝关节直径测量
游标卡尺用于评估大鼠膝关节直径,简要如下:将大鼠固定,使用游标卡尺测量大鼠的膝关节直径,连续测量3次,取平均值。
1.7 酶联免疫吸附法(ELISA)检测
大鼠腹主动脉取血,收集于1.5 mL EP管,室温静置30 min,然后于1 000g离心5 min,收集上清,根据制造商说明检测大鼠血清中IL-1β、TNF-α和IL-6含量。
1.8 实时PCR检测
称取10 mg关节软骨,根据制造商的说明用总RNA提取试剂(Vazyme,中国)提取组织RNA。使用Gene Quant Prospectrophotometer(Amersham Biosciences,美国)的分光光度法测量RNA的浓度。通过HiScriptTMQ-RT Super Mix(Fcmacs,中国)将RNA(1 μg)反转录为cDNA。qRT-PCR由SYBRs Green Master Mix (Fcmacs,中国)在iCycleriQTM5多色实时PCR检测系统(Bio-Rad,美国)进行,引物序列见表1。

表1 实时PCR引物序列
1.9 病理学检查
采用苏木精-伊红(HE)染色和阿尔新蓝染色检测软骨损伤。将大鼠离体的膝盖关节在含福尔马林的磷酸盐缓冲液中固定7 d,然后在10%EDTA脱钙液中脱钙1周,用自动组织处理装置将组织脱水,染色,显微镜拍照观察。
1.10蛋白免疫印迹法
称取10 mg关节软骨,采用蛋白提取分离试剂盒提取组织总蛋白,使用BCA试剂盒测定蛋白质浓度。使用SDS PAGE凝胶分离蛋白质(上样量20 μg),并转移至硝酸纤维素(PVDF)膜。在室温下,将膜密封在5%脱脂牛奶中2 h,并在4 ℃下与以下一抗孵育过夜:p-p65、p65、p-IκBα、NLRP3、Caspase-1 p20、IL-1β p17和β-actin(稀释比例1∶1 000)。第2天,将硝酸纤维素膜洗涤3次,并与HRP标记的山羊抗兔IgG二抗(稀释比例1∶200 000)室温孵育2 h,使用增强型化学发光试剂盒检测蛋白条带,β-actin作为蛋白内参,通过ImageJ Software 7.0进行光密度分析。
1.11统计学方法
2 结果
2.1 祛寒逐风颗粒对KOA大鼠机械性痛阈值和肿胀的影响
与假手术组比较,模型组大鼠的机械性痛阈值明显减小,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组大鼠的机械性痛阈值较模型组明显增加,差异有统计学意义(见图1a)。与假手术组比较,模型组大鼠的膝关节直径明显增加,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组大鼠的膝关节直径明显减小,差异有统计学意义(见图1b)。
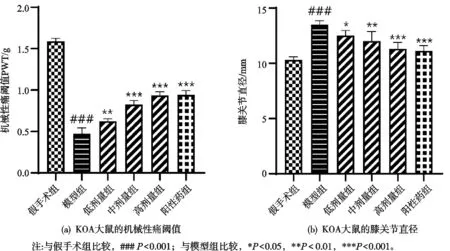
图1 祛寒逐风颗粒对KOA大鼠机械性痛阈值和膝关节直径的影响
2.2 祛寒逐风颗粒对KOA大鼠血清中炎症因子的影响
与假手术组比较,模型组大鼠血清中IL-1β、TNF-α和IL-6含量显著增加,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组较模型组大鼠血清中IL-1β、TNF-α和IL-6含量显著降低,差异有统计学意义(P<0.05),见图2(a,b)。
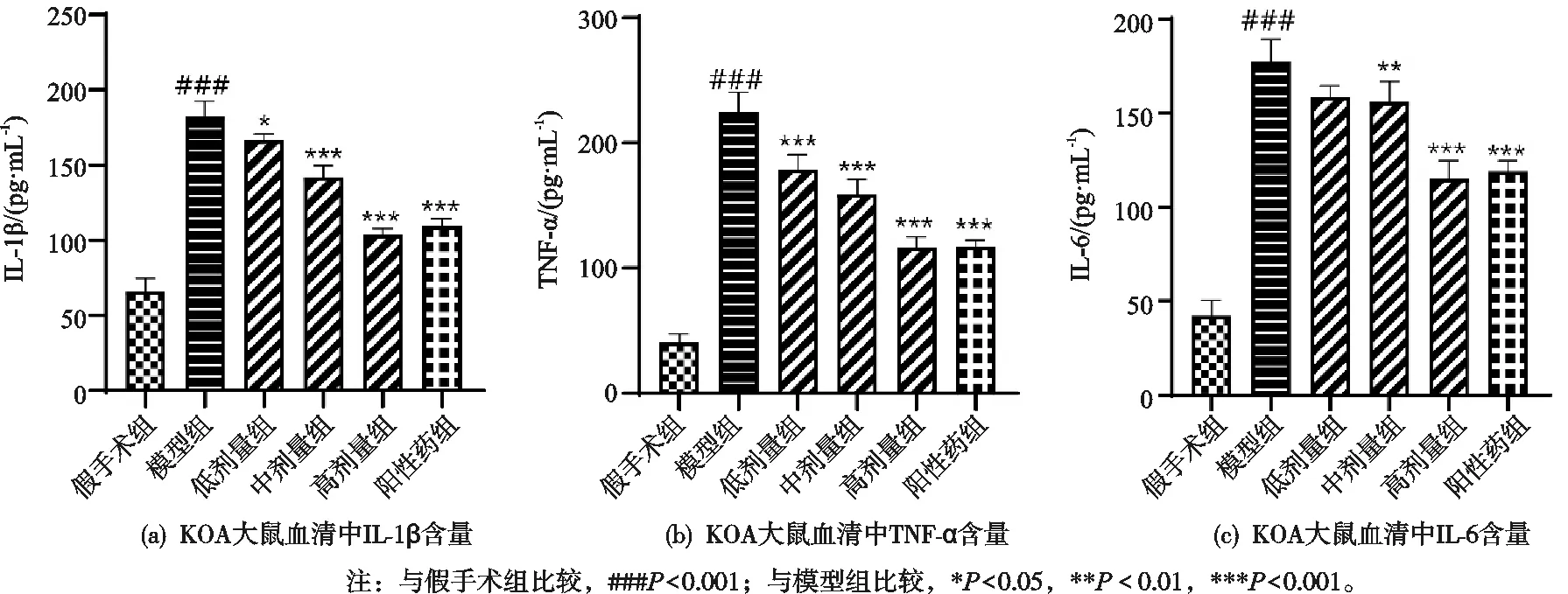
图2 祛寒逐风颗粒对KOA大鼠血清中炎症因子的影响
2.3 祛寒逐风颗粒对KOA大鼠组织中炎症因子的影响
与假手术组比较,模型组大鼠组织中IL-1β、TNF-α和IL-6 mRNA水平显著上调,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组较模型组大鼠组织中IL-1β、TNF-α和IL-6 mRNA水平显著下调(P<0.05),差异有统计学意义,见图3(a,b)。
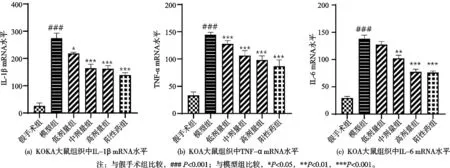
图3 祛寒逐风颗粒对KOA大鼠组织中炎症因子的影响
2.4 祛寒逐风颗粒对KOA大鼠病理学变化的影响
病理组织学检查发现假手术组大鼠膝关节软骨组织正常,模型组大鼠膝关节出现严重变性,并伴有严重的软骨损伤和大规模的软骨纤维化,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组较模型组大鼠的软骨损伤和软骨纤维化缓解,见图4。

图4 祛寒逐风颗粒对KOA大鼠病理学变化的影响(黄色三角形表示基质损伤;红色三角形表示软骨变性)
2.5 祛寒逐风颗粒对KOA大鼠软骨组织中NLRP3炎性小体活化的影响
与假手术组比较,模型组大鼠软骨组织中Caspase-1 p20、IL-1β p17和NLRP3含量显著增加,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组较模型组大鼠血清中Caspase-1 p20、IL-1β p17和NLRP3含量显著降低(P<0.05),差异有统计学意义,见图5。
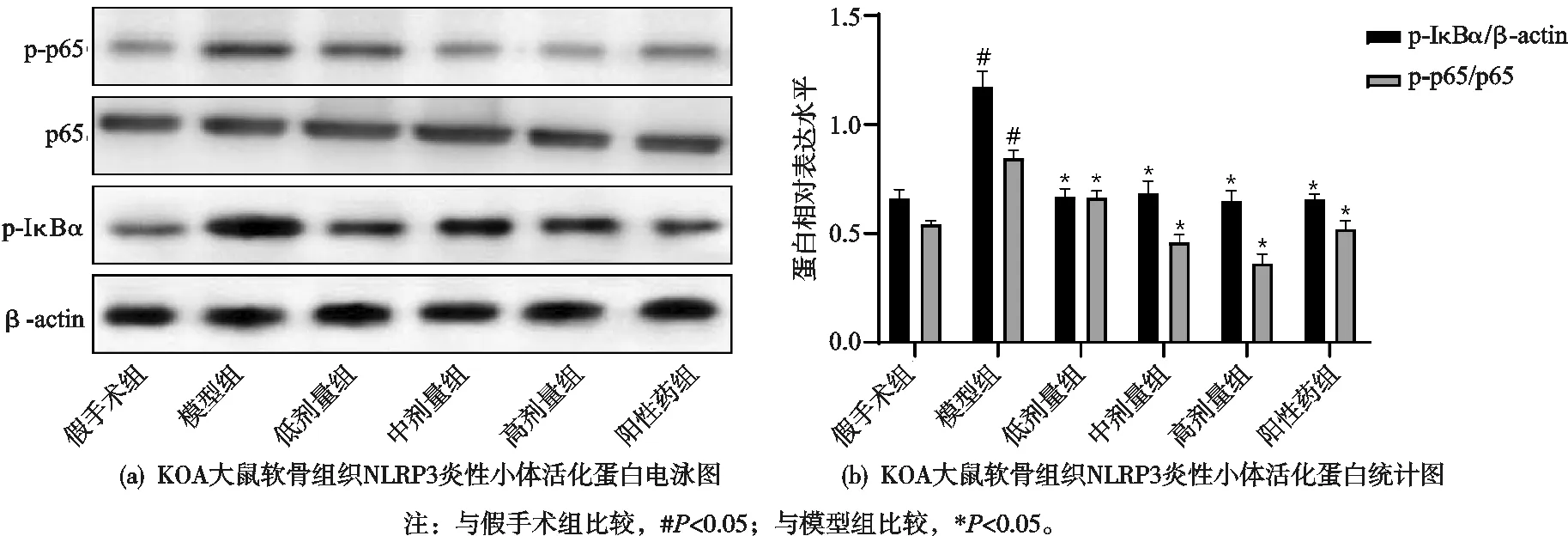
图5 祛寒逐风颗粒对KOA大鼠软骨组织中NLRP3炎性小体活化的影响
2.6 祛寒逐风颗粒对KOA大鼠滑膜组织中NF-κB信号活化的影响
与假手术组比较,模型组大鼠软骨组织中p-p65和p-IκBα含量显著增加,祛寒逐风颗粒低剂量组、中剂量组、高剂量组和阳性药组较模型组大鼠血清中p-p65和p-IκBα含量显著降低,差异有统计学意义(P<0.05),见图6。
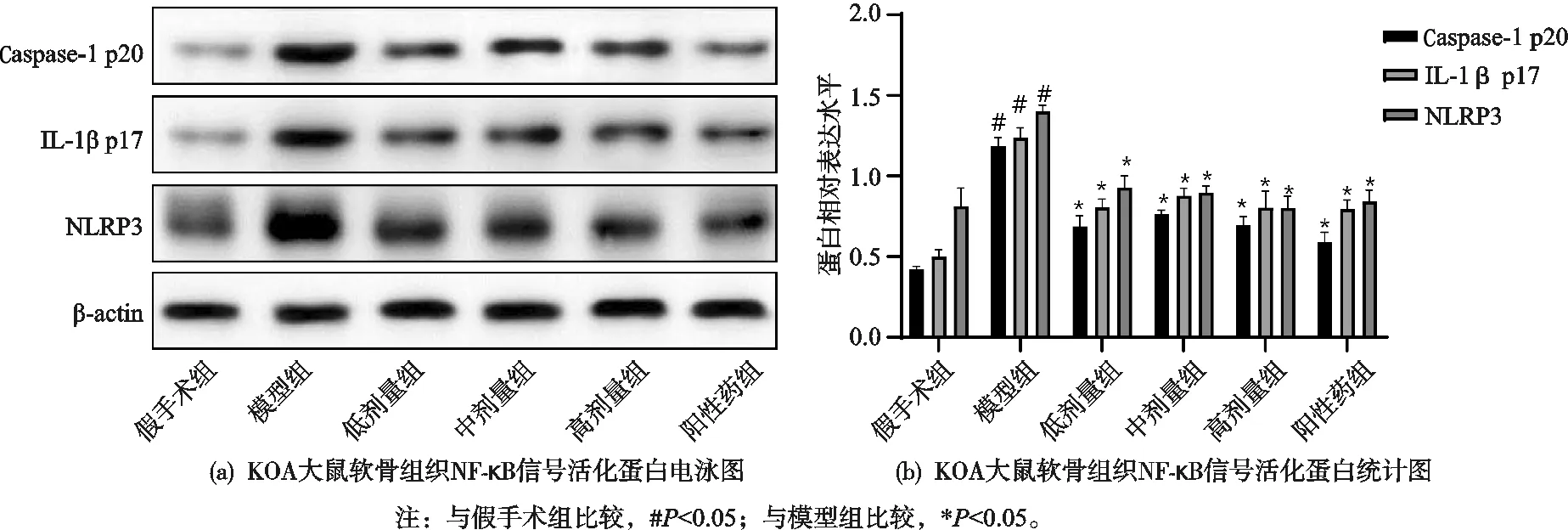
图6 祛寒逐风颗粒对KOA大鼠软骨组织中NF-κB信号活化的影响
3 讨论
骨关节炎属中医学“骨痹”“筋痹”范畴,发病与肾虚关系密切,本病病机为本虚标实,肝肾亏虚为其本,风寒湿痹阻经脉为其标,加之本病迁延难愈,日久成瘀,故中医临床多从补益肝肾、祛风除湿、散寒止痛、活血化瘀等方面治疗[5]。祛寒逐风颗粒以黑顺片、制川乌、秦艽、威灵仙、细辛、花椒、麸炒白术、泽泻、制龟甲、制鳖甲和川芎为处方,主要以黑顺片和制川乌为君药,两药同用,通十二经,走里达表,黑顺片具有逐风寒湿邪之功效,制川乌祛风除湿,温经止痛,秦艽祛风湿,退虚热,舒筋止疼,威灵仙祛风除湿,通络止痛,细辛和花椒祛风散寒,麸炒白术和泽泻具有除湿之功效,再加具有补肾和化瘀之效的制龟甲、制鳖甲和川芎,故祛寒逐风颗粒具有温经活络、除湿消肿、活血止痛和益肾强筋之效[6]。本研究发现祛寒逐风颗粒对骨关节炎具有治疗作用,并且能够抑制KOA大鼠的炎症反应和NF-κB介导的NLRP3炎性小体活化。
炎症反应和软骨损伤是骨关节炎的典型病理特征,尽管KOA病因尚不清楚,但炎症与骨关节炎病理发展密切相关[7-9]。关节发炎可直接导致KOA疼痛发作,加剧软骨损伤,并可能导致持续的疼痛敏感性,最终演变为慢性疼痛[10]。本研究发现祛寒逐风颗粒能够缓解KOA大鼠的膝关节肿胀和疼痛,并且抑制炎症因子的释放。中药黑顺片具有抗炎活性,制川乌对小鼠慢性炎症性疼痛具有缓解作用,秦艽对多种动物炎症模型均表现良好的抗炎活性。除此之外,秦艽的主要活性成分龙胆苦苷对早期炎症反应具有缓解作用,同时还具有抗炎镇痛、保肝及抗肿瘤等多种活性,威灵仙所含活性成分齐墩果酸具有抗炎活性,综合考虑,祛寒逐风颗粒处方具有普遍的抗炎和镇痛活性,最后对骨关节炎起到治疗作用[11-13]。
研究人员发现在KOA的早期阶段,靶向炎症反应可以延迟或预防膝关节软骨损伤和骨赘形成[14]。滑膜组织中的滑膜成纤维细胞是滑膜炎的效应细胞,并且是人体组织和器官中的特定驻留细胞,主要功能是在伤口愈合期间维持细胞外基质(ECM)并促进恢复和健康[15]。IL-1β是与KOA发病有关的关键炎症因子。关于IL-1β的抗炎研究非常广泛,可以独立诱导与多种信号传导机制相关的炎症反应和分解代谢作用,同时IL-1β与KOA疼痛高度相关[16]。例如,IL-1β阻止软骨细胞合成ECM,并干扰Ⅱ型胶原和蛋白聚糖的合成。IL-1β通过自分泌途径直接影响关节的滑膜细胞和软骨细胞,并增加一系列细胞因子和酶(例如PGE2和IL-6)的产生[14]。本研究发现祛寒逐风颗粒能够抑制KOA大鼠炎症反应,降低血清中IL-1β、IL-6和TNF-α含量,病理学发现祛寒逐风颗粒能够缓解大鼠膝关节软骨损伤和纤维化。
近年NLRP3炎性小体在炎症中的作用引起了人们的关注,并且对自身免疫性疾病、神经退行性疾病、代谢性疾病进行了大量研究[17]。研究证实NLRP3介导的慢性无菌性炎症研究正变得越来越普遍,并且KOA中也发现了NLRP3活化[18]。NLRP3炎性小体与KOA的发病机理密切相关,NLRP3炎性小体对于IL-1β的调节和释放起着至关重要的作用,并涉及KOA的软骨破坏和炎症反应[19]。NLRP3激活的两个信号模型调控,包括第一步转录水平的激活信号和第二步装配的激活信号[20]。最终,NLRP3,ASC和Caspase-1结合形成炎性小体,pro-Caspase-1转换为Caspase-1 p20,后者将pro-IL-1β转换为成熟的活性形式(IL-1β)。在关节疾病的研究中发现,Caspase-1是骨关节炎和软骨加速破坏的危险因素之一[21]。核因子-κB(NF-κB)信号是体内重要的NLRP3炎性小体激活的调节通路,细胞正常情况下,NF-κB和抑制蛋白IκBα在细胞质中以无活性复合物的形式存在,外源性刺激、活性氧的积累或有毒代谢产物可促进IκBα磷酸化和泛素化,从而导致NF-κB磷酸化并转运至细胞核[22]。NF-κB途径的激活可能触发NLRP3的表达和NLRP3炎性小体的组装[23]。同时,NF-κB信号活化也能够调节促炎细胞因子IL-1β、IL-6和TNF-α的释放,参与KOA的病理形成和发展[24]。本研究发现祛寒逐风颗粒能够抑制KOA大鼠软骨组织中NF-κB信号通路活化,同时也能够抑制NLRP3炎性小体活化。
综上所述,本研究发祛寒逐风颗粒可能通过抑制NF-κB介导的NLRP3炎性小体活化显着改善KOA大鼠的炎症反应并缓解疼痛,对骨关节炎发挥治疗作用。但是祛寒逐风颗粒含有多种中药材,其成分复杂以及靶点较多,仍需进一步探索。

