Ⅱ型心肾综合征动物模型研究进展
查玉玲,孔淼,周育平*,张文杰
(1.中国中医科学院广安门医院,北京 100053;2.北京中医药大学,北京 100029)
心肾综合征(Cardiorenal Syndrome,CRS)是心脏或肾中某一器官发生急性或慢性病变引起另一个器官的急性或慢性病变[1],分为5种亚型。I型和II型是指心力衰竭(heart failure,HF)引起肾功能损害。研究表明,大于1/4的HF患者合并肾功能不全[2],肾损害是HF死亡的独立危险因素[3]。由于I型CRS起病急,发病快,病情重和致死率高,临床治疗措施局限,而II型CRS是许多心血管疾病的共同转归和结局,是近年HF领域研究的焦点,因此本文主要研究II型CRS动物模型。
CRS机制研究主要包括:血流动力学异常(静脉淤血及灌注不足),神经内分泌紊乱、炎症反应、氧化应激、内皮功能异常和贫血等[4],主要生物标记物包括:中性粒细胞明胶酶相关载脂蛋白(NGAL)、B型钠酸肽(BNP)或NT-proBNP、Galectin-3、a-Klotho蛋白、胱抑素C(CysC)等[5]。有关CRS发病机制研究已有进展,但尚不明确,寻找合适的动物模型有助于明确CRS病理过程,系统探究其内在规律。
1 单一模型
1.1 心力衰竭动物模型
血流动力学改变是CRS发病最初驱动力。HF发生时,心输出量减少导致肾灌注不足,以及中心静脉压(CVP)升高,肾静脉淤血,均可造成肾小球滤过率下降。过度激活的肾素血管紧张素醛固酮系统(RAAS)导致血管收缩,水钠潴留,血管内皮功能受损,血管弹性降低,血压升高,加重肾灌注受损。因此HF模型从理论上可以作为CRS模型使用。
1.1.1 冠状动脉结扎动物模型
冠脉结扎通过造成冠脉管腔变窄,影响心脏血流供应,长期易导致心衰,与人类缺血性心衰机制相似,冠状动脉结扎(MI)术是构建心梗后HF的经典模型。Harrison等[6]通过MI术构建2型CRS模型,术后90 d大鼠出现心梗后HF,心室重量增加,左室舒张功能受损且压力升高,肌酐清除率明显降低,肾基底膜增厚,肾小球滤过率降低。该模型提供了由HF导致肾损伤的确凿的形态、生化和功能证据,是2型CRS代表模型。郝慧鑫[7]采用MI术,6周后观察到小鼠肾破坏明显,小鼠心脏、肾纤维化(肾小球和间质)程度、NGAL表达量、血肌酐(SCr)水平明显升高。Krishnan等[8]采用MI术,观察到大鼠心室后壁变薄,炎性细胞浸润,肾纤维化,肾小管坏死。Qiu等[9]采用MI术,28 d后大鼠左室收缩末和舒张末内径显著升高,左室射血分数(LVEF)和短轴缩短率(LVFS)显著降低,肾主动脉阻力指数升高,血管紧张素II(AngII)、尿素氮(BUN)、环磷鸟苷(cGMP)和SCr浓度升高,肾小管扩张明显,肾间质可见大量炎性细胞浸润。
虽然MI术在确定终点事件时操作方法不尽相同,最终病理变化也存在差异,但都成功模拟出CRS病理过程。目前此类模型成模观察时间在4~6周[6],造模的成功率与结扎部位高低以及操作人员熟练能力有直接关系,目前成功率一般>70%[6-7,9]。Duan等[10]提出MI术能激活大鼠体内RAAS系统,实验中注射外源性AngII可以增加HF大鼠的氧化应激反应。
1.1.2 主动脉缩窄动物模型
主动脉缩窄(TAC)术通过造成主动脉血流受阻,血压增高,诱导左室增生肥厚,是研究压力负荷性HF的常见模型。Kamal等[11]通过TAC术构建CRS模型,术后4~6周小鼠开始出现HF,当小鼠出现晚期非缺血性慢性HF时,小鼠SCr和肾损伤标记物1(KIM-1)表达增加,心肾出现纤维化。研究显示HF小鼠模型诱导肾功能恶化、肾小管间质重塑和炎症发展无需手术操作来实现,优于缺血性心脏损伤和肾损伤相结合的方法,减少了实验创伤。Zhao等[12]采用TAC术,术后8周小鼠心脏β-肌球蛋白重链(β-MHC),基质纤连蛋白和促炎性肿瘤坏死因子-α(TNF-α)明显增加,同时小鼠肾小球足细胞标志物podocalyxin的表达受到抑制,出现纤连蛋白和Snail1的肾表达。这表明TAC可能触发了心脏Wnt/β-catenin途径激活心脏RAAS和促炎性细胞因子释放,而循环细胞因子(例如TNF-α)反向抑制了肾中的klotho蛋白表达,从而导致肾损伤。
TAC术可重复性强,且HF呈现渐进性发展,可以观察心脏从代偿走向失代偿的生理病理变化,可以很好地模拟CRS病理过程。目前此类模型成模观察时间在4~8周[11-12],有研究提示近心端结扎腹主动脉缩窄术致CHF症状及程度更明显,但是成活率相对降低,为60%,实验难度相对增大[13]。
1.1.3 自发性高血压模型
自发性高血压(SHR)模型多用于高血压研究,与RAAS、NO、免疫炎症、血管功能障碍等机制有关[14]。Zhang等[15]发现老年雄性SHR大鼠9周龄时收缩压开始升高,65周>150 mmHg,平均动脉压(199.0±8.1)mmHg;左室肥厚(LVH)随年龄增加而增加,且老年SHR大鼠RAAS活性增强,尿蛋白和白蛋白排泄增加,出现肾小球硬化和坏死、肾小管细胞凋亡、肾间质淋巴细胞浸润、心肾小血管内皮细胞和平滑肌细胞凋亡等现象。
SHR模型在自然条件下产生的,与人类相应疾病近似,很好地模拟临床心肾损伤的自然过程。其成模周期、成模率不需要实验者考虑,比较便捷,但目前由于其仍受到培养周期长、环境要求高、动物价格高等因素的影响,所以在实际应用中仍受到一定的限制[16]。
1.1.4 给药动物模型
Angelini等[17]腹腔注射野百合碱(MCT)30 mg/kg诱发肺动脉高压性右室衰竭,术后大鼠出现较高BNP水平,血清促炎型细胞因子、胰蛋白酶、肾和心脏组织NGAL水平升高,右室肥厚扩张,伴有胸腹腔积液出现。Matsushita等[18]使用注射氯化钾联合心肺复苏法诱发急性CRS模型,术后小鼠出现急性肾损伤,表现出少尿、肾小球滤过率降低、肾小管上皮细胞损伤/死亡、炎症浸润等现象。该模型死亡率高,可重复性低,实验稳定性较差。欧阳过等[19]采用腹腔注射阿霉素3 mg/kg,术后模型大鼠心肾功能出现损伤,心肌及肾组织细胞凋亡率、血清NTproBNP、KIM-1含量均增加。
本模型与人体CRS发生过程存在一定差异。目前在给药模型中,野百合碱模型成模率在70%~80%,造模时间在4周左右,有研究提示50 mg/kg剂量组野百合碱诱导的动物模型更为接近大鼠肺动脉模型的理想数值[20]。氯化钾联合心肺复苏法成模率在37%~60%,临床死亡率较高,造模时间在7周左右[18}。阿霉素注射临床成模率在40%~60%,与阿霉素的注射速度、累积剂量均有关联,有研究提示以2 mL/kg体重剂量腹腔注射,每周1次,共6周,累积总量24 mg/kg体重可以构建心衰模型[21]。
1.1.5 动静脉瘘动物模型
Aboryag等[22]采用肾下主动脉腔瘘(ACF)法构建大鼠HF模型,术后28 d大鼠心肺重量指数明显增加,CVP、左室舒张末期压力和容积、左室收缩末期容积显著升高,LVEF显著降低,肾小球出现萎缩性改变,Bowman腔变宽,肾小球结构、近曲小管结构明显改变,出现上皮脱落和刷缘丢失等现象,这些发现提供了HF导致肾损伤的形态学证据,支持了CRS的病理过程。Abu等[23]采用大鼠腹主动脉和下腔静脉间造瘘术,术后大鼠尿流量和肾小球滤过率明显降低,钠排泄、肾血浆流量明显下降,肾小管损伤,尿NAGL绝对排泄量显著增加。
动静脉瘘手术造成局部血流动力学改变,可以用于研究血流动力学对CRS的影响,然而小动物静脉薄且脆,临床上大动物模型的解剖结构更接近于临床状况,因此血液动力学剪切应力研究一般选用大型动物模型[24-25]。目前动静脉瘘成模时间为(28±2)d[22],大型动物模型临床成模率较高,大部分在90%~100%,但是大型动物模型实验成本较高[25]。
1.2 转基因小鼠模型
基因小鼠模型目前被认为是最具前景的动物模型。Pleasant等[26]采用心肌细胞特异性高表达突变体αβ-晶体蛋白的转基因小鼠模型,与野生型(WT)相比,转基因小鼠的SCr、NAGL、肾小管肾素蛋白表达均明显增高,这些为无症状HF小鼠模型肾内RAAS的早期活化提供了证据。Giam等[27]采用扩张型心肌病(DCM)转基因小鼠模型,发现DCM小鼠的肾小管间质和肾小球纤维化程度(分别为88%和73%)高于同龄WT小鼠,肾氧化性谷胱甘肽水平比WT小鼠高40%,舒张期和收缩期室间隔厚度分别比WT小鼠少35%和44%,收缩期左室后壁厚度比WT小鼠减少25%,这些数据说明2型CRS模型与肾炎症,谷胱甘肽缺乏和纤维化有关。Klotho基因编码的a-Klotho蛋白,在临床研究中被认为有心肾的双重保护作用。刘熹等[28]发现下调或者敲除a-Klotho基因,可以加重心、肾损伤。
转基因小鼠模型遗传背景相对稳定,突变方向人工可控,对研究CRS病理机制,开发新药物具有一定的优势。当然其操作要求更高,造模成本相应增加见表1。

表1 II型CRS单一模型一览表Figure 1 List of type II CRSsingle models
2 复合动物模型
与单式模型相比,复合模型在展现心肾之间互为影响的病理过程时更加贴近临床实际。但是在临床研究中,着重点往往在于观察指标的情况,对于复合模型的造模成功率、造模时间关注较少。
2.1 冠脉结扎联合肾切除动物模型
冠脉结扎联合肾切除是目前CRS造模最常用的方法之一。韦震鸣等[29]采用MI联合5/6肾切除术,手术以心肌缺血发白,肾缺血发白面积在5/6左右为造模成功,造模两次手术间隔时间1周,存活率53.84%,这种方法不仅缩短了造模周期,降低了死亡率,而且在明显诱导出慢性心肾功能受损及心肌组织纤维化的基础上保持了器官的完整性,提高了实验的效率和稳定性。吴英智[30]采用MI联合3/4肾切除进行造模,大鼠存活77.8%,MI术后2周(肾切术后1周),模型大鼠SCr、BUN、BNP明显升高,MI术后4周(肾切术后3周),24 h尿蛋白、心脏质量指数、左肾质量指数明显升高,心脏和肾HE染色非梗死区大量炎症细胞浸润和纤维结缔组织生长。吴氏认为减少肾切面积,可简化手术过程,降低死亡率,造模早期心功能和肾功能即明显下降,符合CRS发病过程中心、肾相互作用和病程发展的的病理特点。段晓宇等[31]通过MI术结合肾急性缺血再灌注损伤制备CRS模型,术后大鼠血中Cys-C、SCr、Ang II、尿微量白蛋白(UMA)和NGAL含量均显著升高,肾损伤严重。盛晓生等[32]采用左肾切除联合MI术,造模后CRS组血清中和肽素(CPP)、SCr、尿肌酐(UCr)、BUN均显著升高,CPP作为AVP前体羧基末端的一段多肽,在血中长期保持稳定,利于检测,可作为生物标志物替代AVP的检测。
虽然构建心肾复合模型时,心肾损伤面积并没有统一的标准,但此类模型临床指标较为完善,有利于揭示心肾互相影响的临床机制。此类复合模型因为急性CRS模型和慢性CRS模型差别,造模周期存在差异。
2.2 药物联合肾切除模型
吴翔等[33]采用盐酸多柔比星腹腔注射联合5/6肾切除术,术后大鼠LVFS、LVEF明显下降,心脏组织细胞凋亡信号调节激酶1(ASK1)、心肌细胞c-Jun氨基末端激酶(JNK)、p38 mRNA和蛋白表达均明显升高,心肌细胞凋亡率明显升高,说明肾功能不全可以促进心功能不全的发展。Yang等[34]采用5/6肾切除联合腹腔注射阿霉素(累积量7.5 mg/kg)和每日高蛋白饮食诱导CRS,术后第63天时,模型大鼠BUN和Cr以及尿蛋白/肌酐显著升高。
本方法简捷高效,与单一肾切除造模时间相似[35],由于药物毒性作用很难控制剂量以及排除对其他器官的干扰,给药联合手术的方式增加了实验的难度,具有一定的局限性(见表2)。
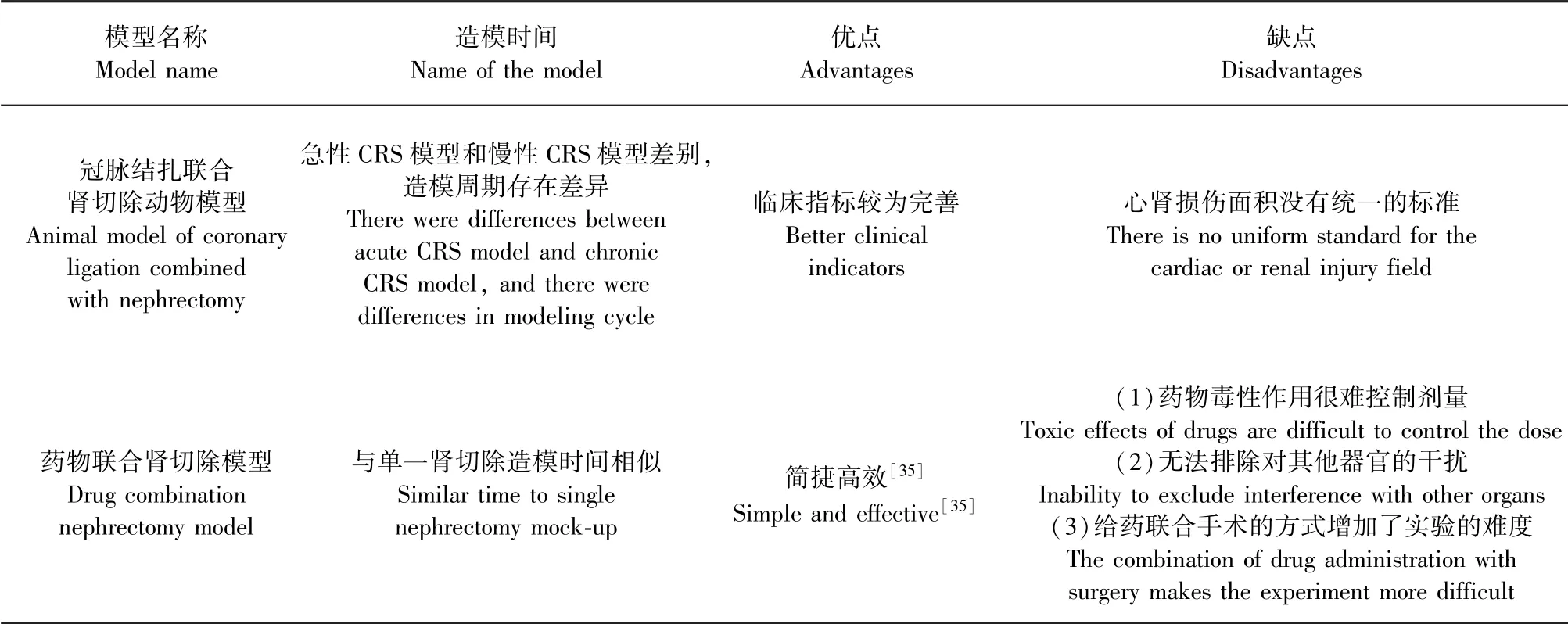
表2 II型CRS复合模型一览表Figure 2 List of type II CRScomposite models
3 讨论
无论是外科手术、药物模型、单式模型、复式模型还是转基因模型,均一定程度反映了CRS病理机制,但并非完美地模拟了CRS发病和进展过程,故需要探索优质模型以模拟心肾之交互作用,以及伴随的血液动力学和全身代偿机制的激活,为药物治疗评价提供手段。